文章信息
- 牛小东,张祎年,冉俊涛,王振伟,朱琳,陈宝余,薛敏,焦聚阳,潘亚文. 2015.
- NIU Xiaodong, ZHANG Yinian, RAN Juntao, WANG Zhenwei, ZHU Lin, CHEN Baoyu, XUE Min, JIAO Juyang, PAN Yawen. 2015.
- 甘肃省105例脑胶质瘤治疗情况回顾性分析
- Retrospective Analysis of Treatment Situation in Gansu Province: 105 Cases of Glioma
- 肿瘤防治研究, 2015, 42(06): 568-570
- Cancer Research on Prevention and Treatment, 2015, 42(06): 568-570
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.06.008
-
文章历史
- 收稿日期:2014-06-13
- 修回日期:2014-09-06
2. 730030 兰州,兰州大学第二医院神经外科;
3. 730050 兰州,甘肃省肿瘤医院放疗科;
4.730000 兰州,兰州大学第一临床医学院
2. Department of Neurosurgery, Lanzhou University Second Hospital, Lanzhou 730030, China;
3. Department of Radiotherapy, Gansu Province Tumor Hospital, Lanzhou 730050, China;
4. The First Clinical Medical College of Lanzhou University, Lanzhou 730000, China(*:Contributed Equally as First Author) Corresponding Author: PAN Yawen, E-mail: panyawen666@sohu.com
脑胶质瘤(Glioma)是神经系统肿瘤中最常见的肿瘤,在脑肿瘤中约占40%~50%,且胶质瘤具有强侵袭性和放化疗抵抗性,致死率高,预后差,平均中位生存期12~15月[1]。目前国内外脑胶质瘤的治疗原则主要是以手术为基础联合放化疗的综合治疗[2]。目前脑胶质瘤的治疗方案尤其是化疗方案类型较多,差异比较大。为明确不同化疗方案治疗脑胶质瘤的临床疗效、安全性及经济性,本研究采用回顾性分析,收集不同化疗方案治疗脑胶质瘤患者的临床资料,了解当前甘肃省胶质瘤的治疗现状,并与当前的胶质瘤诊断和治疗指南对比,分析存在的不一致及其可能的原因,为临床提供一些思考和建议。 1 资料与方法 1.1 一般资料
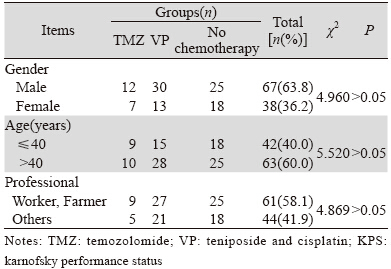
收集2011年1月—2014年1月在兰州大学第二医院和甘肃省肿瘤医院住院经手术切除并经病理学证实为脑胶质瘤,手术治疗为镜下全切或次全切,术后均采用三维适形放疗,临床资料比较完整的患者105例。男67例,女38例,男 :女为1.76,发病年龄11~71岁,平均年龄42岁,<40岁42例,≥40岁63例。KPS≥70(karnofsky performance status,KPS)。经术后病理证实,肿瘤级别Ⅰ~Ⅱ级36例,Ⅲ级38例,Ⅳ级31例。不同组间患者在性别、年龄、职业等方面比较,差异无统计学意义(P>0.05),具有可比性,见表 1。
手术方法根据患者肿瘤位置、体积大小及术前患者临床症状选择不同手术入路,所有患者均行全切或次全切。术后送病理检测,病理级别按照2007年WHO中枢神经系统分类方法分为Ⅰ~Ⅳ级胶质细胞瘤(包含不同病理分级成分的,归入较高级别)。 1.2.2 放疗
放疗主要为普通放疗和三维适行放疗,30~49天的放疗剂量为60 Gy/30 f,平均时间为42天。 1.2.3 化疗
化疗主要用烷化剂类药物,方案主要有替莫唑胺(Temozolomide,TMZ)方案、VP方案即替尼泊苷(Teniposide,VM-26)联合顺铂(Cisplatin,DDP)及其他化疗方案等。根据患者具体情况调整剂量大小和周期。TMZ方案中同步放化疗TMZ剂量为75 mg/(kg.d),非同步放化疗TMZ剂量为150~200 mg/(kg.d),治疗周期不等。VP方案中替尼泊苷(VM-26)为100 mg/d,顺铂(DDP)为20~30 mg/d,治疗周期不等。 1.3 统计学方法
采用SPSS16.0 统计学软件进行数据分析,统计各组数据百分比。计量资料以均数±标准差(x±s)表示,采用t检验;计数资料采用χ2检验。P<0.05 为差异具有统计学意义。 2 结果
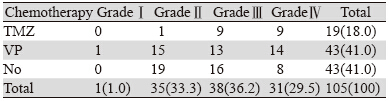
本研究收集的脑胶质瘤患者治疗方案主要为手术联合放疗,部分患者接受化疗。所有患者全部完成显微镜下全切或次全切手术治疗,放疗总剂量均为60 Gy。105例中接受化疗的患者共62例(占纳入病例总数的59.0%),化疗方案主要有TMZ方案、VP方案[替尼泊苷(VM-26)联合顺铂(DDP)]。其中接受TMZ化疗的患者19例(占纳入病例总数的18.0%);接受VP方案化疗的有43人(占纳入病例总数的41.0%),见表 2。另外,本研究高级别胶质瘤(high grade glioma,HGG)患者共69例,其中45例接受化疗,TMZ方案18人(占化疗HGG患者总数的40.0%),VP方案27人(占化疗HGG患者总数的60.0%)(χ2=2.583,P<0.05)。
 |
脑胶质瘤由于其生物学特性为浸润性生长,往往与周围神经组织的界限不清,手术很难完全切除,术后易复发。手术治疗和放疗是胶质瘤主要的治疗手段,但结果却不尽人意。虽放疗能有效减少肿瘤细胞的增殖,但在治疗时对组织也有一定潜在性损伤,而化疗可避免放疗对细胞产生亚致死性或者具有潜在致死性损伤之后的修复作用,提高放疗的敏感度,可见两者在治疗上具有一定的协同作用[3]。近年来由于化疗药物的进展,其种类逐渐增多,疗效也不断提高,化疗常是重要的治疗手段。新型化疗药替莫唑胺的出现,解决了传统化疗药难以通过血脑屏障的难题,能在脑肿瘤组织中聚集较高的浓度,以及其在体内的高活性,能更有效地杀死肿瘤细胞,从而提高化疗疗效[4, 5]。
从本研究结果可以看出:男性患者明显多于女性患者(男 :女=1.76);年龄主要分布在30~60岁间,占70%以上,这与大多数研究结论相符;从职业方面来看,工人和农民发病率较高,这可能与职业中接触到致癌物质的机会较多有关。目前对于HGG,包括我国胶质瘤诊疗指南[6, 7]在内的国际上多个指南均强烈推荐放疗期间辅助运用TMZ化疗以提高术后生存率,而本研究在69例HGG患者中,有45例接受化疗,TMZ方案仅占化疗的40.0%(χ2=2.583,P<0.05)。可见,本研究中化疗方案与指南中所推荐存在明显的不一致。通过分析,可能与以下原因有关,在患者与家属方面,主要是对医生的治疗方案理解不当,或由于化疗费用昂贵、经济条件限制等使其未按照医生的治疗计划治疗以及疾病为恶性而放弃进一步治疗。有研究表明,术后化疗能够提高脑胶质瘤特别是高级别胶质瘤的治疗效果,并有可能与放射治疗有协同作用[8, 9]。另外,医生方面的原因主要有:(1)过于偏重手术治疗,对及时有效的放化疗等辅助治疗重视不够,以致在短期内肿瘤复发。尤其是对于HGG,术后辅助放化疗显得十分的重要。(2)目前我国仍缺少专业的神经肿瘤医生,以及临床上实施辅助治疗的医生在化疗知识等方面相对缺乏。(3)由于医疗利益的驱使,存在患者接受不恰当治疗的情况。(4)临床医生较为依赖于传统化疗药。由于儿童胶质瘤与成人在临床特点上有明显的差异,对于儿童在放疗期间辅助TMZ化疗是否同样适用仍需进一步研究证实。
根据目前的研究结果,结合临床,提出以下建议:(1)临床实践指南或共识多认为是本领域诊治的“金标准”,由于临床指南的重要性和实用性,其科学性就显得更为重要。因此,临床医生关注临床指南及其质量很有必要。是否严格按照指南实施规范治疗,对胶质瘤的预后有很大的影响。(2)目前我国仍然缺乏神经肿瘤医生,应加强对患者及临床医生的临床规范化治疗知识宣教,同时应加快培养一些神经肿瘤医生,从而促进临床治疗的规范化,并在治疗时根据患者具体病情实施个体化治疗,以求达到最佳治疗效果[10]。(3)TMZ价格较贵,临床进一步推广受到一定限制,切实降低TMZ费用是解决当前最佳证据与临床实际效果矛盾的关键所在。另外,随着社会经济水平的提高,国产化生产的进一步普及,TMZ在胶质瘤治疗中将会得到更广泛的应用。(4)本研究随访时间有限,生存资料不全面,故未进行生存分析。就随访来看,一般低级别胶质瘤应每3~6月随访1次,持续5年;以后每年至少随访1次。高级别胶质瘤在放疗结束后2~6周应随访1次,以后每1~3月随访1次,持续2~3年,再以后随访间隔可适当延长[10]。
综上所述,今后临床医生应在我国脑胶质瘤共识或指南的指导下首先做到诊疗的规范化,再根据实际情况,结合临床成熟经验,通过多学科合作建立切实可行的个体化、规范化治疗方案,即“个体化治疗,规范化实施”,并从多中心、前瞻性的大样本临床试验中探索出更优的治疗方案,从而使患者获益最大化。
| [1] | Rosenfeld MR, Pruitt AA. Management of malignant gliomas and primary CNS lymphoma: standard of care and future directions[J]. Continuum(Minneap Minn), 2012, 18(2): 406-15. |
| [2] | Rolle CE, Sengupta S, Lesniak MS. Challenges in clinical design of immunotherapy trials for malignant glioma[J]. Neurosurg Clin N Am, 2010, 21(1): 201-14. |
| [3] | Ogawa K, Ishiuchi S, Inoue O, et al. Phase Ⅱtrial of radiotherapy after hyperbaric oxygenation with multiagent chemotherapy (procarbazine, nimustine, and vincristine) for high-grade gliomas:long-term results[J]. Int J Radiat Oncol Biol Phys, 2012, 82(2): 732-8. |
| [4] | Kroemer G, Galluzzi L, Brenner C. Mitochondrial membrane permeabilization in cell death[J]. Physiol Rev, 2007, 87(1): 99-163. |
| [5] | Cavaliere R, Wen PY, Schiff D. Novel therapies for malignant gliomas[J]. Neurol Clin, 2007, 25(4): 1141-71. |
| [6] | Professional neurosurgery tumors branch of the Chinese medical association. China Clinical Consensus for diagnosis and treatment in central nervous system malignant glioma(Simplified version)[J]. Zhonghua Yi Xue Za Zhi, 2009, 89(43): 3028-30. [中华医学会神经外科分会肿瘤专业组. 中国中枢神经系统恶性胶质瘤诊断和治疗共识(简化版)[J]. 中华医学杂志, 2009, 89(43): 3028-30.] |
| [7] | Editorial committee of “China Clinical Practice Guidelines for diagnosis and treatment in central nervous system glioma”. China Clinical Practice Guidelines for diagnosis and treatment in central nervous system glioma(2012 Simplified version)[J]. Zhonghua Yi Xue Za Zhi, 2012, 92(33): 2309-13.[《中国中枢神经系统胶质瘤诊断和治疗指南》编写组. 中国中枢神经系统胶质瘤诊断和治疗指南(2012精简版)[J]. 中华医学杂志, 2012, 92(33): 2309-13.] |
| [8] | Stupp R, Mason WP, van den Bent MJ, et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma[J]. N Engl J Med, 2005, 352(10): 987-96. |
| [9] | Brandes AA, Turazzi S, Bassso U, et al. A multidrug combination designed for reversing resistance to BCNU in glioblastoma multiforme[J]. Neurology, 2002, 58(12): 1759-64. |
| [10] | Chen ZP. The importance of standardized treatment for glioma[J]. Zhongguo Lin Chuang Shen Jing Wai Ke Za Zhi,2007,12(5): 257-8. [陈忠平.重视胶质瘤的规范化治疗[J].中国临床神经外科杂志, 2007, 12(5): 257-8.] |
 2015, Vol. 42
2015, Vol. 42