文章信息
- 高慧婕,李春霞,陈玉杰. 2015.
- GAO Huijie, LI Chunxia, CHEN Yujie. 2015.
- 萝卜硫素对免疫抑制小鼠的免疫调节作用
- Effects of Sulforaphane on Immunoregulation in Immunosuppression Mice
- 肿瘤防治研究, 2015, 42(06): 564-567
- Cancer Research on Prevention and Treatment, 2015, 42 (06): 564-567
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.06.007
-
文章历史
- 收稿日期:2014-09-09
- 修回日期:2015-04-13
2. 272067 济宁,济宁医学院基础学院免疫学教研室
2. Department of Immunology, Foundation College of Ji'ning Medical University, Ji’ning 272067, China
西兰花是十字花科芸苔属甘蓝种的一个变种,被誉为“蔬菜皇冠”[1]。西兰花中硫苷的酶解产物异硫代氰酸盐主要为萝卜硫素(1-异硫氰酸-4-甲磺酰基丁烷,Sulforaphane,SF),是活力最强的一类异硫氰酸盐,被认为是迄今为止在蔬菜中发现的最强的抗癌成分[2, 3]。目前临床应用的大部分抗肿瘤药物为烷化剂、抗代谢药及阻止有丝分裂的药物,有一定的免疫抑制作用[4]。尽管国外已有研究证明萝卜硫素具有一定的提高免疫力的功能[5],目前有关萝卜硫素的研究仍主要集中在萝卜硫素的抗癌活性功能,其对免疫功能的保护作用及机制尚缺乏系统和深入的研究。因此,本实验建立环磷酰胺(Cy)免疫抑制小鼠模型[6, 7],灌胃给予萝卜硫素,观察萝卜硫素对小鼠免疫功能的整体影响,从而系统评价萝卜硫素的免疫学活性,为西兰花以及萝卜硫素作为免疫调节剂和抗癌药物的研发提供帮助。 1 材料与方法 1.1 材料 1.1.1 动物
清洁级ICR系小鼠80只,体质量(20±2)g,雌雄各半,购自郑州市华兴实验动物养殖场,合格证号SCXK(鄂)2004-0007。 1.1.2 实验材料及配制
萝卜硫素购自中国上海Aladdin试剂公司(货号:S111997),注射用环磷酰胺购自中国上海Aladdin试剂公司(货号:C106991),PHA-P购自美国SIGMA公司(货号:L8754),反转录试剂盒购自美国Thermo Scientific公司,PCR试剂及PCR引物购自上海生工生物工程公司。济宁医学院动物中心提供健康鸡,抽取颈静脉血,于4℃无菌Alsever液中保存,临用前0.9%氯化钠溶液洗涤三次,配制鸡红细胞悬液。豚鼠心脏采血,然后分离血清,经鸡红细胞吸收后作为补体来源,-20℃保存,备用。 1.1.3 仪器
酶标仪购自Thermo LabSystems(上海)公司,凝胶图像分析系统MSD-2000A购自北京麦思奇公司,Sigma台式高速冷冻离心机购自德国Sigma公司,PCR仪购自美国Wealtec公司,电泳仪DYY-6C购自北京六一公司。 1.2 方法 1.2.1 动物分组及给药
80只ICR小鼠被随机分成4组,雌雄各半。萝卜硫素高、低剂量组分别按照30、15 mg/kg的剂量每日灌胃,每只0.4 ml,对照组和Cy模型组采用等体积0.9%氯化钠溶液灌胃,连续8天,每天1次。除对照组外,其余各组第5、6、7天每日腹腔注射Cy 80 mg/kg造模,对照组腹腔注射等体积0.9%氯化钠溶液。 1.2.2 小鼠血清溶血素测定
实验第3天小鼠腹腔注射5%的鸡红细胞,进行初次免疫,于最后一次给药2 h后,眼球取血2 ml。用0.9%氯化钠溶液1∶100稀释,取1 ml稀释液与0.5 ml 5%鸡红细胞混悬液、0.5 ml 10%补体(豚鼠血清)混合,37℃恒温水浴,0.5 h后立即取出,冰浴冷却后3 000 r/min离心5 min。取上清液,置酶标仪于450 nm波长测定OD值。 1.2.3 小鼠淋巴细胞转化实验
实验第5天小鼠肌肉注射PHA 8 mg/(kg·d)。最后一次给药2 h后断尾取血,均匀涂片,晾干后吉姆萨染色15 min,水洗晾干,油镜下观察外周血淋巴细胞转化率。 1.2.4 小鼠腹腔吞噬细胞吞噬功能的测定
实验第6天小鼠腹腔注射可溶性淀粉蛋白胨溶液1 ml,于最后1次给药2 h后每只腹腔注射5%鸡红细胞悬液0.4 ml,轻揉腹部,30 min后,每只小鼠腹腔注射2 ml 0.9%氯化钠溶液,轻揉腹部数次,注射器吸取小鼠腹腔液,滴50 μl于洁净的载玻片上,推成薄片,晾干后甲醇固定5 min。滴加瑞氏-吉姆萨染液,染色5 min,流水轻轻冲洗,自然晾干,油镜观察。计算小鼠腹腔巨噬细胞对鸡红细胞的吞噬率和吞噬指数。吞噬率=(100个巨噬细胞中吞噬鸡红细胞的细胞数/100)×100%;吞噬指数=(100个巨噬细胞吞噬的鸡红细胞总数/100)×100%。 1.2.5 小鼠免疫器官指数的测定
第9天称重并处死小鼠,取胸腺和脾脏,称重,根据公式计算胸腺及脾脏指数,胸腺(脾脏)指数=胸腺(脾脏)质量(mg)/体重(g)。 1.2.6 半定量RT-PCR方法检测小鼠脾细胞免疫调节基因TGF-β和PD-1mRNA的表达
小鼠处死后取脾,收集脾细胞,用TRIzol RNA提取试剂盒提取脾细胞总RNA,按照反转录试剂盒进行操作。半定量RT-PCR方法检测免疫调节基因TGF-β、PD-1 mRNA的表达水平。所用引物设计如下:TGF-β(132 bp):上游引物5'-AACAATTCCT GGCGTTACCT-3',下游引物5'-GAATCGAAAGCCCTGTATTCC-3';PD-1(236 bp):上游引物5'-CATGCCCAGGTACCTCAGTT-3',下游引物5'-GAACCCAACTCCAGGACAGA-3'。采用GAPDH(496 bp)作为内参,序列:上游引物5'-CAAGGTCATCCATGACAACTTTG-3',下游引物5'-GTCCACCACCCTGTTGCTGTAG-3'。PCR产物进行2%琼脂糖凝胶电泳,凝胶扫描分析DNA电泳条带光量子强度,以目的DNA电泳条带光量子强度与GAPDH电泳条带光量子强度比值为其表达水平的参数。 1.3 统计学方法
实验数据均以平均数±标准差(x±s)表示,组间差异比较用SPSS17.0 统计软件作方差分析,P<0.05为差异有统计学意义。 2 结果 2.1 对小鼠血清溶血素的影响
Cy模型组小鼠血清溶血素OD值(0.702±0.08)明显低于对照组(1.461±0.10),与Cy模型组相比,萝卜硫素高剂量组、低剂量组的小鼠血清溶血素OD值(1.325±0.10、1.124±0.08)均显著升高(F=270.00,P=0.000),见图 1。

|
| *: P<0.05, compared with control group; **: P<0.05, compared with cyclophosphamide(Cy) group; SF: sulforaphane 图 1萝卜硫素对免疫抑制小鼠血清溶血功能的影响 Figure 1Effect of sulforaphane(SF) on serum hemolysin function in immunodepressed mice |
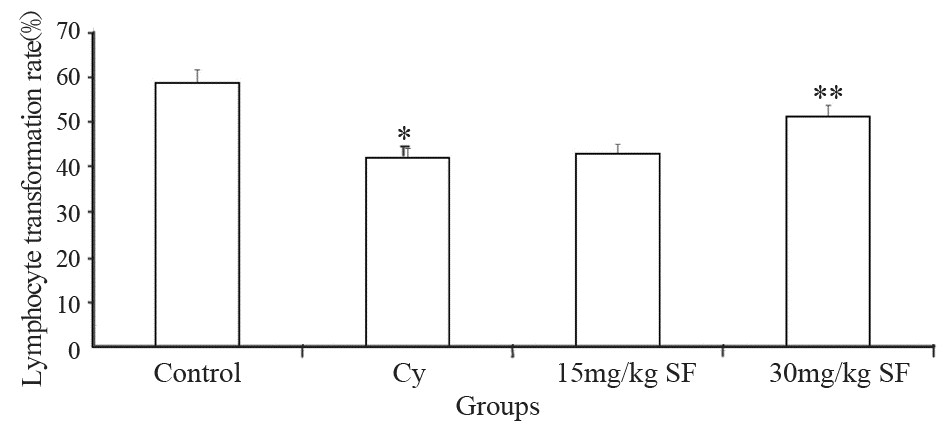
与对照组的外周血淋巴细胞转化率(58.92%)相比,Cy模型组淋巴细胞转化率(42.22%)显著减少;与Cy模型组相比,萝卜硫素高剂量组外周血淋巴细胞转化率(51.44%)显著升高,可提高免疫抑制小鼠外周血淋巴细胞转化,拮抗Cy的免疫抑制作用,但萝卜硫素低剂量组拮抗效果不明显(F=25.835,P=0.000),见图 2。
|
| *: P<0.05, compared with control group; **: P<0.05, compared with Cy group 图 2萝卜硫素对免疫抑制小鼠淋巴细胞转化率的影响 Figure 2Effect of sulforaphane on lymphocyte transformation rate in immunodepressed mice |
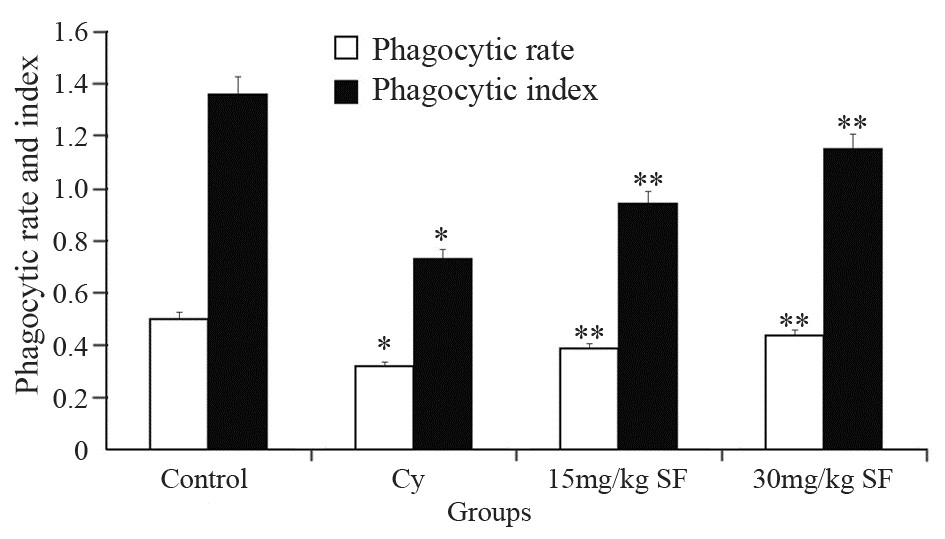
Cy模型组小鼠腹腔巨噬细胞对鸡红细胞的吞噬百分率(31.86%)和吞噬指数(0.73±0.06)均显著低于对照组(50.06%和1.36±0.09);与Cy模型组比较,萝卜硫素高、低剂量组均可提高免疫抑制小鼠腹腔巨噬细胞的吞噬功能,且萝卜硫素高剂量组提高吞噬百分率(43.56%)和吞噬指数(1.15±0.08)效果明显,差异有统计学意义(F=46.55,287.781,P=0.000),见图 3。
|
| *: P<0.05, compared with control group; **: P<0.05, compared with Cy group 图 3萝卜硫素对免疫抑制小鼠腹腔吞噬细胞吞噬功能的影响 Figure 3Effect of sulforaphane on macrophage phagocytosis in immunodepressed mice |
Cy模型组小鼠胸腺指数(1.25±0.21)和脾指数(2.73±0.26)显著低于对照组(2.24±0.32和4.24±0.45)。与Cy模型组比,萝卜硫素高、低剂量组胸腺指数和脾指数均有不同程度的提高,以萝卜硫素高剂量组(1.89±0.31和3.80±0.46)效果更为显著(F=47.514,52.119,P=0.000),见图 4。

|
| *: P<0.05, compared with control group; **: P<0.05, compared with Cy group 图 4萝卜硫素对Cy致免疫抑制小鼠胸腺指数与脾指数的影响 Figure 4Effect of sulforaphane on spleen index and thymus index in immunodepressed mice |
脾淋巴细胞TGF-β基因mRNA(132 bp)和PD-1基因mRNA(236 bp)表达的变化以GAPDH(496 bp)为内参照,经过密度扫描和公式计算相对于对照组的增高率,发现Cy模型组小鼠TGF-β的mRNA表达水平显著高于正常组,同时发现Cy亦可上调PD-1mRNA的转录及表达,萝卜硫素高、低剂量组均能有效抑制TGF-β mRNA和PD-1 mRNA的表达,并有剂量依赖性,见图 5。

|
| a: control group; b: 15mg/kg SF group; c: 30mg/kg SF group; d: Cy group; M: marker; A:GAPDH mRNA; B: TGF-β mRNA; C: PD-1 mRNA; D: histogram of TGF-β mRNA and PD-1 mRNA expression; *: P<0.05, compared with control group; **: P<0.05, compared with Cy group 图 5RT-PCR测定TGF-β mRNA和PD-1 mRNA的表达 Figure 5Expressions of TGF-β mRNA and PD-1 mRNA detected by RT-PCR |
胸腺和脾脏均为免疫器官,在免疫功能低下时胸腺、脾脏萎缩,体积变小[8]。本实验结果显示高、低剂量的萝卜硫素均能明显提高Cy降低的胸腺指数和脾脏指数,提示萝卜硫素对Cy抑制的免疫器官均有一定的保护和促进恢复正常的作用。本实验选用腹腔巨噬细胞吞噬作为非特异性免疫功能的指标、溶血素试验作为特异性体液免疫指标、淋巴细胞转化作为细胞免疫指标,观察两种不同剂量的萝卜硫素对小鼠免疫抑制模型免疫功能的调节作用。结果提示,高、低剂量的萝卜硫素均可提高腹腔巨噬细胞吞噬百分率及吞噬指数,促进溶血素的形成,高剂量的萝卜硫素可显著刺激淋巴细胞的转化。以高剂量萝卜硫素的免疫兴奋作用为强,低剂量组相对较弱,认为萝卜硫素的免疫保护作用与剂量的大小成正相关,剂量增加,免疫兴奋作用会有所增强。
有文献报道高浓度TGF-β可诱导CD4+CD25+ Treg细胞的产生及免疫抑制,同时亦可诱导Foxp3的转录[9, 10]。另有研究报道PD-1/PD-L1也参与CD4+CD25+Treg细胞活性的发挥,抗体阻断PD-1/PD-L1通路可抑制CD4+CD25+Treg细胞的免疫抑制活性[11]。本实验通过测定小鼠脾脏淋巴细胞调节基因表达,发现经Cy处理的模型组TGF-β、PD-1的mRNA水平均显著增高,而萝卜硫素能够显著抑制TGF-β、PD-1的过度表达,从基因表达调节机制上进一步显示萝卜硫素有一定的免疫增强作用。
总之,不论是免疫器官的保护,特异性、非特异性和细胞免疫功能的增强,还是调节免疫相关基因表达,都证实了萝卜硫素能够提高机体的免疫活性。这进一步证明了萝卜硫素不但具有良好的抗癌活性,而且对机体具有一定的免疫保护作用,可有效弥补普通化学抗癌药物的免疫抑制作用,为西兰花作为中药材的进一步开发利用提供了实验依据。近几年来,我国西兰花的种植面积大量增加,从西兰花中大量提取和提纯萝卜硫素的技术进一步发展成熟,形成了一定的产业链,也为其深入开发应用提供了市场支持。因此对于萝卜硫素的免疫功能和机制的深入研究是十分必要的,仍需进一步的完善。
| [1] | Zhang XJ, Fan SJ, Sun ZY, et al. A summary on phytogenetic classification of brassicaceae from China[J]. Wuhan Zhi Wu Xue Yan Jiu, 2003, 21(3):267-2. [张学杰, 樊守金, 孙稚颖, 等. 中国十字花科植物系统分类近期研究进展[J]. 武汉植物学研究, 2003, 21(3): 267-2.] |
| [2] | Wang R, He L. Primary study on anti-tumor components in broccoli and their bioactivity[J]. Shi Ping Ke Xue, 2009, 30(7): 243-5. [王蓉, 何磊. 西兰花中的抗癌成分及其活性的初步研究[J]. 食品科学, 2009, 30(7): 243-5.] |
| [3] | Sharma R, Sharma A, Chaudhary P, et al. Role of lipid peroxidation in cellular responses to D,L-sulforaphane, a promising cancer chemopreventive agent[J]. Biochemistry, 2010, 49(14): 3191-202. |
| [4] | Yu YY, Feng L, Liu JJ, et al. Analysis of antitumor drugs in global market[J]. Zhongguo Yao Xue Za Zhi, 2013, 48(2): 155-8.[于元元,冯柳, 刘京京, 等. 抗肿瘤药物全球市场分析[J]. 中国药学杂志, 2013, 48(2): 155-8.] |
| [5] | Thejass P, Kuttan G. Immunomodulatory activity of Sulforaphane, a naturally occurring isothiocyanate from broccoli(Brassica oleracea) [J]. Phytomedicine, 2007, 14(7-8): 538-45. |
| [6] | Song Y, Jia XD, Cui WM, et al. Comparison research of immunosuppression models induced by different ways and doses of cyclophosphamide in mice[J]. Zhongguo Shi Pin Wei Sheng Za Zhi, 2013,25(3):218-25. [宋雁, 贾旭东, 崔文明, 等. 不同途径和剂量环磷酰胺建立小鼠免疫抑制模型的对比研究[J]. 中国食品卫生杂志, 2013, 25(3): 218-25.] |
| [7] | Yang XY. Establishing a C57BL/6J mouse immunosuppressive model induced by cyclophosphamide[J]. Zhongguo Zu Zhi Gong Cheng Yan Jiu, 2012, 16(40): 7486-90. [杨宪勇. 应用环磷酰胺构建C57BL/6J小鼠免疫抑制模型[J].中国组织工程研究, 2012, 16(40): 7486-90.] |
| [8] | Di Ianni M, Del Papa B, De Ioanni M, et al. Mesenchymal cells recruit and regulate T regulatory cells[J]. Exp Hematol, 2008, 36(3): 309-18. |
| [9] | Lehner T. Special regulatory T cell review: the resurgence of the concept of contra-suppression in immunoregulation[J]. Immunology, 2008, 123(1): 40-4. |
| [10] | Yang SW, Cao L, Yang SW, et al. Imbalance of immunological functions of Treg and TGF-β1 aggravated cerebral ischemia damage in mice[J]. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi, 2011, 27(4): 408-11.[杨双文, 曹丽, 杨双武, 等. Treg细胞及TGFβ-1免疫调节功能紊乱加重小鼠缺血性脑损伤[J]. 细胞与分子免疫学杂志, 2011, 27(4): 408-11.] |
| [11] | Wei S, Shreiner AB, Takeshita N, et al. Tumor-induced immune suppression of in vivo effector T-cell priming is mediated by the B7-H1/PD-1 axis and transforming growth factor beta[J]. Cancer Res, 2008, 68(13): 5432-8. |
 2015, Vol. 42
2015, Vol. 42
