文章信息
- 郑海燕,阮健 ,潘玲兰,刘见桥. 2015.
- ZHENG Haiyan, RUAN Jian, PAN Linglan, LIU Jianqiao. 2015.
- 溶酶体组织蛋白酶L对人卵巢癌SKOV3细胞迁移及侵袭的作用
- Cathepsin L Promotes Invasion and Migration of Human Ovarian Cancer Cell Line SKOV3
- 肿瘤防治研究, 2015, 42(06): 556-559
- Cancer Research on Prevention and Treatment, 2015, 42 (06): 556-559
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.09.002
-
文章历史
- 收稿日期:2014-05-16
- 修回日期:2014-08-11
2. 510315 广州,南方医科大学肿瘤中心
2. Cancer Center of The Southern Medical University, Southern Medical University, Guangzhou 510315, China
在女性生殖器官恶性肿瘤中,卵巢癌(ovarian cancer)发病率占第三位,然而病死率一直位居第一位。原因是大多数卵巢癌发病隐匿,约75%的患者发现时已属晚期。针对晚期卵巢癌,癌细胞减灭术加紫杉醇/铂类联合化疗,能暂时缓解疾病进展,但是肿瘤复发率却高达80%以上[1]。因此,迫切需要寻找新的治疗卵巢癌的有效方法。随着分子生物学的飞速发展,分子靶向治疗已成为当今卵巢癌防治研究的热点。溶酶体组织蛋白酶L(Cathepsin L)是一种溶酶体半胱氨酸水解蛋白酶,可降解基底膜和细胞外基质,其在肿瘤细胞的侵袭及转移过程中起着重要作用[2]。此外,上皮细胞-间充质转化(epithelial mesenchymal transition,EMT)在肿瘤转移中也发挥了关键作用[3]。然而,关于Cathepsin L是否能够调节卵巢癌细胞的迁移及侵袭能力,则尚未有研究报道。本研究拟应用RNA干扰技术将靶向Cathepsin L基因的shRNA稳定转染卵巢癌离体细胞株SKOV3,观察Cathepsin L基因表达沉默后对SKOV3迁移及侵袭的影响以及EMT相关指标的表达变化,初步探讨Cathepsin L基因在卵巢癌细胞中的作用机制。 1 材料和方法
1.1 细胞培养
人卵巢癌细胞ES-2、SKOV3、OV1以及OV2购自于中科院上海细胞库。四株细胞培养于含10%胎牛血清的RPMI 1640培养液中,并置于体积分数为5%CO2、37℃的细胞培养箱内培养。 1.2 Cathepsin L特异性shRNA和转染
shRNA购自美国Santa Cruz公司(Cat. No:sc-29939-SH)。采用脂质体转染技术,具体操作流程参照英韦创津公司的Lipofectamine2000产品说明书。48 h后加入筛选抗生素G418,浓度为400 μg/ml,维持培养6天后,G418浓度改为200 μg/ml;细胞扩增后,提取蛋白和RNA,进行RT-PCR和Western blot鉴定。将构建好的稳定细胞株命名为SKOV3/shRNA,空白组和对照组分别为SKOV3和SKOV3/Con。 1.3 荧光定量PCR
采用TGuide RNA提取试剂盒(Tiangen公司)提取RNA。反转录反应则采用TAKARA的PrimeScript™ Ⅱ Reverse Transcriptase 试剂盒。荧光定量PCR引物则由Premier Primer 5.0 软件来设计,序列如下:人Cathepsin L前导链:5’-CTGGTGGTTGGCTACGGATT-3’,人 Cathepsin L后随链:5’-CTCCGGTCTTTGGCCATCTT-3’(261 bp);人GAPDH前导链: 5’-AGGTGAAGGTCGGAGTCAAC-3’,人GAPDH后随链:5’-CGCTCCTGGAAGATGGTGAT -3’(232 bp)。实验重复3次。 1.4 蛋白印迹法(Western blot)
将约1×107个细胞加至蛋白裂解液,冰上静置30 min,低温离心20 min(转速12 000 r/min),提取上清液。应用BCA定量法计算蛋白的浓度。取60 μg总蛋白跑胶(恒压100 V)。电转膜30 min。含5%脱脂奶粉的TBST封闭1 h。一抗4℃冰箱过夜。二抗孵育1 h后显影。Cathepsin L、E-cadherin、N-cadherin、p-AKT、total-AKT、Snail以及GAPDH抗体均购自美国Santa Cruz公司。 1.5 Transwell小室法检测细胞侵袭能力
首先将Transwell小室放进24孔板里,然后将稳定转染Cathepsin L或阴性对照序列的细胞用胰蛋白酶消化,用不含胎牛血清的RPMI 1640培养液洗涤细胞3次,随之将细胞重悬,每孔加入100 μl细胞悬液,在小室的下层加入500 μl 1%胎牛血清的RPMI 1640培养液,在培养箱中放置24 h。最后取出小室,弃掉培养液,使用棉签轻轻擦去小室内的残余细胞。甲醛固定并结晶紫染色。显微镜下观察,随机选取8个视野进行细胞计数。 1.6 细胞划痕实验
将生长状态良好的各组细胞以2×105个/ml接种于6孔板内,每孔2 ml。待细胞长至约80%汇合时,用200 μl枪头垂直划出一无细胞的细痕,分别观察0、12、24 h时细胞划痕处细胞运动变化,随机选取3个视野并计算划痕区域的细胞数,3次独立实验。 1.7 统计学方法
采用SPSS13.0统计软件进行处理,计量资料以均数±标准差x±s表示。Transwell侵袭实验采用析因设计方差分析比较各组间差异;荧光定量PCR实验采用单因素方差分析(One-way ANOVA)比较各组间差异。P<0.05为差异有统计学意义。 2 结果
2.1 卵巢癌细胞中Cathepsin L的表达
荧光定量PCR结果显示,见图 1。四株卵巢癌细胞中,SKOV3的Cathepsin L表达水平最高(以此为参照),而ES-2、OV1以及OV2细胞的表达水平分别为0.72±0.04、0.34±0.03和0.55±0.05。因此,选择SKOV3作为研究对象进行下一步实验。

|
| 图 1 Cathepsin L在四株人卵巢癌细胞中的表达水平 Figure 1 Expression of Cathepsin L in four human ovarian carcinoma cell lines |
图 2所示,特异性shRNA经过转染筛选后,Western blot显示Cathepsin L的蛋白水平较前明显下降,荧光定量PCR结果显示,SKOV3、SKOV3/Con以及SKOV3/shRNA细胞的相对表达水平分别为 0.99±0.05、0.96±0.07以及0.37±0.03,Cathepsin L的核酸水平表达均较对照组显著下调(P=0.00527),结果提示,Cathepsin L表达下调的SKOV3细胞株构建成功,并用于下一步实验。
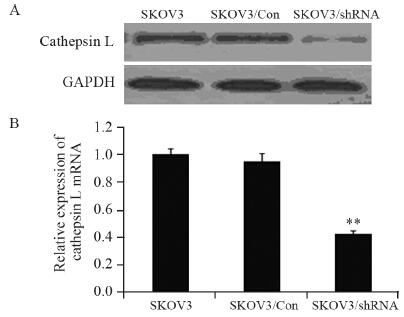
|
| **: P<0.01,compared with control group 图 2 shRNA显著抑制SKOV3细胞的Cathepsin L表达 Figure 2 shRNA significantly suppressed Cathepsin L expression in SKOV3 cells |
划痕0 h时两组细胞贴壁良好,划痕完全,划痕处无细胞贴壁或悬浮;划痕12 h后,SKOV3/Con组较SKOV3/shRNA组的迁移细胞明显增多;划痕24 h后,SKOV3/Con组的划痕基本愈合,而SKOV3/shRNA组的划痕尚未愈合,见图 3。

|
| 图 3 Cathepsin L基因敲除对SKOV3细胞迁移的影响 Figure 3 Effect of Cathepsin L gene transfection on the migration of human ovarian cancer cells SKOV3 |
SKOV3、SKOV3/Con组和SKOV3/shRNA组的穿膜细胞数分别为93.67±8.62,90.33±12.22和35.67±4.73。与对照组相比,SKOV3/shRNA组细胞侵袭能力受到显著抑制(P=0.00372),见图 4。

|
| 图 4 Cathepsin L对细胞体外侵袭能力的影响 Figure 4 Effect of Cathepsin L knockdown on the invasion of SKOV3 cells |
通过 Western blot 检测发现,SKOV3/shRNA组的E-cadherin表达显著增加,而N-cadherin的表达显著降低;此外,Cathepsin L干扰组细胞的Snail、p-AKT表达较对照组显著下降,见图 5。结果提示Cathepsin L可能通过调节Snail和p-AKT两种上游信号因子来调控EMT的发生。

|
| 图 5 Cathepsin L基因敲除对SKOV3细胞中E-cadherin、N-cadherin、Snail以及p-AKT表达的影响 Figure 5 Effect of Cathepsin L gene knockdown on the E-cadherin, N-cadherin, Snail and p-AKT expression in human ovarian cancer cells SKOV3 |
卵巢癌是一类恶性程度较高的肿瘤,容易发生局部浸润及远处转移[1]。Cathepsin L是溶酶体半胱氨酸蛋白酶家族中的一员,可通过分解代谢多种蛋白质参与机体的多种生理病理活动,目前研究已证实,其在肺癌、乳腺癌、结肠癌以及黑色素瘤等多种肿瘤中高表达,并与预后密切相关[4, 5, 6, 7]。本研究结果表明,在卵巢癌中,Cathepsin L是高表达的;成功构建Cathepsin L低表达的细胞株后,发现该组细胞的迁移及侵袭能力较对照组显著下降(P<0.01)。因此推测Cathepsin L基因是卵巢癌的促转移相关基因。
EMT作为上皮源性肿瘤发生发展过程中的重要步骤,与肿瘤浸润及转移密切相关,其主要特征为上皮标志物E-cadherin表达的减少,间质标志物N-cadherin表达的增加[8]。Snail是E-cadherin的主要调节因子,可通过与Smad相互作用蛋白(SIP1)竞争性结合E-cadherin蛋白启动子区的E-box连接基序,抑制E-cadherin的表达,从而诱导EMT发生[9]。有研究表明,Cathepsin L能直接作用于E-cadherin,使其降解,从而松动细胞间的粘连,增强肿瘤细胞的侵袭能力[10]。因此,我们推测Cathepsin L是否通过调节Snail来调控E-cadherin的表达水平,从而推动EMT的发生。
我们进一步研究结果显示,卵巢癌细胞在Cathepsin L下调后,Snail分子的表达水平较对照组显著降低,而E-cadherin表达显著增加,N-cadherin表达则显著下降,提示了Cathepsin L与卵巢癌细胞EMT密切相关,其部分机制可能为Cathepsin L通过对Snail因子的调控,从而影响E-cadherin的表达水平。然而,值得注意的是,EMT的调节涉及多条信号通路,且这些信号通路之间可能还存在着相互作用。PI3K/AKT通路是目前研究得比较深入的与EMT密切相关的信号通路[11]。为了进一步明确Cathepsin L对EMT的调节作用,我们还检测了PI3K/AKT通路的关键调节因子p-AKT的表达,发现Cathepsin L下调后,p-AKT蛋白表达亦受到明显抑制,这提示了Cathepsin L对EMT的调控可能也与PI3K/AKT通路相关。
综上所述,本研究探讨了Cathepsin L与EMT及卵巢癌细胞迁移侵袭之间的相互关系,发现Cathepsin L可通过调控EMT的发生影响卵巢癌细胞的迁移及侵袭,其可能机制为调节EMT上游通路分子Snail及p-AKT。这为进一步揭示Cathepsin L基因与卵巢癌的关系提供新的实验依据,为探讨卵巢癌转移的分子机制提供新的思路。
| [1] | Jayson GC, Kohn EC, Kitchener HC, et al. Ovarian cancer[J]. Lancet, 2014, 384(9951): 1376-88. |
| [2] | Arvatz G, Shafat I, Levy-Adam F, et al. The heparanase system and tumor metastasis: is heparanase the seed and soil?[J]. Cancer Metastasis Rev, 2011, 30(2): 253-68. |
| [3] | Lamouille S, Xu J, Derynck R. Molecular mechanisms of epithelial-mesenchymal transition[J]. Nat Rev Mol Cell Biol, 2014, 15(3): 178-96. |
| [4] | Chen Q, Fei J, Wu L, et al. Detection of cathepsin B, cathepsin L, cystatin C, urokinase plasminogen activator and urokinase plasminogen activator receptor in the sera of lung cancer patients[J]. Oncol Lett, 2011, 2(4): 693-9. |
| [5] | Jagodic M, Vrhovec I, Borstnar S, et al. Prognostic and predictive value of cathepsins D and L in operable breast cancer patients[J]. Neoplasma, 2005, 52(1): 1-9. |
| [6] | Sullivan S, Tosetto M, Kevans D, et al. Localization of nuclear cathepsin L and its association with disease progression and poor outcome in colorectal cancer[J]. Int J Cancer, 2009, 125(1): 54-61. |
| [7] | Stabuc B, Mrevlje Z, Markovic J, et al. Expression and prognostic significance of Cathepsin L in early cutaneous malignant melanoma[J]. Neoplasma, 2006, 53(3): 259-62. |
| [8] | Tsai JH, Yang J. Epithelial-mesenchymal plasticity in carcinoma metastasis[J]. Genes Dev, 2013, 27(20): 2192-206. |
| [9] | Gheldof A, Berx G. Cadherins and epithelial-to-mesenchymal transition[J]. Prog Mol Biol Transl Sci, 2013, 116: 317-36. |
| [10] | Gocheva V, Zeng W, Ke D, et al. Distinct roles for cysteine cathepsin genes in multistage tumorigenesis[J]. Genes Dev, 2006, 20(5): 543-56. |
| [11] | Larue L, Bellacosa A. Epithelial-mesenchymal transition in development and cancer: role of phosphatidylinositol 3’ kinase/AKT pathways[J]. Oncogene, 2005, 24(50): 7443-54. |
 2015, Vol. 42
2015, Vol. 42
