文章信息
- 王洪斌,王宗华,陈俊颖,邹利全,宋航,陈陵. 2015.
- WANG Hongbin, WANG Zonghua, CHEN Junying, ZOU Liquan, SONG Hang, CHEN Ling. 2015.
- 负载人microRNA-149的复制缺陷型腺病毒对人肝癌细胞株增殖的影响
- Replication-deficient Adenovirus Carrying hsa-microRNA-149 Inhibits Proliferation of Human Hepatocellular Carcinoma Cell Lines
- 肿瘤防治研究, 2015, 42(06): 548-552
- Cancer Research on Prevention and Treatment, 2015, 42 (06): 548-552
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.09.002
-
文章历史
- 收稿日期:2014-06-20
- 修回日期:2015-02-12
2. 400038 重庆,中国人民解放军第三军医大学护理学院;
3. 400020 重庆,中国人民解放军第324医院病理科
2. Nursing School, The Third Military Medical University, Chongqing 400038, China;
3. Department of Pathology, 324 Hospital of PLA, Chongqing 400020, China
肝癌发病率高、起病隐匿、治疗手段有限、疗效不佳,长期预后极差[1]。深入开展肝癌转移的基础研究,阐明肝癌转移的分子机制,是提高肝癌患者生存率的重要因素。MicroRNAs是最大的一类转录后基因表达调控因子[2],与肿瘤发生发展关系密切。目前已发现,microRNA-149在肺癌、胃癌、结肠癌等多种肿瘤发生发展中起着重要作用[3, 4, 5]。我们在前期工作中亦发现[6],负载microRNA-149的慢病毒所介导microRNA-149的过表达,可抑制人肝癌细胞株MHCC97-H细胞的增殖和侵袭。由于慢病毒载体存在着目的外源基因随机插入宿主基因组的风险问题,其应用受到限制,目前甚至还无法进行Ⅰ期临床试验[7],但腺病毒载体则无类似安全问题,且腺病毒载体技术已成功进入临床应用[8]。因此,我们进一步包装了负载microRNA-149的腺病毒表达载体并观察其在体外对肝癌细胞株增殖的抑制作用,为研究microRNA-149在肿瘤发生发展中的作用,以及其在肿瘤治疗中的应用奠定基础。 1 材料和方法
1.1 材料
腺病毒包装质粒pBHGloxDeltaE1,3Cre、穿梭质粒pDC315、人胚肾HEK293细胞(本室保存);负载LacZ基因的复制缺陷型腺病毒(Ad-LacZ)(本室保存);BamHⅠ内切酶(TaKaRa,大连);EcoRⅠ内切酶(TaKaRa,大连);1 kb plus Ladder (TaKaRa,大连); Lipofectamine 2000转染试剂(Invitrogen,美国);PCR试剂盒(Promega,美国);酵母提取物及胰蛋白胨(上海生工);RNAiso试剂(TaKaRa,大连)。质粒DNA小量快速抽提试剂盒(Omega,美国); RT试剂盒(Toyobo,日本);实时荧光定量PCR试剂盒(Toyobo,日本); ABI7500荧光定量PCR仪(ABI,美国);pre-microRNA-149 DNA寡核苷酸链合成序列(上海生工);高糖DMEM培养液及标准胎牛血清(HyClone,美国);HepG2和MHCC97-H人肝癌细胞株(上海复旦大学肝癌研究所);microRNA-149的PCR引物采用Primer Premier 5自行设计,上海生工合成纯化,其上游序列P1:5’-TTCGCCCGCCTTGCGTCCAGCCTGC-3’。下游序列P2:5’-GCGACCTGCGTTGTTCCAGC-3’,扩增片段长度141 bp。腺病毒载体E2b区引物序列:上游P3:5’-TCGTTTCTCAGCAGCTGTTG-3’;下游P4:5’-CATCTGAACTCAAAGCGTGG-3’,扩增片段长度为860 bp。 1.2 方法
1.2.1 Ad-miR149的包装
在NCBI网站查找microRNA-149前体序列(89 bp),并分别向上游和下游延伸50 bp,在5’端加入EcoRⅠ酶切位点,在3’端加入BamHⅠ酶切位点,全基因合成后插入pDC315穿梭质粒多克隆位点,构建pDC315-miR149质粒。参照Lipofectamine 2000使用说明书将pDC315-miR149及包装质粒共转染HEK293细胞;转染后10~12 d出现空斑后,挑取空斑溶液冻融4次后离心,取上清液感染HEK293细胞,3~5 d后HEK293细胞出现细胞病变效应(cytopathic effect,CPE),离心收集HEK293细胞,冻融4次后离心,收集上清液。 1.2.2 鉴定负载microRNA-149的复制缺陷型腺病毒
(1)电子显微镜鉴定:取0.2 ml的Ad-miR149病毒液感染1×106 HEK293细胞,37℃培养2~3 d出现CPE后,收集HEK293制作电子显微镜标本,透射电子显微镜观察细胞内病毒颗粒[9]。以PBS代替病毒液作为阴性对照。(2)PCR鉴定: 取0.2 ml Ad-miR149病毒液,在EP管内沸水煮10 min后备用。分别采用miR149特异引物P1、P2和腺病毒特异引物P3、 P4,使用PCR Master进行PCR扩增,取5 μl煮沸后的病毒液作为DNA模板,上游和下游引物各加1 μl,反应体系总计20 μl。反应条件为94℃ 3 min,94℃ 1 min,56℃ 1 min,72℃ 2 min,共计35个循环,再72℃延伸7 min,之后4℃保存。电泳后同时出现腺病毒和microRNA-149的特异性扩增条带作为阳性判断标准[10]。用Ad-LacZ作为阴性对照。 1.2.3 Ad-miR149的扩增及滴度测定
Ad-miR149经鉴定正确后进行大量扩增。具体方法:取Ad-miR149病毒液,感染HEK293细胞,出现细胞病变效应(CPE)后收集细胞反复冻融4次,离心(2 500 g,5 min)。吸取上清液,用0.22 μm滤膜过滤除菌,采用氯化铯梯度离心纯化后,置-70℃冻存备用[11]。于24孔培养板中每孔接种1×105个HEK293细胞,取病毒液0.2 ml加PBS稀释至总量2 ml,混匀后作10倍比稀释至第6管,每个稀释度设3复孔。于每孔细胞内加入不同稀释度病毒液0.2 ml,1 h后补加培养液1.5 ml,48 h后观察细胞病变情况。取100%出现CPE的最大稀释度,按下列公式计算病毒滴度:pfu/ml=(105细胞×稀释度×10个病毒/细胞)/0.2 ml。 1.2.4 Real-time PCR检测microRNA-149的表达
根据RNAiso试剂说明书抽提细胞内总RNA并测定浓度和纯度。参照试剂盒说明书配制20 μl反应体系,反应条件为42℃ 15 min,85℃ 5 s;根据荧光实时定量PCR试剂盒说明书,反转录产物吸取5 μl,并加入引物及Mix,反应体系为25 μl;预变性95℃ 30 s,设置反应条件为95℃ 5 s,60℃ 30 s,40次循环。采用2-△△ CT法处理数据。 1.2.5 MTT方法观察microRNA-149对肝癌细胞生长曲线的影响
取纯化后负载microRNA-149的腺病毒,以10:1感染复数,分别感染人肝癌细胞株HepG2和MHCC97-H肝癌细胞株,24 h后将细胞接种于96孔板,每孔1×103个肿瘤细胞,设5个复孔。每孔加入20 μl MTT溶液(5 mg/ml),培养4 h后,弃去培养液,每孔加入150 μl二甲基亚砜,振荡10 min后,在多功能酶标仪上检测吸光度(450 nm)。计算microRNA-149对两组肝癌细胞的抑制率[7]:抑制率(%)=(1-实验孔吸光度/对照孔吸光度)×100%。 1.3 统计学方法
结果以x±s表示,对多组数据采用One-way ANOVA检验,采用Tukey检验比较组间数据。使用Prism 5.0(GraphPad)统计学软件分析,P<0.05为差异有统计学意义。 2 结果
2.1 构建pDC315-miR149腺病毒穿梭质粒
分别将pDC315腺病毒穿梭质粒、全基因合成的pre-miR-149片段以EcoRⅠ和BamH Ⅰ双酶切,回收酶切片段并采用牛小肠碱性磷酸酶(CIP)去磷酸化,两条片段连接后转化DH5α大肠杆菌,选取阳性菌落,予以扩增并抽提质粒,成功连接的重组体用EcoRⅠ和BamHⅠ双酶切鉴定可见3 900 bp和189 bp两条带,见图 1。

|
| M: 1 kb plus ladder; 1: pDC315;2: pDC315-miR149 图 1 采用BamHⅠ和EcoRⅠ双酶切方法鉴定重组质粒 Figure 1 Recombinant plasmid identified by BamHⅠand EcoRⅠdouble-digestion methods |
将包装成功的负载microRNA-149的腺病毒(Ad-miR149)在HEK293细胞内扩增后,采用倍比稀释法,测得腺病毒滴度达5×109 pfu/ml。 2.3 电子显微镜鉴定结果
将Ad-miR149纯化液感染HEK293细胞,经过2~3 d出现CPE表现后,收集细胞用于制作透射电子显微镜标本。在透射电子显微镜下,观测到HEK293细胞内有大量病毒颗粒,见图 2A,呈圆形实心小颗粒状,直径约为75~85 nm,细胞核核膜有破损,细胞器模糊。未感染腺病毒的对照组HEK293细胞内未见病毒颗粒,见图 2B,胞质内细胞器清晰,细胞核核膜完整连续。

|
| A: Virus particles were observed in HEK293 cells infected with Ad-miR149(TEM×10 000); B: No virus particle was observed in HEK293 cells non-infected with Ad-miR149(TEM×7 000) 图 2 感染Ad-miR149和未感染病毒的HEK293细胞 Figure 2 HEK293 cells infected and non-infected with Ad-miR149 |
采用腺病毒特异引物和microRNA-149引物分别对Ad-miR149和阴性对照Ad-LacZ进行PCR扩增,结果发现Ad-miR149可扩增出860和141 bp两个条带,而Ad-LacZ只出现860 bp的腺病毒特异条带,见图 3。这表明包装成功的腺病毒载体携带pre-miR-149序列。

|
| M: 1kb plus Ladder 图 3 负载microRNA-149腺病毒载体的PCR鉴定 Figure 3 Recombinant adenovirus carrying microRNA-149(Ad-miR149) identified by PCR |
与PBS组(以PBS代替腺病毒)相比,感染Ad-miR149的HepG2和MHCC97-H细胞内microRNA-149表达丰度分别升高4.32倍和3.52倍,而感染Ad-LacZ的肝癌细胞株内microRNA-149变化不显著,见表 1。
 |
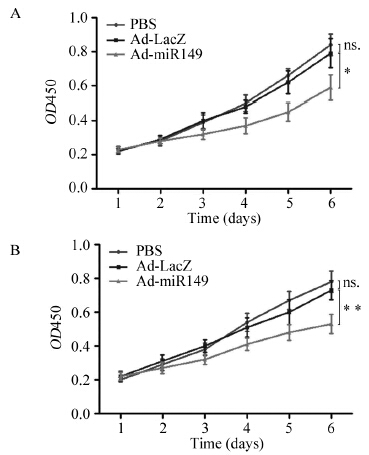
采用PBS代替Ad-miR149作为空白对照,采用Ad-LacZ作为阴性对照。结果发现,与Ad-LacZ相比,Ad-miR149感染后肝癌细胞株增殖能力显著下降[HepG2:(0.791±0.105)vs.(0.59±0.072),P=0.013;MHCC97-H:(0.726±0.098) vs.(0.528±0.057),P=0.004],见图 4。而两组肝癌细胞株之Ad-LacZ组与PBS组相比,细胞增殖无明显变化[HepG2:(0.791±0.105)vs.(0.844±0.064),P=0.363;MHCC97-H:(0.726±0.098)vs.(0.782±0.063),P=0.314],见图 4。第6天,与Ad-LacZ相比,Ad-miR149对HepG2的抑制率为25.4%,对MHCC97-H的抑制率为27.7%,见图 4。
|
| *: P<0.05; **: P<0.01; ns.: no significance; A: HepG2; B: MHCC97-H 图 4 肝癌细胞株增殖曲线 Figure 4 Proliferation curves of hepatocellular carcinoma cell lines |
MicroRNAs在肿瘤的发生与发展过程中起着重要作用,有望作为临床诊断指标与治疗靶标应用于临床[12]。基于microRNAs的肿瘤诊断与治疗研究正在成为肿瘤研究中的热点之一。原发性肝癌是我国常见恶性肿瘤之一,严重威胁人民健康。寻找新的肝癌治疗靶标,对肝癌的防治具有重要价值。目前发现,microRNA-149对多种肿瘤具有抑制作用。例如,Ke等[3]发现,microRNA-149可通过抑制肺癌细胞上皮-间质转变(epithelial-to-mesenchymal transition,EMT)而抑制非小细胞肺癌转移能力,机制可能是直接抑制其靶基因叉头盒转录基因M1(Forkhead box M1,FOXM1);Wang等[4]发现,在胃癌中microRNA-149通过抑制其靶基因锌指蛋白ZBTB2而抑制胃癌细胞增殖及细胞周期进程;Chan等[13]发现,miR-149可通过抑制靶基因G蛋白耦联受体激酶相互作用分子1(G-protein-coupled receptor kinase-interacting protein 1,GIT1)而抑制乳腺癌的侵袭与转移。miR-149不但被发现具有抑癌作用,还可预测预后。例如,Wang等[5]发现,miR-149可通过抑制其靶基因转录蛋白1(SP1)而抑制结直肠癌增殖和侵袭,并可作为结直肠癌的预后指标。但国内罗朝辉等[14]发现,microRNA-149可通过促进鼻咽癌EMT转变从而促进肿瘤转移,但microRNA-149促进EMT的机制未明确。这些研究表明,microRNA-149可通过多种不同的机制,在不同的肿瘤内发挥抑癌作用。目前关于microRNA-149在原发性肝癌方面尚无研究报道。我们前期研究发现[6],与癌旁组织相比,microRNA-149在肝癌组织内表达显著下调。本实验以负载microRNA-149的腺病毒感染人肝癌细胞株HepG2和MHCC-97H,发现可显著抑制多种肝癌细胞株的增殖。这表明microRNA-149或许可作为抑癌microRNAs在肝癌治疗中发挥重要作用。由于原发性肝癌的发生机制非常复杂,涉及包括microRNAs在内的一系列分子生物学机制。明确这些机制才能更有效地防治原发性肝癌。与其他由复杂的蛋白结构组成的细胞因子不同,由核苷酸组成的microRNAs本身结构简单,易于制备。因此从确定一条抑癌microRNAs到开发临床应用级别的药物的难度,远小于以往任何药物开发过程。这是基于microRNAs药物的天然优势。但是,由于一条microRNAs可调控多个靶基因,这可能会带来较多的不良反应;同时,一个靶基因又可受到多条microRNAs的调控,这又可能会使作用强度不足。因此,基于microRNAs的肿瘤治疗道路,还任重道远。多途径、多靶点联合将会是今后研究的一个重要方向。
| [1] | Luo J, Zhang JC, Liu FR, et al. Expression of FMNL-2 and MMP-2 in primary hecarcinoma and its clinicopathological characteristics[J]. Zhong Liu Fang Zhi Yan Jiu, 2014, 41(5): 460-3. [罗佳, 章敬成, 刘繁荣, 等. 肝癌组织中FMNL-2和MMP-2的表达及临床病理分析[J]. 肿瘤防治研究, 2014, 41(5): 460-3.] |
| [2] | Nana-Sinkam SP, Croce CM. Clinical applications for microRNAs in cancer[J]. Clin Pharmacol Ther, 2013, 93(1): 98-104. |
| [3] | Ke Y, Zhao W, Xiong J, et al. miR-149 Inhibits Non-small-cell lung cancer cells EMT by Targeting FOXM1[J]. Biochem Res Int, 2013, 2013: 506731. |
| [4] | Wang Y, Zheng X, Zhang Z, et al. MicroRNA-149 inhibits proliferation and cell cycle progression through the targeting of ZBTB2 in human gastric cancer[J]. PLoS One, 2012, 7(10): e41693. |
| [5] | Wang F, Ma YL, Zhang P, et al. SP1 mediates the link between methylation of the tumour suppressor miR-149 and outcome in colorectal cancer[J]. J Pathol, 2013, 229(1): 12-24. |
| [6] | Cao YL, Chen L, Lu MH, et al. Expression of miR-149-5p in hepatocellular carcinoma and its clinical significance[J]. Di San Jun Yi Da Xue Xue Bao, 2012, 34(7):627-31. [曹亚玲, 陈陵, 吕沐瀚, 等. miR-149-5p在肝细胞癌中的表达及其临床意义[J]. 第三军医大学学报, 2012, 34(7): 627-31.] |
| [7] | Qin ZW,Wang ZH, Zou LQ, et al. Package and identification of lentivirus carrying human miR-29 and its effects on the proliferation of gastric cancer cell[J]. Zhongguo Zhong Liu, 2011, 20(6): 453-6. [覃志伟, 王宗华, 邹利全, 等. 负载人miR-29慢病毒的包装鉴定及对人胃癌细胞株增殖的影响[J]. 中国肿瘤, 2011, 20(6): 453-6.] |
| [8] | Yang F, Lu B, Hu CY, et al. Treatment of advanced lung cancer with malignant pleural effusion using Intrathoracic injection of recombinant human 5 adenovirus[J]. Shi Yong Yi Xue Za Zhi, 2013, 29(17): 2885-6. [杨帆, 卢斌, 胡春燕, 等. 胸腔内注射重组人5型腺病毒治疗晚期肺癌恶性胸腔积液的疗效观察[J]. 实用医学杂志, 2013, 29(17): 2885-6.] |
| [9] | Chen L, Xiong XF, Gao J, et al. Package and identification of lentiviral vector carrying human hTERT-regulated miR-138[J]. Xian Dai Yi Yao Wei Sheng, 2011, 27(2): 177-80. [陈陵, 熊晓峰, 高军, 等. 负载hTERT调控相关miR-138慢病毒的包装及鉴定[J]. 现代医药卫生, 2011, 27(2): 177-80.] |
| [10] | Xiong XF, Chen L, Fang YC, et al. Package and identification of replication-deficient adenovirus carrying hTERT-regulated miR-138[J]. Chongqing Yi Xue, 2011, 40(9): 896-8. [熊晓峰, 陈陵, 范亚川, 等. 负载hTERT调控相关miR-138复制缺陷型腺病毒的包装及鉴定[J]. 重庆医学, 2011, 40(9): 896-8.] |
| [11] | Gao J, Fan YC, Wang J, et al. Package and identification of replication-deficient adenovirus carrying hsa-miR-29a[J]. Xi Nan Guo Fang Yi Yao, 2011, 21(10): 1045-8. [高军, 范亚川, 王军, 等. 负载人miR-29a复制缺陷型腺病毒的包装及鉴定[J]. 西南国防医药, 2011, 21(10): 1045-8.] |
| [12] | Chen L, Xiao H, Wang ZH, et al. miR-29a suppresses growth and invasion of gastric cancer cells in vitro by targeting VEGF-A[J]. BMB Rep, 2014, 47(1): 39-44. |
| [13] | Chan SH, Huang WC, Chang JW, et al. MicroRNA-149 targets GIT1 to suppress integrin signaling and breast cancer metastasis[J]. Oncogene, 2014, 33(36): 4496-507. |
| [14] | Luo ZH, Zhang LY, Li Z, et al. miR-149 promotes epithelial-mesenchymal transition and invasion in nasopharyngeal carcinoma cells[J]. Zhong Nan Da Xue Xue Bao(Yi Xue Ban), 2011, 36(7): 604-9. [罗朝辉, 张李洋, 李征, 等. miR-149促进鼻咽癌细胞侵袭和上皮-间质转变[J]. 中南大学学报(医学版), 2011, 36(7): 604-9.] |
 2015, Vol. 42
2015, Vol. 42