文章信息
- 谭伊诺,袁瑛. 2015.
- TAN Yi’nuo, YUAN Ying. 2015.
- 胃癌腹膜转移的治疗进展
- Treatment Advances of Peritoneal Metastasis from Gastric Cancer
- 肿瘤防治研究, 2015, 42(05): 506-510
- Cancer Research on Prevention and Treatment, 2015, 42 (05): 506-510
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.05.019
-
文章历史
- 收稿日期:2014-11-27
- 修回日期:2015-03-01
2. 310009 杭州,恶性肿瘤预警与干预教育部重点实验室,医学分子生物学重点实验室
2. Key Laboratory of Cancer Prevention and Intervention, Chinese Ministry of Education,Key Laboratory of Molecular Biology in Medical Sciences, Hangzhou 310009, China
胃癌是一种侵袭性强、恶性度高,在全球范围内病死率居第二位的癌症。胃癌腹膜转移可导致肠梗阻,大量恶性腹水等并发症,是胃癌患者死亡的主要原因之一。在初诊胃癌患者中,大约14%伴有腹膜转移,而在晚期胃癌患者中腹膜转移比例高达39%~43%[1],胃癌术后复发的患者中更高达45%[2, 3]。胃癌伴腹膜转移的患者预后极差,中位生存时间大约为4~6月[1, 4],而总体胃癌患者中位生存时间约为15~30月。目前胃癌伴腹膜转移尚缺乏疗效显著的国际公认的标准治疗方案,全身化疗仍是国内外指南中的推荐方案,其他方法有手术、腹腔灌注化疗、靶向治疗等,但疗效尚无定论,本文对胃癌伴腹膜转移的诊疗进展进行回顾总结。 1 胃癌腹膜转移的诊断
胃癌腹膜转移的诊断手段较为多样,目前临床中无创检查方法如B型超声、CT,甚至PET-CT等均有一定的局限性,难以达到较高的敏感度。B型超声或CT对于腹腔转移的检出均需达到一定量的腹腔积液或有较大转移结节,即使是大于1 cm的腹腔转移结节,CT的敏感度也仅达到约70%。而PET-CT对于胃癌腹膜转移的敏感度及特异性也比较有限。有研究表明,增强CT和PET-CT对于胃癌腹膜转移的诊断敏感度分别为39.4%和74.4%,特异性分别为93.8%和93.1%[5]。虽然PET-CT对于腹膜转移的诊断敏感度相对较高,但其昂贵的费用限制了其在临床中的应用。目前胃癌腹膜转移诊断的金标准仍是腹腔镜或腹腔冲洗细胞学。 2 胃癌腹膜转移的治疗 2.1 全身化疗
全身化疗可通过循环系统将化疗药物作用于全身各处,并且可通过血液循环深入肿瘤内部。对于晚期胃癌首选的化疗药物包括铂类、氟尿嘧啶类、紫杉类、伊立替康以及口服药物如替吉奥(S-1)、卡培他滨等,一般推荐两药联合,体力耐受度好的患者也可采用三药联合方案。
S-1为一种口服的氟尿嘧啶类药物,不同于5-Fu、卡培他滨等传统氟尿嘧啶类药物,因其成分中含有吉美嘧啶,可抑制二氢嘧啶脱氢酶(DPD)对5-Fu的降解,且S-1还含有奥替拉西,可降低相应的胃肠道反应,故在晚期胃癌患者中的应用逐渐增多。有研究表明,S-1在肿瘤中的药物浓度是5-Fu的4倍,而在腹腔中更高达5.5倍,故而S-1针对腹膜转移可能更有效[6]。2002年就有对比S-1和氟尿嘧啶疗效的小型临床试验,结果显示S-1可显著提高患者生存时间(8.6月 vs. 3.9月)[7],见表 1。同时,紫杉醇在晚期胃癌化疗中的地位和重要性也逐渐被认识到[8],且紫杉醇在静脉用药后可有效渗透入腹腔并在腹腔中维持高达72 h[9],故对于腹膜转移紫杉醇类可能会有较好疗效。
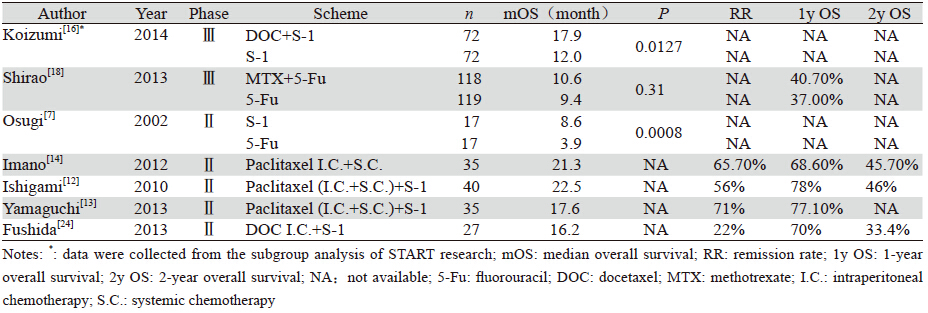 |
对于身体状态良好的患者,应用紫杉醇和S-1联合方案的耐受性和有效性已有Ⅱ期临床试验验证[10],来自中国的随机对照临床试验表明紫杉醇和S-1联合方案疗效优于S-1单药方案[11]。另有三项关于紫杉醇腹腔灌注、静脉化疗联合S-1口服的针对胃癌伴腹膜转移患者的Ⅱ期临床试验,取得了1年生存率77.10%~78%,总反应率56%~71%的良好效果[12, 13],见表 1,甚至其中有研究显示有部分患者治疗后腹腔镜复查证实腹膜转移消失,遂再行D2根治术,该群患者的中位生存时间高达29.8月[14]。
基于S-1的其他联合方案在胃癌腹膜转移中也有临床应用证据,2008年日本的SPIRIT研究对比了S-1联合顺铂和单用S-1在进展期胃癌中的疗效,结果显示联合方案明显优于单药,且在腹膜转移的亚组中,联合方案的生存优势更明显[15],危险度降低48%(P=0.02)。另外一项同样来自日本的大型Ⅲ期临床试验START研究对比了S-1联合多西他赛和单用S-1治疗晚期胃癌的疗效,入组639例患者,结果显示联合方案对比单药方案可将总生存期从10.8月提高到12.5月,但是在无可评价病灶的144例患者中[腹膜转移患者占76%(109/144)],联合方案比单药方案有显著生存获益(17.9月vs.12.0月)[16],见表 1。可见紫杉醇、顺铂、多西他赛均可与S-1联合,疗效优于S-1单药。至于三药联合方案,有Ⅱ期临床试验将S-1、紫杉醇、顺铂三药联合用于晚期胃癌,8例腹膜转移患者中3例达到CR,2例PR,2例SD[17]。但这些临床试验均非特异性针对胃癌伴腹膜转移患者,上述结论仅为分析亚组数据结果而得出的,故结论效力有限。
其他尚有若干阴性结果的临床试验,如JCOG0106试验对比了氟尿嘧啶联合甲氨蝶呤与氟尿嘧啶单药对于胃癌腹膜转移的疗效,结果并无差异[18],见表 1。另一项关于胃癌腹膜转移患者在5-Fu耐药后对比改用紫杉醇和继续5-Fu两种方案的疗效,结果亦无明显差异,中位生存时间均为7.7月,一年生存率约27%~31%[19]。GC0301/TOP-002研究中也表明对于伊立替康和S-1的联合方案并没有明显优于S-1单药,反而增加了不良反应,且在腹膜转移的亚组中也没有显示生存差异[20]。
当前正在进行的值得期待的研究包括,一项多中心的Ⅲ期临床试验——PHOENIX研究,实验组和对照组均以S-1为基础,其中一组联合紫杉醇静脉、腹腔灌注化疗,另一组联合顺铂静脉化疗;还有一项关于紫杉醇的Ⅱ期临床试验——INPACT研究,针对胃癌伴腹膜转移高危可能(如腹水细胞学阳性、弥漫浸润型、8 cm以上的溃疡浸润型等)的患者在胃癌手术后在以S-1口服的基础上,对比紫杉醇静脉化疗和腹腔灌注化疗的疗效差异[21]。 2.2 腹腔灌注化疗
在全身化疗过程中,由于腹膜-血浆屏障的存在[22, 23],化疗药物在腹腔内浓度往往较低,无法达到产生有效细胞毒作用的浓度。腹腔灌注化疗作为一种辅助治疗手段,让腹腔内高浓度的细胞毒药物和散在肿瘤组织及游离的肿瘤细胞充分接触,从而杀灭微小转移结节,控制癌性腹水,缓解腹胀腹痛等症状。腹腔灌注化疗的另一个优势在于药物持续作用时间久,因化疗药物透过腹膜-血浆屏障缓慢,故药物清除速度较慢,甚至有研究表明紫杉醇腹腔灌注化疗的有效持续作用时间可达72 h之久[9]。
腹腔灌注化疗常用的药物包括顺铂、氟尿嘧啶等。近年来,紫杉类药物由于其分子量较大,不易被血管吸收,在腹腔滞留时间较长的特点被逐渐用于腹腔灌注化疗,正如前文所述,在S-1口服联合紫杉醇静脉应用的基础上,腹腔灌注紫杉醇已有Ⅱ期临床试验证明其安全性和有效性,也有Ⅲ期临床试验正在进一步验证其疗效。
多西他赛在腹腔灌注中的应用也有国内外临床试验已证明其安全性和良好的耐受性[24, 25],见表 1,至于其临床疗效如何、静脉用药对比孰优孰劣,仍缺乏有力的临床数据,期待更多的大样本Ⅲ期临床研究。
目前腹腔灌注化疗在临床中除了应用于复发性、不可切除性的晚期胃癌伴腹膜转移患者,更多应用于围手术期,包括术中的腹腔热灌注化疗,术后早期腹腔灌注化疗等改良方法,多与细胞减灭术等联合应用,延长了部分晚期患者的生存时间,具体将在下文中详述。
虽然腹腔灌注化疗可将药物直接高浓度作用于癌结节,但是化疗药物的组织穿透能力有限,即使是相对分子量小,水溶性好的铂类、氟尿嘧啶类药物,也仅能从肿瘤表面渗入若干毫米[23],而紫杉醇、多西他赛等分子量大、水溶性差的药物则更难以从腹腔内渗透入血浆,其药物渗透深度仅有200~300 μm[26],对于已局部形成粘连包裹的癌结节更难以作用到深部,另一方面,即使同一种化疗药物,在不同癌结节中的穿透能力也有较大差异[27, 28]。故在晚期患者中应用腹腔灌注化疗时,全身化疗的地位仍非常重要,特别是对于紫杉类等较难渗入血管的大分子药物,应用腹腔灌注化疗时需联合全身化疗。 2.3 手术联合腹腔热灌注化疗
目前胃癌伴腹膜转移且无肝脏等其他脏器及远处淋巴结转移的患者,可以考虑行细胞减灭术联合腹腔热灌注化疗。在1960至1990年期间,姑息性胃癌手术的死亡率高达20%[29],所以权衡生存获益和手术风险后,对于晚期胃癌医生普遍不建议手术治疗,但是伴随着手术方式、麻醉技术、围术期管理等方面的发展和进步,手术死亡率明显降低[30]。另一方面,腹腔热灌注化疗,利用肿瘤细胞不耐热,易在高热环境下变性坏死等特性,可杀伤游离的肿瘤细胞和微小转移灶,自1980年由Spratt等提出腹腔热灌注化疗的方法后[31],该方法被不断优化改进,目前有越来越多的临床试验证实细胞减灭术联合腹腔热灌注化疗在部分胃癌伴腹膜转移患者中的疗效。
对于胃癌单腹膜转移,有回顾性研究数据证实了手术在部分患者中的治疗价值。国内有研究统计胃癌伴腹膜微转移患者行胃癌手术后5年生存率可达24%,甚至对于肉眼可见转移的患者行手术治疗后,仍有6%的5年生存率[32]。在无症状的胃癌伴腹膜转移患者中行胃癌手术联合化疗对比一线化疗可将中位生存时间从10.3月提高到21.3月[33]。一项法国的多中心回顾性研究中表明在胃癌伴腹膜转移患者中行细胞减灭术后5年生存率达23%[34]。
近几年逐渐开展了一些前瞻性临床试验,验证了细胞减灭术联合腹腔热灌注化疗的价值。GYMSSA试验[35]入组了16位胃癌伴腹膜转移患者,实验组接受细胞减灭术、腹腔奥沙利铂、5-Fu热灌注化疗联合FOLFOXIRI化疗,中位生存时间约11.3月,而对照组仅接受FOLFOXIRI化疗,中位生存时间仅约4.3月。说明对比单纯化疗,细胞减灭术和腹腔热灌注化疗是有生存获益的,只是该研究样本量偏少。另一项Ⅲ期临床试验纳入68位胃癌伴腹膜转移患者,对照组单用细胞减灭术,实验组则在细胞减灭术后加用腹腔热灌注化疗,顺铂120 mg和丝裂霉素C 30 mg加入6 000 ml 43℃的0.9%氯化钠溶液中热疗60~90 min,该组患者中位生存时间11月,高于单用细胞减灭术患者的6.5月[36],这证明了腹腔热灌注化疗的价值。一项包含有159例胃癌伴腹膜转移患者的研究表明,接受细胞减灭术联合腹腔热灌注化疗的患者5年生存率达13%,其中细胞减灭术全部清扫完肉眼可见结节的亚组患者的5年生存率高达23%[34]。
腹膜播散范围越广、种植灶直径越大,患者预后越差,激进的治疗手段受益越小。胃癌伴腹膜转移曾经被认为只能姑息化疗,生存超过五年几乎无望,而近些年有一小部分患者通过手术和腹腔热灌注化疗后可以长期存活,这样的结果是非常激动人心的,但在临床中应用细胞减灭术、腹腔热灌注化疗等治疗措施需谨慎筛选可能受益的患者,这仍待更大范围的随机对照研究,以制定更优化的受益患者的筛选方案。 2.4 靶向治疗
人表皮生长因子受体2(HER2)阳性的胃癌患者可应用靶向药物曲妥珠单抗,已有大型Ⅲ期临床试验如ToGA试验明确其在HER2阳性的晚期胃癌的生存获益[37],但在ToGA试验无可评价病灶的亚组中(即包含大部分腹膜转移患者)应用曲妥珠单抗无生存获益,甚至有增加危险度的趋势,差异无统计学意义。另一方面,在胃癌腹膜转移的患者中HER2阳性的比例很低,约为2.9%~6%[37, 38],故抗HER2的靶向药物在胃癌腹膜转移患者中应用前景有限,其疗效有待进一步验证。
另一个较为热门的靶点是上皮细胞黏附分子(EpCAM)。Catumaxomab是一种非人源化的嵌合体单抗,已于2009年在欧洲被批准用于腹腔灌注治疗由EpCAM阳性的上皮源性转移瘤所引起的恶性腹水。在胃癌腹膜转移患者中EpCAM的阳性比例几乎接近100%,且有研究表明腹膜转移灶中EpCAM的表达明显强于原发灶[39],故对于胃癌腹膜转移的患者应用Catumaxomab可能会有效,Ⅱ期临床试验表明Catumaxomab用于胃癌术后腹腔灌注治疗有一定的安全性和耐受性[40],Ⅲ期临床试验研究证实腹腔灌注Catumaxomab对于恶性腹水有一定疗效,特别是在胃癌患者中[41]。Ⅱ期临床试验探索胃癌伴局限性腹膜转移的患者在细胞减灭术后应用Catumaxomab腹腔灌注的疗效[42]。 3 总结 虽然胃癌伴腹膜转移的患者总体预后较差,但随着化疗药物的发展,手术观念的改变,腹腔热灌注化疗等技术的联合使用,腹膜转移患者的生存期在逐渐延长。对于腹膜转移诊断明确的胃癌患者,全身化疗仍为主导地位。常用药物包括氟尿嘧啶类如S-1,紫杉类以及铂类等。以S-1为基础的联合方案优于单用S-1。全身化疗可配合腹腔内灌注化疗,目前顺铂、氟尿嘧啶类药物在腹腔灌注化疗中应用较多,多西他赛腹腔灌注也已有实验证明其可行性及安全性,但紫杉类药物腹腔灌注化疗仍缺乏大型的Ⅲ期临床研究结果。单纯腹膜转移且结节较少较局限的患者经过筛选后部分患者行细胞减灭术联合腹腔热灌注化疗可有生存获益,甚至部分患者可能长期存活,但仍需探索更好的方案以筛选出最大获益人群。在靶向药物领域,胃癌腹膜转移多高表达EpCAM,针对该靶点的单抗Catumaxomab在胃癌腹膜转移中可能具有应用前景,期待更多临床试验的验证。
| [1] | Thomassen I, van Gestel YR, van Ramshorst B, et al. Peritoneal carcinomatosis of gastric origin: a population-based study on incidence, survival and risk factors[J]. Int J Cancer, 2014, 134(3): 622-8. |
| [2] | Yonemura Y, Endou Y, Sasaki T, et al. Surgical treatment for peritoneal carcinomatosis from gastric cancer[J]. Eur J Surg Oncol, 2010, 36(12): 1131-8. |
| [3] | Yoo CH, Noh SH, Shin DW, et al. Recurrence following curative resection for gastric carcinoma[J]. Br J Surg, 2000, 87(2): 236-42. |
| [4] | Yang D, Hendifar A, Lenz C, et al. Survival of metastatic gastric cancer: significance of age, sex and race/ethnicity[J]. J Gastrointest Oncol, 2011, 2(2): 77-84. |
| [5] | Yang QM, Bando E, Kawamura T, et al. The diagnostic value of PET-CT for peritoneal dissemination of abdominal malignancies[J]. Gan To Kagaku Ryoho, 2006, 33(12): 1817-21. |
| [6] | Mori T, Fujiwara Y, Yano M, et al. Prevention of peritoneal metastasis of human gastric cancer cells in nude mice by S-1, a novel oral derivative of 5-fluorouracil[J]. Oncology, 2003, 64(2): 176-82. |
| [7] | Osugi H, Takada N, Takemura M, et al. Oral fluoropyrimidine anticancer drug TS-1 for gastric cancer patients with peritoneal dissemination[J]. Oncol Rep, 2002,9(4): 811-5. |
| [8] | Emi Y, Yamamoto M, Takahashi I, et al. Phase Ⅱstudy of weekly paclitaxel by one-hour infusion for advanced gastric cancer[J]. Surg Today, 2008, 38(11): 1013-20. |
| [9] | Kobayashi M, Sakamoto J, Namikawa T, et al. Pharmacokinetic study of paclitaxel in malignant ascites from advanced gastric cancer patients[J]. World J Gastroenterol, 2006, 12(9): 1412-5. |
| [10] | Ueda Y, Yamagishi H, Ichikawa D, et al. Multicenter phase Ⅱ study of weekly paclitaxel plus S-1 combination chemotherapy in patients with advanced gastric cancer[J]. Gastric Cancer, 2010, 13(3): 149-54. |
| [11] | Wang X, Wang ML, Zhou LY, et al. Randomized phase Ⅱ study comparing paclitaxel with S-1 vs. S-1 as first-line treatment in patients with advanced gastric cancer[J]. Clin Transl Oncol, 2013, 15(10): 836-42. |
| [12] | Ishigami H, Kitayama J, Kaisaki S, et al. Phase Ⅱ study of weekly intravenous and intraperitoneal paclitaxel combined with S-1 for advanced gastric cancer with peritoneal metastasis[J]. Ann Oncol, 2010, 21(1): 67-70. |
| [13] | Yamaguchi H, Kitayama J, Ishigami H, et al. A phase 2 trial of intravenous and intraperitoneal paclitaxel combined with S-1 for treatment of gastric cancer with macroscopic peritoneal metastasis [J]. Cancer, 2013,119(18): 3354-8. |
| [14] | Imano M, Yasuda A, Itoh T, et al. Phase Ⅱ study of single intraperitoneal chemotherapy followed by systemic chemotherapy for gastric cancer with peritoneal metastasis[J]. J Gastrointest Surg, 2012, 16(12): 2190-6. |
| [15] | Koizumi W, Narahara H, Hara T, et al. S-1 plus cisplatin versus S-1 alone for first-line treatment of advanced gastric cancer (spirits trial): a phase Ⅲ trial[J]. Lancet Oncol, 2008, 9(3): 215-21. |
| [16] | Koizumi W, Kim YH, Fujii M, et al. Addition of docetaxel to S-1 without platinum prolongs survival of patients with advanced gastric cancer: a randomized study (start)[J]. J Cancer Res Clin Oncol, 2014, 140(2): 319-28. |
| [17] | Iwase H, Shimada M, Tsuzuki T, et al. A phase Ⅱ multi-center study of triple therapy with paclitaxel, S-1 and cisplatin in patients with advanced gastric cancer[J]. Oncology, 2011, 80(1-2): 76-83. |
| [18] | Shirao K, Boku N, Yamada Y, et al. Randomized phase Ⅲ study of 5-fluorouracil continuous infusion vs. Sequential methotrexate and 5-fluorouracil therapy in far advanced gastric cancer with peritoneal metastasis (JCOG0106)[J]. Jpn J Clin Oncol, 2013, 43(10): 972-80. |
| [19] | Takiuchi H, Fukuda H, Boku N, et al. Randomized phaseⅡ study of best-available 5-fluorouracil (5-Fu) versus weekly paclitaxel in gastric cancer (GC) with peritoneal metastasis (PM) refractory to 5-fu-containing regimens (JCOG0407)[C]. American:J Clin Oncol, 2010, 28(15). |
| [20] | Narahara H, Iishi H, Imamura H, et al. Randomized phaseⅢ study comparing the efficacy and safety of irinotecan plus S-1 with S-1 alone as first-line treatment for advanced gastric cancer (study GC0301/TOP-002)[J]. Gastric Cancer, 2011,14(1): 72-80. |
| [21] | Kodera Y, Imano M, Yoshikawa T, et al. A randomized phase Ⅱ trial to test the efficacy of intra-peritoneal paclitaxel for gastric cancer with high risk for the peritoneal metastasis (inpact trial)[J]. Jpn J Clin Oncol, 2011, 41(2): 283-6. |
| [22] | Jacquet P, Sugarbaker PH. Peritoneal-plasma barrier[J]. Cancer Treat Res, 1996, 82:53-63. |
| [23] | Hasovits C, Clarke S. Pharmacokinetics and pharmacodynamics of intraperitoneal cancer chemotherapeutics[J]. Clin Pharmacokinet, 2012, 51(4): 203-24. |
| [24] | Fushida S, Kinoshita J, Kaji M, et al. Phase Ⅰ/Ⅱ study of intraperitoneal docetaxel plus S-1 for the gastric cancer patients with peritoneal carcinomatosis[J]. Cancer Chemother Pharmacol, 2013, 71(5): 1265-72. |
| [25] | Fujiwara Y, Takiguchi S, Nakajima K, et al. Intraperitoneal docetaxel combined with S-1 for advanced gastric cancer with peritoneal dissemination[J]. J Surg Oncol, 2012, 105(1): 38-42. |
| [26] | Kyle AH, Huxham LA, Yeoman DM, et al. Limited tissue penetration of taxanes: a mechanism for resistance in solid tumors [J]. Clin Cancer Res, 2007, 13(9): 2804-10. |
| [27] | Los G, Mutsaers PH, van der Vijgh WJ, et al. Direct diffusion of cis-diamminedichloroplatinum(Ⅱ) in intraperitoneal rat tumors after intraperitoneal chemotherapy: a comparison with systemic chemotherapy[J]. Cancer Res, 1989, 49(12): 3380-4. |
| [28] | Pretorius RG, Petrilli ES, Kean CK, et al. Comparison of the iv. and ip. routes of administration of cisplatin in dogs[J]. Cancer Treat Rep, 1981, 65(11-12): 1055-62. |
| [29] | Hallissey MT, Allum WH, Roginski C, et al. Palliative surgery for gastric cancer[J]. Cancer, 1988, 62(2): 440-4. |
| [30] | Lasithiotakis K, Antoniou SA, Antoniou GA, et al. Gastrectomy for stage Ⅳ gastric cancer. a systematic review and meta-analysis [J]. Anticancer Res, 2014, 34(5): 2079-85. |
| [31] | Spratt JS, Adcock RA, Sherrill W, et al. Hyperthermic peritoneal perfusion system in canines[J]. Cancer Res, 1980, 40(2): 253-5. |
| [32] | Liu X, Cai H, Sheng W, et al. Long-term results and prognostic factors of gastric cancer patients with microscopic peritoneal carcinomatosis[J]. PLoS One, 2012, 7(5): e37284. |
| [33] | He MM, Zhang DS, Wang F, et al. The role of non-curative surgery in incurable, asymptomatic advanced gastric cancer[J]. PloS One, 2013, 8(12): e83921. |
| [34] | Glehen O, Gilly FN, Arvieux C, et al. Peritoneal carcinomatosis from gastric cancer: a multi-institutional study of 159 patients treated by cytoreductive surgery combined with perioperative intraperitoneal chemotherapy[J]. Ann Surg Oncol, 2010, 17(9): 2370-7. |
| [35] | Rudloff U, Langan RC, Mullinax JE, et al. Impact of maximal cytoreductive surgery plus regional heated intraperitoneal chemotherapy (hipec) on outcome of patients with peritoneal carcinomatosis of gastric origin: results of the gymssa trial[J]. J Surg Oncol, 2014, 110(3): 275-84. |
| [36] | Yang XJ, Huang CQ, Suo T, et al. Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy improves survival of patients with peritoneal carcinomatosis from gastric cancer: final results of a phaseⅢ randomized clinical trial[J]. Ann Surg Oncol, 2011, 18(6): 1575-81. |
| [37] | Bang YJ, Van Cutsem E, Feyereislova A, et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of her2-positive advanced gastric or gastro-oesophageal junction cancer (toga): a phase 3, open-label, randomised controlled trial[J]. Lancet, 2010, 376(9742): 687-97. |
| [38] | mano M, Satou T, Itoh T, et al. Peritoneal metastatic lesions of gastric cancer exhibit low expression of human epidermal growth factor receptor 2[J]. Target Oncol, 2012, 7(4): 213-6. |
| [39] | Imano M, Itoh T, Satou T, et al. High expression of epithelial cellular adhesion molecule in peritoneal metastasis of gastric cancer[J]. Target Oncol, 2013, 8(4): 231-5. |
| [40] | Bokemeyer C, Ridwelski K, Atanackovic D, et al. 2-year follow-up of a phase Ⅱ study on catumaxomab as part of a multimodal approach in primarily resectable gastric cancer[C]. England: Ann Oncol, 2012, 23: 228. |
| [41] | Heiss MM, Murawa P, Koralewski P, et al. The trifunctional antibody catumaxomab for the treatment of malignant ascites due to epithelial cancer: results of a prospective randomized phase Ⅱ/Ⅲ trial [J]. Int J Cancer, 2010, 127(9): 2209-21. |
| [42] | Goéré D, Gras-Chaput N, Aupérin A, et al. Treatment of gastric peritoneal carcinomatosis by combining complete surgical resection of lesions and intraperitoneal immunotherapy using catumaxomab[J]. BMC Cancer, 2014, 14: 148. |
 2015, Vol. 42
2015, Vol. 42


