文章信息
- 雷旦生,裴锋,喻晶,王堃,朱毅. 2015.
- LEI Dansheng, PEI Feng, YU Jing, WANG Kun, ZHU Yi. 2015.
- 组织多肽抗原联合ProGRP、CEA、NSE、SCC、CYFRA21-1在肺癌诊治中的价值
- Evaluation Value of Tissue Polypeptide Antigen Combined with ProGRP, CEA, NSE, SCC and CYFRA21-1 on Patients with Lung Cancer
- 肿瘤防治研究, 2015, 42(05): 488-492
- Cancer Research on Prevention and Treatment, 2015, 42 (05): 488-492
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.05.015
-
文章历史
- 收稿日期:2014-06-13
- 修回日期:2014-09-20
2. 430079 武汉,湖北省肿瘤医院胃肠外科
2.Department of Gastrointestinal Surgery, Hubei Cancer Hospital, Wuhan 430079, China
组织多肽抗原(tissue polypeptide antigen,TPA)是与角蛋白8、18和19相关的多肽类物质[1],在上皮性肿瘤中表达增加,因此,TPA的水平直接反映了细胞增殖、分化率和肿瘤的浸润程度,是肿瘤增殖性标志[2, 3, 4, 5]。肺癌是目前发病率及致死率都非常高的一种恶性肿瘤,近年来发病率日趋增高,且不易早期诊断,五年生存率约15%[6],因此对肺癌的早期发现、诊断及治疗至关重要。细胞角蛋白19可溶性片段CYFRA21-1是肺癌标志物[2],尤其在肺鳞癌中有高表达。作为角蛋白8、18、19相关的多肽物质TPA与肺癌密切相关[7],本研究将详细探讨TPA在肺癌诊断与疗效监测中的应用价值。 1 资料与方法 1.1 资料
选择2013年1月—2013年10月在湖北省肿瘤医院住院治疗的肺癌患者238例,其中男179例、女59例,年龄19~80岁,平均年龄57.1岁,均经病理确诊。根据患者病情,将肺癌患者分为局限期(Ⅰ~Ⅱ期,仅限于同侧肺和淋巴结)和广泛期(Ⅲ~Ⅳ期,扩散到另一侧肺或对侧胸部淋巴结,或远处器官,或出现恶性胸腔积液)。肺部良性疾病25例,男20例、女5例,年龄40~81岁,平均年龄58.6岁,均无其他疾患。健康对照组65例,为本院健康体检者,男40名,女25名,年 龄19~78岁,平均年龄44.8岁,均无肺部、胃肠及肝肾疾患。 1.2 试剂与仪器
TPA、CEA、NSE试剂盒和DiaSorin-XL化学发光免疫分析仪(意大利DiaSorin公司)。ProGRP、SCC、CYFRA211试剂盒和i2000SR化学发光免疫分析仪(美国Abbott公司)。 1.3 标本采集
采用带有惰性分离胶的进口真空采血管,抽取待检者空腹静脉血4 ml;自然凝集30 min,8℃ 2 300 g离心15 min,分离血清,-80℃保存待测。 1.4 标本检测与质量控制
采用DiaSorin-XL全自动化学发光免疫分析仪测定TPA、CEA、NSE浓度,采用i2000SR化学发光免疫分析仪及原装进口配套试剂检测ProGRP、NSE、SCC、CYFRA21-1的数值;标准品及质控品均为原装配套试剂;室内质控、室间质控均合格。根据本实验室前期大样本量的研究结果,确定CEA、NSE、ProGRP、SCC、CYFRA21-1数值的临界值分别为7.2、18、64、1.5和2.52。 1.5 统计学方法
采用SPSS17.0统计软件进行统计学分析。以ROC曲线确定TPA临界值及AUC;各组指标的浓度均呈偏态分布,采用中位数(四分位数)表示,各组间数据的比较采用非参数Kruskal-Wallis检验,判断各组间差异的显著性,再采用Mann-Whitney U检验进一步做两两比较,P<0.05为差异有统计学意义。敏感度=真阳性人数/(真阳性人数+假阴性人数)×100%,特异性=真阴性人数/(真阴性人数+假阳性人数)×100%,有效性=(真阳性人数+真阴性人数)/总人数×100%。以敏感度为纵坐标代表真阳性率,(1-特异性)为横坐标代表假阳性率,绘成ROC曲线并进行分析。 2 结果 2.1 各组血清TPA检测结果比较
肺癌患者TPA水平明显高于健康对照组(P =0.000)及肺部良性疾病患者(P=0.02),差异有统计学意义(P均<0.05);而肺部良性疾病患者与健康对照组之间差异均无统计学意义(P=0.114),见表 1。
 |
肺癌患者的TPA、CEA、NSE、ProGRP、SCC、CYFRA21-1进行ROC曲线分析,见图 1。通常情况下,曲线下面积越大,鉴别诊断价值越高[8, 9]。各指标曲线下面积:TPA为(0.824±0.058),ProGRP为(0.637±0.075),CEA为(0.825±0.055),NSE为(0.625±0.075),SCC为(0.606±0.076),CYFRA21-1为(0.819±0.059)。
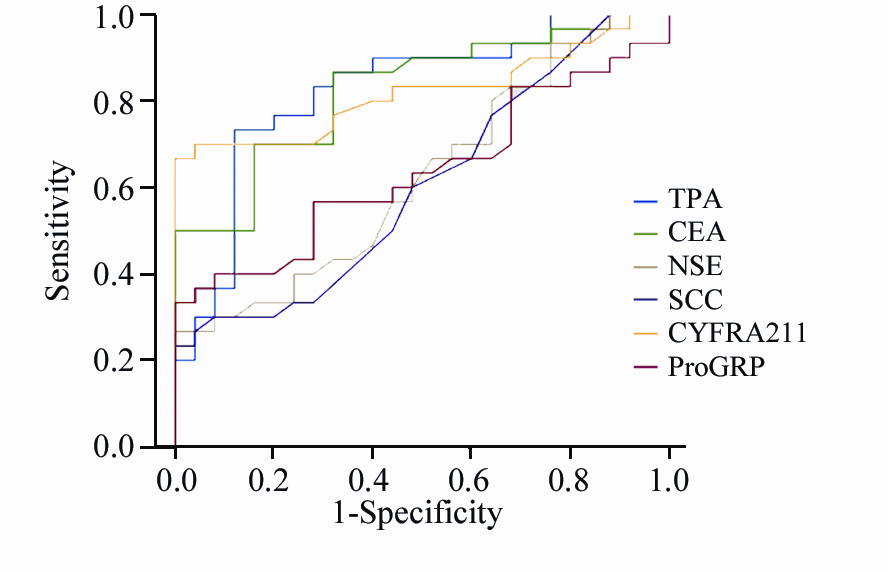
|
| 图1 肺癌患者的六种标志物ROC曲线 Figure 1 ROC curves of six tumor markers:TPA, CEA, NSE, SCC, CYFRA211, ProGRP in lung cancer patients |
TPA与CEA、SCC、CYFRA21-1以并联形式联合检测时,诊断NSCLC的敏感度和特异性为161/191(85.86%)和124/137(90.51%);TPA与CEA、NSE、ProGRP以并联形式联合检测时,诊断SCLC的敏感度为39/47(82.98%)、特异性为252/281(89.68%),血清TPA及肺癌标志物对不同病理类型肺癌诊断的敏感度和特异性比较,见表 2。
 |
以临床实际检测数值分别计算四项、五项、六项组合的敏感度、特异性和有效性,结果经χ2检验,χ2值分别为0.49、0.13、0.22(P均>0.05),即四项、五项、六项组合差异无统计学意义。联合检测可明显提高诊断敏感度及有效性,虽差异无统计学意义,但数值上以六项组合的敏感度和有效性最高,而特异性有所下降,见表 3。
 |
随肺癌的分期升高,TPA水平明显升高,临床晚期患者(Ⅲ~Ⅳ期)明显高于健康对照组(P=0.000)和早期患者(P=0.003),且早期患者(Ⅰ~Ⅱ期)与健康对照组间差异有统计学意义(P=0.002)。随病程进展TPA敏感度逐步升高,Ⅲ、Ⅳ期肺癌患者达到50%以上,见表 4。
 |
238例肺癌患者中,对其中33例肺癌患者进行随访测定。其中25例术后1月经B型超声及影像学检查未见复发转移,TPA、ProGRP、CEA、NSE、CYFRA21-1水平较术前降低,结果有显著性差异,见表 5。另外8例不能手术的肺癌患者每1~2月监测1次(2013年1月~10月),其中6例患者六项标志物可见不同水平增高,经B型超声及影像学检查证实复发转移;其余2例患者至观察结束止,未见明显升高,经B型超声及影像学检查未见复发转移。
 |
TPA是与角蛋白8、18和19相关的多肽类物质,在上皮性肿瘤中表达增加,由增殖细胞产生和释放,因此,TPA水平直接反映了细胞增殖、分化率和肿瘤的浸润程度,是肿瘤增殖性标志[4, 5]。血清TPA水平显示出与细胞生长速率和肿瘤分级的良好相关性,可用于肿瘤治疗后的疗效判断,可较早发现肿瘤复发[7],且TPA在肿瘤的临床应用已有多方报道[1, 2, 3, 4, 5, 7]。本研究全面评估了TPA联合ProGRP及其他四种血清标志物(CEA、SCC、NSE、CYFRA21-1)在肺癌中的临床价值[10, 11]。此外,以往研究TPA多为放射免疫分析或酶联免疫分析方法,此次研究首次采用TPA化学发光试剂,化学发光法相比于前两种方法具有敏感度高、精密度好、重复性好、操作简便等优势,评估化学发光法TPA检测在肺癌中的临床应用,将使TPA更好的运用于临床肺癌诊断及疗效评估。
本研究发现,肺癌患者血清TPA浓度显著高于肺良性疾病组和健康对照组,与文献报道一致。TPA与标志物五项(CEA、NSE、ProGRP、SCC、CYFRA21-1)单项检测肺癌时[10, 11],以TPA敏感度最高(50%),CYFRA21-1的特异性最好(94.44%)。研究还发现TPA诊断肺鳞癌的敏感度为56.16%,特异性为66.67%;诊断肺腺癌的敏感度为49.15%,特异性为67.62%;诊断SCLC的敏感度为42.55%,特异性为62.28%。TPA联合CEA、SCC、CYFRA21-1诊断NSCLC的敏感度可提高到85.86%,特异性提高到90.51%;TPA联合CEA、NSE、ProGRP诊断SCLC的敏感度可提高到82.89%,特异性提高到89.68%。TPA联合传统的肺癌标志物可大大提高肺癌诊断的敏感度,有利于肺癌的早期发现和诊断。
肺癌患者TPA水平与肿瘤分期及转移明显相关。随肺癌的进展,TPA水平明显升高,临床分期越晚,患者血清TPA水平越高,甚至可高达>1 000 u/L。我们发现患者血清TPA水平可随着病情缓解而下降,且治疗前TPA水平越高的肺癌患者,预后越差。术后TPA水平下降对手术疗效的监测具有一定临床价值。因此TPA更重要的价值在于作为临床治疗监测的有效工具及提示疾病复发转移的有效指标[12, 13]。尤其是联合六项肺癌标志物进行动态监测并综合分析,对指导临床疗效监测尤其重要[12, 13]。
综上,TPA在肺癌患者血清中可呈现不同程度的高表达,合理进行联合检测,可对肺癌患者进行早期诊断、疗效监测及疗效评价。由于临床研究中患者追踪采样存在较大的困难,肺癌患者病情监测及预后入组患者数有限,本文的此项结果尚待大样本量的研究证实。建议在肺癌临床工作中,将TPA联合五项肺癌标志物(CEA、CYFRA21-1、SCC、NSE、ProGRP)应用紧密结合并进行动态监测,以更好地提高肺癌的临床诊疗水平。
| [1] | Niho S, Shinkai T. Tumor markers in lung cancer[J]. Gan To Kagaku Ryoho, 2001, 28(13): 2089-93. |
| [2] | Schneider J, Philipp M, Velcovsky HG, et al. Pro-gastrin-releasing peptide(ProGRP), neuron specific enolase(NSE), carcinoembryonic antigen(CEA) and cytokeratin 19-fragments (CYFRA 21-1) in patients with lung cancer in comparison to other lung diseases[J]. Anticancer Res, 2003, 23(2A): 885-93. |
| [3] | Bennink R, Van Poppel H, Billen J, et al. Serum tissue polypeptide antigen (TPA): monoclonal or polyclonal radio-immunometric assay for the follow-up of bladder cancer[J]. Anticancer Res, 1999, 19(4A): 2609-13. |
| [4] | Sugiyama Y, Kawaguchi Y. Tissue polypeptide antigen(TPA)[J].Nihon Rinsho, 2005, 63(suppl8): 705-7. |
| [5] | Shimojo K, Watanabe N, Sakai S, et al. A basic and clinical evaluation of a new immunoradiometric assay kit for human serum tissue polypeptide antigen(TPA)[J]. Kaku Igaku, 1996, 33(6): 655-61. |
| [6] | Zhang XD, Li W, Liu XL, et al. Diagnostic value of serum from cancer patient in detection of epidermal growth factor receptor mutation: a Meta-analysis[J]. Zhong Liu Fang Zhi Yan Jiu, 2014, 41(5): 409-12. [张学德, 李维, 刘晓丽, 等. 肺癌患者血清EGFR突变诊断实验的Meta分析[J]. 肿瘤防治研究, 2014, 41(5): 409-12.] |
| [7] | Takahashi H, Kameda H. Clinical significance of tissue polypeptide antigen as a tumor marker[J]. Nihon Rinsho, 1990, 48 Suppl: 928-30. |
| [8] | Li XX, Zhou SL, Wang HJ, et al. To investigate the clinical value of four tumor markers in small cell lung cancer[J]. Zhonghua Jian Yan Yi Xue Za Zhi, 2008, 31(9): 1011-5. [李学祥, 周善良, 王憨杰, 等. 四种肿瘤标志物联合检测在小细胞肺癌中的临床价值[J]. 中华检验医学杂志, 2008, 31(9): 1011-5.] |
| [9] | Luo SW, Ou CP, Zhang LP, et al. Application of ROC curve to evaluate CEA, CYFRA21-1,SCC to non-small cell lung cancer diagnosis value[J]. Chongqin Yi Xue, 2011, 40(3): 250-5.[罗疏薇, 欧春萍, 张莉萍, 等. 应用ROC曲线评价CEA、CYFRA211、SCC对非小细胞肺癌的诊断价值[J]. 重庆医学, 2011, 40(3): 250-5.] |
| [10] | Wang GH, Wan WH, Liu B, et al. To investigate the clinical value of four tumor markers in non-small cell lung cancer[J]. Zhonghua Jian Yan Yi Xue Za Zhi, 2003, 26(8): 491-4. [王国洪, 万文徽, 刘波, 等. 四种肿瘤标志检测非小细胞肺癌的临床运用研究[J]. 中华检验医学杂志, 2003, 26(8): 491-4.] |
| [11] | Yu WP, Zheng XH, Wu JW. The study progress of ProGRP in diagnosis of small cell lung cancer[J]. Shantou Da Xue Yi Xue Yuan Xue Bao, 2004, 17(2): 127-9. [余文聘, 郑小河, 吴洁文. 胃泌素释放肽前体在小细胞肺癌诊断中的研究进展[J].汕头大学医学院学报, 2004, 17(2): 127-9.] |
| [12] | Wu JM. Recognition of tumor markers[J]. Zhonghua Jian Yan Yi Xue Za Zhi, 2005, 28(1): 11-2. [吴健民. 对肿瘤标志物的再认识[J]. 中华检验医学杂志, 2005, 28(1): 11-2.] |
| [13] | Wang P, Cao YT, Li JH, et al. Clinical diagnosis value of combined detection of serum tumor markers in early non small lung cancer[J]. Zhonghua Quan Ke Yi Shi Za Zhi, 2013, 12(11): 921-3. [王萍, 曹永彤, 李京华, 等. 血清肿瘤标志物联合检测对非小细胞肺癌早期诊断的临床价值[J]. 中华全科医师杂志, 2013, 12(11): 921-3.] |
 2015, Vol. 42
2015, Vol. 42
