文章信息
- 朱燕,伍钢,欧阳礼辰,朱芳,陈静,周毅. 2015.
- ZHU Yan, WU Gang, OUYANG Lichen, ZHU Fang, CHE Jing, ZHOU Yi. 2015.
- 神经节苷脂GM3对人宫颈癌HeLa细胞凋亡和血管内皮生长因子表达的影响
- Effects of Monosialoganglioside-3 on Apoptosis and VEGF Expression in Human Cervical Cancer Cell Line HeLa
- 肿瘤防治研究, 2015, 42(05): 450-453
- Cancer Research on Prevention and Treatment, 2015, 42 (05): 450-453
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.05.006
-
文章历史
- 收稿日期:2014-03-25
- 修回日期:2014-11-19
子宫颈癌是女性常见的生殖道恶性肿瘤,以鳞状上皮细胞癌为主,约占90%~95%,腺癌仅占5%~10%。近年来宫颈癌的发病率有明显上升趋势[1]。对于宫颈癌早期患者可行手术治疗,同时配合放疗、化疗可以达到较好的治疗效果。但是对于那些手术估计难以切除者或晚期宫颈癌患者并没有好的治疗手段,放化疗效果差,且花费高,严重影响生存质量[2]。随着基因组学和蛋白组学的不断研究,寻找疗效佳毒性小的靶向新药成为宫颈癌治疗的新战略。
单唾液酸神经节甘酯3( monosialoganglioside-3,GM3)是一类含唾液酸的糖鞘脂,广泛存在于哺乳动物各组织的细胞膜上[3]。研究表明,GM3除了参与细胞间识别、连接、运动和信息传递等多个过程,还具有抗肿瘤作用[4]。本研究通过体外实验观察了GM3对人宫颈癌HeLa细胞增殖、凋亡及血管内皮生长因子(VEGF)表达的影响,以了解GM3在体外宫颈癌细胞生物学行为的影响,为其应用于临床抗宫颈癌治疗寻找新的理论依据。
1 材料和方法 1.1 实验材料 1.1.1 细胞系人宫颈癌HeLa细胞由华中科技大学协和医院肿瘤中心实验室提供,37℃、5%CO2饱和湿度培养箱内常规培养。
1.1.2 试剂 RPMI1640培养液和小牛血清购自美国Gibco公司,胰酶购自中国众一生物公司,神经节苷脂GM3购自美国Alexis公司(ALX-302-005),MTT和DMSO购自美国Amresco公司,Annexin V-FITC细胞凋亡检测试剂盒购自美国CAT公司,RT-PCR全部试剂购自美国Invitrogen公司,蛋白Marker及兔抗人VEGF多克隆抗体购自美国Santa Cruz公司,CY-3标记羊抗兔IgG购自美国Ptglab公司,其他试剂均为国产分析纯。
1.2 实验方法分组:设置实验组(experiment group),对照组(control group)及空白组(blank group)。对照组不加药物只加细胞及培养液,空白组不加药物和细胞只加培养液。培养:常规法培养HeLa细胞24 h后,实验组中加入不同浓度GM3。
1.2.1 MTT法实验组GM3终浓度分别为2、10、50和250 μmol/L,每孔终体积为100 μl。继续培养24 h后每孔加入MTT溶液(5 g/L)10 μl,相同条件下继续培养4 h后,每孔加入DMSO 200 μl(0.5 g/L),振荡10 min。酶标仪检测630 nm波长处的每孔吸光度(OD值),以上操作重复三次。计算HeLa细胞生长抑制率(IR),并绘制细胞生长抑制曲线。
1.2.2 Annexin V-FITC/PI法实验组GM3终浓度分别为10、50和250 μmol/L,继续培养24 h后收集、洗涤细胞。操作过程严格按照“Annexin V-FITC/PI细胞凋亡检测”试剂盒说明书进行。所有样本避光,1 h内用流式细胞仪检测。以上操作重复三次。
1.2.3 RT-PCR法实验组GM3终浓度分别为10、50和250 μmol/L,继续培养24 h后,提取各孔细胞总RNA,参照TRIzol(美国Invitrogen公司)试剂说明书进行。用M-MLV反转录酶进行cDNA合成。Primer Premier5.0软件设计PCR扩增引物序列:VEGF上、下游引物分别为:5′-GCCTTGCCTTGCTGCTCTAC-3′,5′-TCCTATGTGCTGGCCTTGGT-3′,扩增片段长度为323 bp。GAPDH上、下游引物分别为:5′-ACCACAGTCCATGCCATCAC-3′,5′-TCCACCACCCTGTTGCTGTA-3′,扩增片段长度为451 bp。参照文献进行PCR扩增,预变性、变性、退火、复性、延伸,共35个循环,其中VEGF退火温度为62.1℃,GAPDH退火温度为56.8℃。PCR扩增产物电泳,用Marker来鉴定其相对分子质量,凝胶电泳成像系统拍照,以上操作重复四次。图像分析软件测量吸光度值,以“VEGF条带吸光度值/GAPDH条带吸光度值”表示细胞VEGF mRNA 的相对表达水平。
1.2.4 Western blot法实验组各孔加入GM3使终浓度分别为2、10、50和250 μmol/L,继续培养24 h后,漂洗、消化、收集、再洗涤、裂解、超声粉碎、离心、紫外分光仪测蛋白浓度。电泳、转膜、封闭。行抗原抗体反应:一抗(兔抗人1:100)4℃湿盒孵育过夜,次日洗涤,加即用通用型二抗(羊抗兔1:300)37℃水浴1 h,洗涤后显色。采用UVP凝胶成像系统照相,记录条带的OD值并半定量分析结果,以“VEGF条带吸光度值/β-actin条带吸光度值”表示。
1.3 统计学方法采用SPSS18.0统计学软件进行分析,实验数据用(x±s)表示,采用t检验比较实验组和对照组之间的差异。P < 0.05为差异有统计学意义。
2 结果 2.1 MTT法检测GM3对HeLa细胞增殖的影响浓度分别为2、10、50和250 μmol/L的外源性GM3作用HeLa细胞24 h后,细胞抑制率分别为9.8%、32.9%、50.7%、78.6%。当GM3浓度高于10 μmol/L,以上各组对HeLa细胞增殖均有抑制作用,抑制率与对照组相比差异有统计学意义(P<0.05),见表 1。随着药物浓度不断增加,HeLa细胞增殖抑制率也逐渐增加,具有浓度依赖性,呈现良好的量效关系,计算得出GM3对HeLa细胞作用24 h的IC50为49.8 μmol/L。
浓度分别为10、50和250 μmol/L的外源性GM3作用HeLa细胞24 h后,流式细胞学技术检测细胞凋亡。随着GM3浓度增加,右下象限内的红点密度逐渐升高,表明凋亡早期HeLa细胞量逐渐增加;随着GM3浓度增加,右上象限内的红点密度也逐渐升高,表明凋亡晚期HeLa细胞量也逐渐增加,见图 1A~1D。Cell Quest软件分析结果:对照组HeLa细胞凋亡率为1.0%,实验组GM3浓度分别为10、50、250 μmol/L,HeLa细胞凋亡率分别为(4.9±0.4)%(P < 0.042)、(15.1±0.3)%(P < 0.031)、(24.4±0.7)%(P < 0.047)。与对照组相比,当GM3浓度高于10 μmol/L时,其促进HeLa细胞凋亡作用明显(P < 0.05)。
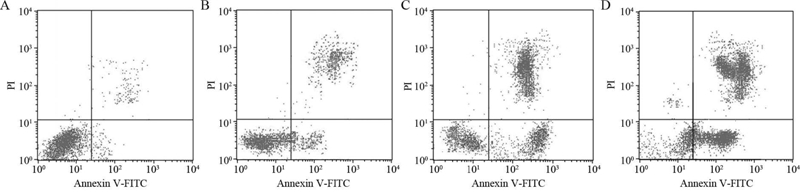
|
| A: Control group; B-D: GM3 concentration; 10 μmol/L,50 μmol/L,250 μmol/L 图 1 Annexin V-FITC/PI法检测GM3对HeLa细胞凋亡的影响 Figure 1 The effect of exogenous GM3 on HeLa cells apoptosis detected by Annexin V-FITC/PI |
GAPDH作内参对照,琼脂糖凝胶电泳成像,见图 2。图像分析软件测量“VEGF吸光度值/GAPDH吸光度值”,见表 2。与对照组相比,GM3浓度高于10 μmol/L各组HeLa细胞VEGF mRNA表达均下降(P<0.05),并且随GM3浓度增高,HeLa细胞VEGF mRNA表达下降更明显,呈明显的量效关系。250 μmol/L组GM3下调HeLa细胞VEGF mRNA作用最明显(P<0.05)。
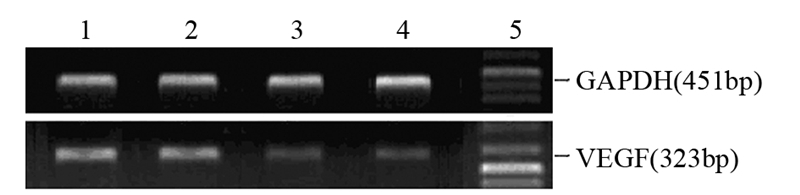
|
| 1: Control group; 2-4: GM3 concentration: 10μmol/L,50μmol/L, 250μmol/L; 5: Marker 图 2 RT-PCR法检测GM3对HeLa细胞VEGF mRNA表达 的影响 Figure 2 The effect of exogenous GM3 on VEGF mRNA expression in HeLa cells detected by RT-PCR |
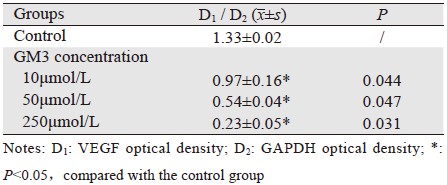 |
β-actin作内参对照,UVP凝胶成像系统照相,见图 3。图像分析软件测量“VEGF吸光度值/β-actin吸光度值”,见表 3。与对照组相比,GM3浓度高于10 μmol/L各组HeLa细胞VEGF 蛋白表达均下降(P<0.05),并且随GM3浓度增高,HeLa细胞VEGF 蛋白表达下降更明显,呈明显的量效关系,与RT-PCR结果相一致。
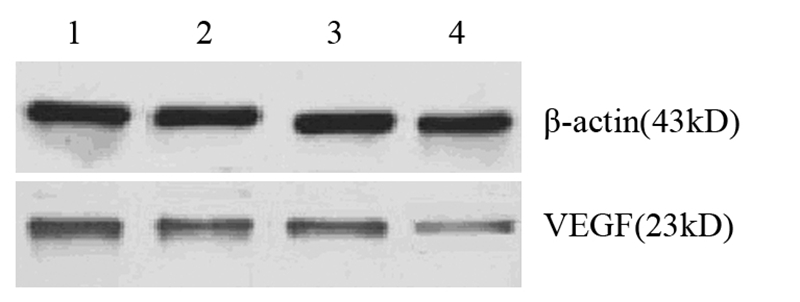
|
| 1: Control group; 2-4: GM3 concentration: 10 μmol/L,50 μmol/L,250 μmol/L 图 3 Western blot法检测GM3对HeLa细胞VEGF蛋白表达的影响 Figure 3 The effect of exogenous GM3 on VEGF protein expression in HeLa cells detected by Western blot |
 |
GM3可以通过自分泌或旁分泌方式作用于肿瘤及肿瘤相关宿主细胞如巨噬细胞,内皮细胞等,参与细胞间的识别、黏着、增殖、分化、凋亡、信号传递等过程[5]。本实验结果显示外源性神经节苷脂GM3能呈浓度依赖性抑制人宫颈癌HeLa细胞细胞增殖,促进HeLa细胞凋亡,还能下调HeLa细胞VEGF mRNA和蛋白的表达水平。本实验结果和目前一些学者所观察到的有关GM3抗肿瘤作用是一致的[6]。
随着分子水平和基因水平的研究进展,GM3调节肿瘤细胞凋亡的作用逐渐受到关注。GM3联合CD9和CD82,形成细胞表面复合物,抑制细胞生长并诱导细胞凋亡[7]。已证实GM3参与细胞凋亡是依赖caspase蛋白酶级联放大反应通路[8],但是GM3诱导细胞凋亡分子机制尚无定论,与肿瘤坏死因子和内皮素-1介导的信号转导途径都有关。本实验证实GM3能呈浓度依赖性促进HeLa细胞凋亡,推测其下游通道可能是通过以上信号途径进行,可为今后深入研究分子机制提供切入点。
大量研究表明VEGF参与了宫颈癌的发生、发展和转移,与宫颈癌的恶性程度密切相关,可作为一项评估宫颈癌生物学行为的有力指标[9]。肿瘤细胞能选择性地表达功能性的VEGF受体,形成自分泌环。研究发现VEGF与其自身受体特异性结合促进肿瘤细胞的增殖浸润,同时还具有抗肿瘤细胞凋亡作用,激活不同的抗凋亡基因Hsp90、Bcl22、MCL1、ZK7和survivin等高表达,通过一系列分子机制最终导致细胞凋亡的膜受体途径和线粒体途径不同程度受阻[10]。以VEGF作为抗肿瘤血管生成治疗的靶点,特异性强,对正常组织影响小,不仅能使肿瘤组织内的血管生成明显减少,还能抑制肿瘤生长并抵消VEGF的抗肿瘤细胞凋亡作用。近年来研究发现神经节苷脂GM3能通过抑制VEGF与其受体之间的作用,从而抑制人脐血静脉内皮细胞增殖和迁移,明显阻滞VEGF诱导的血管新生作用。Chung等[11]证实GM3特异性与VEGFR-2细胞外区域发生作用,阻滞VEGF与VEGFR-2结合,抑制VEGFR-2二聚体形成和激活。GM3是目前发现的唯一能直接与VEGFR作用的神经节苷脂,但是还没有关于GM3与肿瘤内源性VEGF之间关系的研究。本实验结果显示不同浓度GM3作用后,VEGF的下调程度与HeLa细胞凋亡程度一致,提示GM3不仅能抑制VEGF诱导的肿瘤血管新生,还能抵消VEGF抗肿瘤细胞凋亡作用。以VEGF为靶分子,用GM3对抗肿瘤血管新生,促进肿瘤细胞凋亡,在抗宫颈癌的治疗上有非常好的临床应用前景。
GM3分子量中等,同时具有脂溶性和水溶性,易穿透各种组织屏障,且有着其他化疗药物不可比及的耐受性高、毒性小的特点,大量研究提示其能通过多种途径抑制肿瘤生长[12]。本研究通过体外实验亦证实GM3对宫颈癌细胞株HeLa具有增殖抑制、促进凋亡的作用,同时能下调HeLa细胞VEGF mRNA及蛋白的表达。深入对GM3的研究,有望为宫颈癌的治疗提供新的治疗手段。
| [1] | Vici P, Mariani L, Pizzuti L, et al. Emerging Biological Treatments for Uterine Cervical Carcinoma[J]. J Cancer, 2014, 5(2): 86-97. |
| [2] | Shi H, Li W. Inhibitory effects of human lactoferrin on U14 cervical carcinoma through upregulation of the immune response[J]. Oncol Lett, 2014, 7(3): 820-6. |
| [3] | Regina Todeschini A, Hakomori SI. Functional role of glycosphingolipids and gangliosides in control of cell adhesion, motility, and growth, through glycosynaptic microdomains[J]. Biochim Biophys Acta, 2008, 1780(3): 421-33. |
| [4] | Margheri F, Papucci L, Schiavone N, et al. Differential uPAR recruitment in caveolar-lipid rafts by GM1 and GM3 gangliosides regulates endothelial progenitor cells angiogenesis[J]. J Cell Mol Med, 2015, 19(1): 113-23. |
| [5] | Yoon SJ, Ikeda S, Sadilek M, et al. Self-recognition of N-linked glycans with multivalent GlcNAc, determined as ceramide mimetic conjugate[J]. Glycobiology, 2007, 17(9): 1007-14. |
| [6] | Mukherjee P, Faber AC, Shelton LM, et al. Ganglioside GM3 suppresses the proangiogenic effects of vascular endothelial growth factor and ganglioside GD1a[J]. J Lipid Res, 2008, 49(5): 929-38. |
| [7] | Wang XQ, YanQ, Sun P, et al. Suppression of epidermal growth factor receptor signaling by protein kinase C-α activation requires CD82, caveolin-1, and ganglioside[J]. J Cancer Res, 2007, 67 (20): 9986-95. |
| [8] | Anastasia L, Papini N, Colazzo F, et al. NEU3 sialidase strictly modulates GM3 levels in skeletal myoblasts C2C12 thus favoring their differentiation and protecting them from apoptosis[J]. J Biol Chem, 2008, 283(52): 36265-71. |
| [9] | Long M, Dong K, Gao P, et al. Overexpression of astrocyte-elevated gene-1 is associated with cervical carcinoma progression and angiogenesis[J]. Oncol Rep, 2013, 30(3): 1414-22. |
| [10] | Van Cruijsen H, Ruiz MG, van der Valk P, et al. Tissue micro array analysis of ganglioside N-glycolyl GM3 expression and signal transducer and activator of transcription(STAT)-3 activation in relation to dendritic cell infiltration and microvessel density in non-small cell lung cancer[J]. BMC Cancer, 2009, 9: 180. |
| [11] | Chung TW, Kim SJ, Choi HJ. Ganglioside GM3 inhibits VEGF/VEGFR-2-mediated angiogenesis: Direct interaction of GM3 with VEGFR-2[J]. Glycobiology, 2009, 19(3): 229-39. |
| [12] | Zhu Y, Wu G. Ganglioside GM3 and tumor[J]. Zhong Liu Fang Zhi Yan Jiu, 2011, 38(1): 112-4. [朱燕, 伍钢. 神经节苷脂GM3与肿瘤[J]. 肿瘤防治研究, 2011, 38(1): 112-4.] |
 2015, Vol. 42
2015, Vol. 42



