文章信息
- 汪丽菁,程向东,徐志远,应莉莎,谢华夏. 2015.
- WANG Lijing, CHENG Xiangdong, XU Zhiyuan, YING Lisha, XIE Huaxia. 2015.
- 苦参碱联合X线对肝癌细胞协同杀伤作用的实验
- Synergistic Killing Effect and Mechanism of Matrine Combined with X-ray on HepG2
- 肿瘤防治研究, 2015, 42(05): 442-445
- Cancer Research on Prevention and Treatment, 2015, 42 (05): 442-445
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.05.004
-
文章历史
- 收稿日期:2014-12-26
- 修回日期:2015-02-17
2. 310006 杭州,浙江省中医药大学第一临床医学院普外科;
3. 310022 杭州,浙江省肿瘤研究所 浙江省癌症中心
2. Department of Gastrointestinal Surgery, The First Affiliated Hospital of Zhejiang Chinese Medicine University, Hangzhou 310006, China;
3. Zhejiang Cancer Research Institute, Zhejiang Cancer Center, Hangzhou 310022, China
肝癌细胞对离子辐射敏感度相对较差、肝脏对X线耐受性低[1],严重制约着放疗在肝癌中的应用。因此迫切需要寻找一种新的药物以提高肝癌细胞对放疗的敏感度且不增加放疗对正常肝组织的损伤。本课题组前期研究发现,苦参碱有抑制肝癌细胞生长的作用,且早期就可以引起细胞内谷胱甘肽(GSH)耗竭、氧自由基增加、抑制Bcl-2蛋白表达,通过线粒体途径诱导肝癌细胞凋亡。本研究就苦参碱和放射线对肝癌细胞的协同杀伤作用及其机制进行探讨。
1 材料与方法 1.1 材料和试剂苦参碱10 g/L,每支5 ml,购自江苏连云山制药有限公司,抗细胞色素C、Bcl-2、Bax单克隆抗体、抗caspase-9单克隆抗体购于美国Chemicon 公司,N-乙酰半胱氨酸(NAC)、L-buthionine-sulfoximine(BSO)购于美国Sigma公司,HepG2细胞由德国洪堡大学Ruth Swartzlander博士馈赠;DMEM细胞培养液购自德国Biochrom公司;CellTiter 96® Aqueous试剂购于美国Promega公司;细胞凋亡ELISA检测试剂盒为瑞士Roche公司产品;谷胱甘肽还原酶购自德国Boehringer公司。
1.2 细胞培养HepG2细胞在含10%小牛血清,100 u/ml青霉素,100 μg/ml链霉素,1%非必需氨基酸,1 mmol/L的DMEM培养液中,37℃、5%CO2条件下培养。
1.3 细胞活力检测HepG2细胞以0.05×106个/孔的密度培养于96孔板中。于各检测点采用MTT法检测细胞活力,检测方法参照说明书。
1.4 LDH、AST水平检测和蛋白含量测定原代人肝细胞以0.5×106个/孔的密度分别接种在12孔培养皿中,分别单用或联用X线(20 Gy)和苦参碱(0.3 mg/ml)处理。1、3和5天后收集培养液和细胞用于测定LDH和AST,分别用NobiFlow GOT-IFCC和NobiFlow LDH-L试剂盒测定,方法按说明书进行。
1.5 细胞凋亡检测HepG2 细胞以0.1×106个/孔的密度培养于6孔板中,并分别用0.1、0.3、0.5 mg/ml的苦参碱处理细胞。24 h后用细胞凋亡ELISA检测试剂盒进行检测,检测方法参照说明书。
1.6 实时荧光定量聚合酶链反应(real-time RT-PCR)用TRIzol提取细胞的RNA,并反转录成cDNA,采用SYBR Green染料法进行RT-qPCR反应,在96孔PCR反应板中按说明书依次加入各试剂,制成10 μl的PCR反应体系,反应条件参考试剂说明。每次检测设立3个复孔,至少重复3次。运用2-△△Ct方法确定目的基因表达的相对水平。引物由上海生工设计合成。
1.7 Western blot试验细胞经PBS清洗两次后,加入0.5 ml pH值7.5的缓冲液。经液氮和37℃温水反复冻融三次后在4°C下以750 g速度离心5 min。上清液在4°C下以10 000 g的速度离心15 min,所得沉积物为线粒体蛋白;所得上清液在4°C下以100 000 g的速度离心1 h,所得上清液为胞质蛋白。考马斯亮蓝测定法测定各组蛋白浓度。取等量蛋白行SDS-PAGE电泳,以电转印法将蛋白转印到硝酸纤维膜上,加鼠单抗细胞色素C抗体,兔多克隆抗caspase-9、pro-caspase-9抗体结合,使用电化学发光法显色,实验重复3次。以β-actin为内参照,Multigauge V3.2软件计算灰度值比值,作为其蛋白相对表达量。
1.8 统计学方法应用SPSS 12.0统计软件分析,数据以均数±标准差表示,两组间连续变量的比较采用独立样本t检验,P≤0.05为差异有统计学意义。
2 结果 2.1 苦参碱和X线联合治疗显著抑制HepG2细胞的活力并诱导其凋亡用0.3 mg/ml的苦参碱预处理HepG2细胞12 h后行X线(3 Gy)照射,分别于第1、2、3和4天用MTT法检测细胞活力,结果显示联合应用苦参碱和X线能显著抑制HepG2细胞生长,见图 1。为进一步明确联合治疗组抑制HepG2细胞生长的机制,用ELISA法检测对照组、苦参碱单药、X线及苦参碱联合X线作用24 h后HepG2细胞的凋亡情况。显示联合治疗组HepG2细胞的凋亡率明显升高 (P<0.05),见图 2。

|
| 图 1 苦参碱和X线联合治疗对HepG2细胞活力的影响 Figure 1 The effect of matrine combined with X-ray on viability of HepG2 cells |

|
| *: compared with Matrine+X-ray group 图 2 苦参碱和X线联合治疗24h时对HepG2细胞凋亡的影响 Figure 2 The effect of matrine combined with X-ray on apoptosis of HepG2 cells |
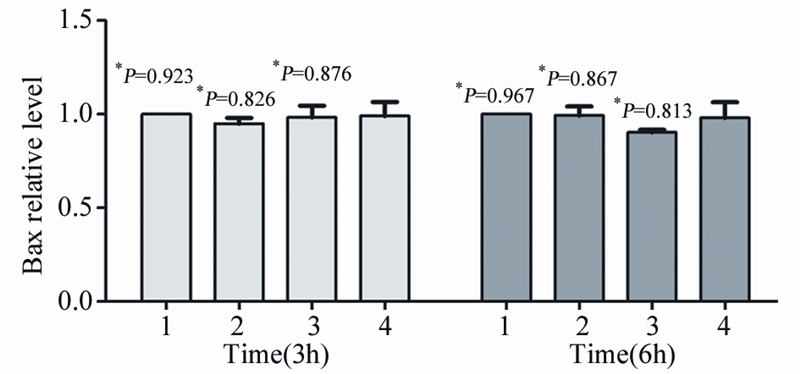
苦参碱和X线联合治疗3、6 h后,用real-time RT-PCR反应检测HepG2细胞中Bcl-2和Bax表达水平。结果显示联合治疗组的Bcl-2表达水平均显著低于对照组、苦参碱组及X线治疗组(P<0.05),见图 3,而Bax表达水平无明显差异(P>0.05),见图 4,提示联合应用苦参碱和X线能显著降低Bcl-2/Bax比例。

|
| 1: Control; 2: Matrine; 3: X-ray; 4: Matrine+X-ray; *: compared with Matrine+X-ray group 图 3 苦参碱和X线联合治疗3,6h后Bcl-2表达的变化 Figure 3 The change of Bcl-2 expression after combination treatment of matrine and X-ray for 3,6h |
|
| 1: Control; 2: Matrine; 3: X-ray; 4: Matrine+X-ray; *: compared with Matrine+X-ray group 图 4 苦参碱和X线联合治疗3,6h后Bax表达的变化 Figure 4 The change of Bax expression after combination treatment of matrine combined with X-ray for 3,6h |
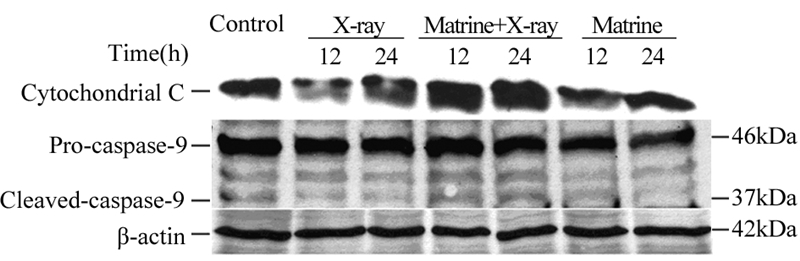
为了进一步探讨苦参碱和X线诱导细胞凋亡的机制,利用Western blot检测了胞质内caspase-9和pro-caspase-9以及细胞色素C表达变化。苦参碱和X线联合治疗组胞质内的细胞色素C及caspapase-9水平均明显升高,而各组间pro-caspase-9的表达无明显差异,见图 5。
|
| 图 5 苦参碱和X线对caspase-9、pro-caspase-9及细胞色素C表达的影响 Figure 5 Effect of matrine combined with X-ray on expression of caspase-9,pro-caspase-9 and cytochondrial- C |
为了验证苦参碱和离子辐射联合治疗原代培养的对人肝细胞的毒性作用,分别单用或联用X线(20 Gy)和苦参碱(0.3 mg/ml)处理人肝细胞,1、3和5天后分别检测LDH及AST水平。结果发现各组间LDH及AST的水平差异无统计学意义(P>0.05),见图 6、7,细胞形态也无明显差异,见图 8,提示联合治疗不会显著增加对人肝细胞的毒性。

|
| *: compared with Matrinet+x-ray group 图 6 苦参碱和X线联合治疗对LDH表达的影响 Figure 6 The effect of matrine combined with X-ray on LDH expression |

|
| *: compared with Matrinet+x-ray group 图 7 苦参碱和X线联合治疗对AST表达的影响 Figure 7 The effect of matrine combined with X-ray on AST expression |

|
| A: Control; B: X-ray; C: Matrine; D: Matrine+X-ray 图 8 苦参碱和X线联合治疗对人肝细胞形态的影响 Figure 8 The effect of matrine combined with X-ray on cell morphology of human hepatocytes |
本课题组前期研究发现苦参碱有抑制肝癌细胞生长的作用,并能增加肝癌细胞对化疗药物的敏感度[2],本实验进一步研究了苦参碱在增加人肝癌细胞HepG2对X线敏感度中的作用,结果显示苦参碱和X线联合治疗能显著抑制HepG2细胞生长并诱导细胞凋亡,提示苦参碱和X线联合应用时存在 “加速抑制作用”,即苦参碱有类催化剂样作用,增加了肝癌细胞对X线的敏感度。
Bcl-2等凋亡相关基因的异常表达是导致肿瘤放疗耐受性的重要原因之一[3]。体外实验已证实放疗可使Bcl-2获得性高表达[4]。研究表明放疗早期即可增加核转录因子NF-κB的表达,然后通过提高Bcl-2、Bcl-xL水平而抑制细胞凋亡,进而导致放疗的失败[5]。因此,如能有效抑制Bcl-2等凋亡相关基因的表达,必将能逆转肝癌细胞对放、化疗的抵抗。本课题组前期研究发现,苦参碱能呈剂量依赖性降低抗凋亡基因Bcl-2的表达水平,从而有效降低Bcl-2/Bax比率,促进细胞凋亡[2]。同时,caspase-9是内源性凋亡途径中的关键蛋白酶,当细胞接收到凋亡信号后,线粒体释放细胞色素C及凋亡活化因子,两者结合以后形成凋亡小体共同激活caspase-9,活化后的caspase-9 进一步激活下游的效应caspase级联反应从而参与调节细胞凋亡过程。前期研究发现,苦参碱能诱导细胞色素C从线粒体释放进入细胞质中,进而激活caspase-9,触发凋亡级联反应,最后导致HepG2细胞凋亡[6]。本实验结果提示苦参碱和X线联合治疗能明显抑制HepG2细胞中Bcl-2的表达水平,而Bax的表达无明显变化,从而显著降低Bcl-2/Bax比例。此外,联合治疗组细胞中的细胞色素C及caspase-9水平持续增加,进一步证明苦参碱能增加HepG2细胞对X线的敏感度。
X线导致的严重肝损伤也是制约放疗在肝癌中应用的重要原因之一。本实验用X线联合苦参碱处理人肝细胞1、3和5天后分别检测LDH及AST水平,结果发现各时间点、各组间的LDH及AST水平差异均无统计学意义,细胞形态也无明显差异,提示联合苦参碱治疗并不会加重X线对人肝细胞的损害。
综上所述,苦参碱能增加肝癌细胞HepG2对放疗的敏感度,而这种增敏作用可能是通过抑制Bcl-2的表达、降低Bcl-2/Bax比例、促进细胞色素C的释放以及诱导caspase-9的持续活化进而诱导细胞凋亡而最终实现的。提示联合应用苦参碱能从一定程度上也减少放疗的照射剂量,降低放疗的不良反应。同时,苦参碱治疗不会加重X线对人肝细胞的损害,所以作为一种肝癌放射治疗的增敏剂具有一定的前景,将进一步在动物实验中进行验证。
| [1] | Tanguturi SK, Wo JY, Zhu AX, et al. Radiation Therapy for Liver Tumors: Ready for Inclusion in Guidelines[J]. Oncologist, 2014, 19(8): 868-79. |
| [2] | Cheng XD, Du YA, Huang L, et al. The effect of matrine on GSH regulation and cytoxicity in human hepatoma Hep G2 cells [J]. China cance, 2008, 17(4): 311-3. [程向东, 杜义安, 黄灵, 等. 苦参碱对人肝癌HepG2细胞内GSH水平调节和细胞杀伤作用[J].中国肿瘤, 2008, 17(4): 311-3 .] |
| [3] | Sun Y, Wang Y, Yin Y, et al. GSTM3 reverses the resistance of hepatoma cells to radiation by regulating the expression of cell cycle/apoptosis-related molecules[J]. Oncol Lett, 2014, 8(4): 1435-40. |
| [4] | Plati J, Bucur O, Khosravi-Far R, et al. Apoptotic cell signaling in cancer progression and therapy[J]. Integr Biol (Camb), 2011, 3(4): 279-96. |
| [5] | Schattenberg JM, Schuchmann M, Galle PR, et al. Cell death and hepatocarcinogenesis: Dysregulation of apoptosis signaling pathways[J]. J Gastroenterol Hepatol, 2011, 26(Suppl 1): 213-9. |
| [6] | Cheng XD, Du YA, Huang L, et al. The role of matrine in regulating the expression of Bax and Bcl-w in Hep G2 cells which induce apoptosis[J]. Zhongguo Zhong Liu Lin Chuang, 2008, 35(12): 712-3. [程向东, 杜义安, 黄灵, 等. 苦参碱在调节Bax和Bcl-2蛋白表达诱导HepG2细胞凋亡中的作用[J]. 中国肿瘤临床, 2008, 35(12): 712-3.] |
 2015, Vol. 42
2015, Vol. 42


