文章信息
- 范旭龙,吴爱国,朱大江,焦庆丽,郑临海,邵国利,王梦川,纪术峰. 2015.
- FAN Xulong, WU Aiguo, ZHU Dajiang, JIAO Qingli, ZHENG Linhai, SHAO Guoli, WANG Mengchuan, JI Shufeng. 2015.
- Beclin 1蛋白增强三阴性乳腺癌细胞对5-Fu
- Beclin 1 Protein Enhances Sensitivity of Triple-negative Breast Cancer Cell Line BT-549 to 5-Fu by Promoting Cell Apoptosis
- 肿瘤防治研究, 2015, 42(05): 436-441
- Cancer Research on Prevention and Treatment, 2015, 42 (05): 436-441
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.05.003
-
文章历史
- 收稿日期:2014-07-19
- 修回日期:2014-10-27
2. 510280 广州,南方医科大学珠江医院普外科
2. Department of General Surgery, Zhujiang Hospital, Southern Medical University, Guangzhou 510280, China
乳腺癌是女性最常见的恶性肿瘤之一,近年来其发病率呈明显上升趋势,也已成为威胁妇女生命和健康的头号杀手[1]。三阴性乳腺癌(triple negative breast cancer,TNBC)是指不表达雌激素受体、孕激素受体和人表皮生长因子受体-2的特殊类型乳腺癌,占所有乳腺癌的9%~16%[2]。化疗作为TNBC唯一的全身治疗方案,是TNBC治疗的基石和首选[3, 4]。5-氟尿嘧啶(5-fluorouracil,5-Fu)是治疗乳腺癌、结肠癌、胃癌等肿瘤最常见的化疗药物之一,但多种原因导致其在肿瘤治疗过程中效果并不尽如人意[5]。因此,如何提高肿瘤的5-Fu化疗敏感度目前临床亟需解决的重要难题。
beclin 1基因作为第一个被发现哺乳动物自噬相关基因,是一种具有争议性的抑癌基因[6]。目前,国内外关于Beclin 1蛋白的研究主要集中在自噬调控等方面,而关于其和乳腺癌化疗敏感度关系的研究少见报道。本研究拟探究Beclin 1蛋白与TNBC对5-Fu敏感度之间的关系,并对相关机制进行初步探讨。
1 材料和方法 1.1 材料人TNBC细胞系BT-549购于中国科学院上海细胞库;pLenO-GTP-BECN1真核表达载体及pLenO-GTP空载体购于上海英为信公司;RPMI1640培养液及胎牛血清均购于美国HyClone公司;5-Fu、嘌呤霉素和MTT购于美国Sigma公司;TRIzol试剂和RT-PCR引物均购于上海Invitrogen公司;PrimeScript反转录试剂盒和real-time PCR试剂盒购于日本TaKaRa公司;Annexin V/7-AAD试剂盒购于美国eBioscience公司;Hoechst33342试剂盒购于南京凯基有限公司;兔抗人Beclin 1多克隆抗体、兔抗人Caspase-3抗体和兔抗人Caspase-8抗体购于美国CST公司;800 nm近红外抗兔荧光二抗购于美国LI-COR公司。
1.2 细胞培养和转染BT-549细胞用含10%胎牛血清的RPMI1640于37℃、5%CO2饱和湿度环境培养箱内传代培养,2~3天换液,4~5天传代。取对数生长期BT-549细胞,按1×104/孔接种于24孔板,每孔500 μl完全培养液,待细胞融合度达到60%~80%时根据慢病毒转染手册进行转染。转染细胞扩大培养后,1 μg/ml嘌呤霉素筛选。筛选完成后倒置荧光显微镜下观察绿色荧光蛋白(GFP)的表达以评估转染效率。根据是否转染及载体种类将BT-549细胞分为三组:pLenO-GTP-BECN1组、pLenO-GTP组和空白组。
1.3 Real-time PCR检测Beclin 1 mRNA表达收集各组细胞,TRIzol法提取总RNA;按照Prime Script反转录试剂盒说明将RNA反转录为cDNA;SYBR Green Ⅰ real-time PCR检测mRNA表达。Beclin 1引物:正向5’-ACCTCAGCCGAAGACTGAAG-3’,反向5’-AACAGCGTTTGTAGTTCTGACA-3’;内参β-actin引物:正向5’-CCATCGTCCACCGCAAAT-3’,反向5’-GCTGTCACCTTCACCGTTC-3’。 Real-time PCR条件如下: 95℃预变性30 s;95℃变性5 s,60℃退火34 s,循环反应40次;95℃ 15 s,60℃ 1 min分析熔解曲线。最后采用2-ΔΔCT法分析Beclin 1 mRNA相对表达量。
1.4 Western blot检测Beclin 1蛋白表达收集各组细胞,按凯基蛋白提取试剂盒说明提取总蛋白,BCA法测定蛋白浓度;按每孔30 μg蛋白量上样,10% SDS-PAGE凝胶电泳;湿法转至PVDF膜;室温下脱脂奶粉封闭1 h;4℃下Beclin 1(1:1 000)和β-actin(1:3 000)抗体分别孵育过夜,TBST洗涤3次,每次5 min;室温下荧光二抗(1:3000)避光孵育1 h,TBST洗3次,每次10 min;Odyssey近红外成像系统扫膜;Gel-Pro软件分析各条带灰度值;计算Beclin 1对β-actin的相对表达量。
1.5 MTT法检测Beclin 1蛋白对BT-549细胞5-Fu敏感度的影响取对数生长期细胞,按6×103个细胞每孔接种于96孔板,待细胞融合度达到70%~80%时后分别予浓度为0.09765625、0.78125、6.25、25、50、100、200、400 μg/ml的5-Fu处理细胞,同时设不加药孔和完全空白孔。作用48 h,每孔加入20 μl MTT溶液(终浓度0.5 mg/ml),37℃避光孵育4 h,彻底吸去上清液,加入150 μl DMSO,避光振荡10 min,于MD5多功能酶标仪检测各孔490 nm波长处吸光度(OD值)。每组设6个复孔,实验重复3次。计算5-Fu对各组细胞增殖抑制率。利用SPSS13.0软件计算各组细胞的IC50。抑制率=(1-实验组OD值∕未加药对照组OD值)×100%。
1.6 Annexin V/7-ADD法检测5-Fu处理前后BT-549细胞的凋亡率取对数生长期细胞,按2×106个细胞每孔接种于6孔板,待细胞融合度达到80%左右时,加入50 μg/ml的5-Fu作用48 h,收集全部细胞,冷PBS洗2遍,binding buffer重悬细胞。取100 μl细胞悬液,加入5 μl Annexin V-APC,室温下避光孵育15 min;再加入10 μl 7-AAD,冰上避光孵育10 min,200 μl binding buffer洗1遍,立即用流式细胞仪检测。实验重复3次。
1.7 Hoechst33342染色检测5-Fu处理前后BT-549细胞凋亡情况取对数生长期细胞,按1.0×104个细胞每孔接种到24孔板,待细胞融合度达到70%左右时,50 μg/ml 5-Fu作用48 h后进行Hoechst33342染色。每孔加入10 μl Hoechst 33342染液(终浓度5 μg/ml),37℃避光孵育10 min,PBS洗2遍,荧光显微镜观察细胞核改变情况。实验重复3次。
1.8 Western blot 法检测凋亡相关蛋白的表达Western blot检测50 μg/ml的5-Fu作用48 h后各组细胞凋亡相关蛋白Caspase-3和Caspase-8的表达情况(方法见1.4)。其中Caspase-3抗体稀释度为1:500;Caspase-8抗体稀释度为1:1 000。
1.9 统计学方法所有数据结果应用SPSS13.0统计软件处理。实验结果以(x±s)表示。各组间one-way ANOVA进行显著性检验;方差齐性检验采用Levene检验:满足方差齐性时两两比较采用LSD检验,方差不齐时两两比较采用Dunnett’s T3检验;P<0.05为差异有统计学意义。
2 结果 2.1 成功构建稳定表达Beclin 1蛋白的BT-549细胞株慢病毒转染及筛选后,pLenO-GTP-BECN1组和pLenO-GTP组BT-549细胞均可见较强绿色荧光,两组荧光表达率均大于90%,空白组无荧光出现,见图 1A。Real-time PCR结果显示,pLenO-GTP-BECN1组Beclin 1 mRNA相对β-actin的表达量为(28.13±0.96),显著高于pLenO-GTP组(1.17±0.07)和空白组(1.00±0.06)(F=2356.036,P < 0.00),见图 1B。Western blot结果显示,pLenO-GTP-BECN1组Beclin 1蛋白相对表达量为(2.29±0.0063),显著高于pLenO-GTP组(0.063±0.0012)和空白组(0.096±0.0016)(F=339231.3,P < 0.00);而pLenO-GTP-BECN1组Beclin 1蛋白较空白组升高了24.83倍(P < 0.00),pLenO-GTP组仅为0.90倍(P < 0.00),见图 1C。
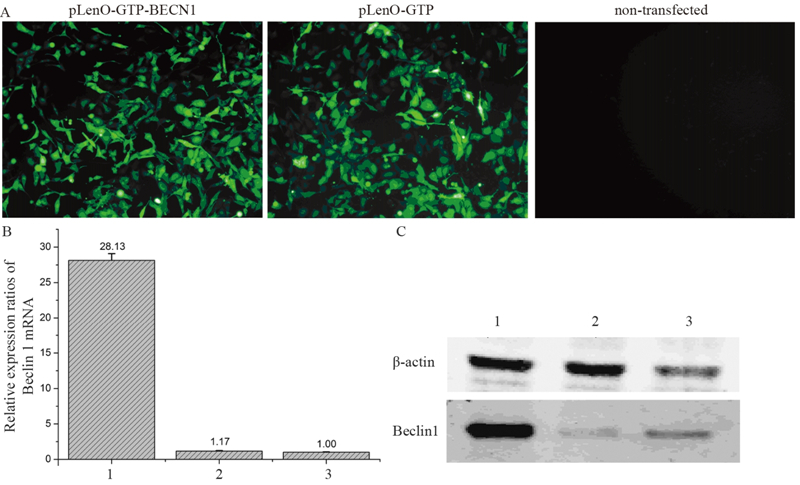
|
| 1: pLenO-GTP-BECN1; 2: pLenO-GTP; 3: non-transfected; A: the fluorescence expression of GFP in BT-549 cells (×100); B: the relative expression of Beclin 1 mRNA in BT-549 cells; C: the expression of Beclin 1 protein in BT-549 cells 图 1 慢病毒载体介导Beclin 1在BT-549细胞中稳定表达的情况 Figure 1 Stable expression of Beclin 1 in BT-549 cells via lentiviral vector |
MTT法检测各组细胞对5-Fu的敏感度。不同浓度5-Fu作用于BT-549细胞时,细胞增殖抑制率与5-Fu浓度之间存在剂量依赖性和时间依赖性;同pLenO-GTP组和空白组细胞相比,pLenO-GTP-BECN1组细胞增殖抑制率升高更为明显。5-Fu作用48 h时,pLenO-GTP-BECN1组BT-549的IC50为(3.54±0.20)μg/ml,显著低于pLenO-GTP组的 (14.45±1.81)μg/ml和空白组的(79.40±8.34)μg/ml(F=207.902;P < 0.00),见图 2。
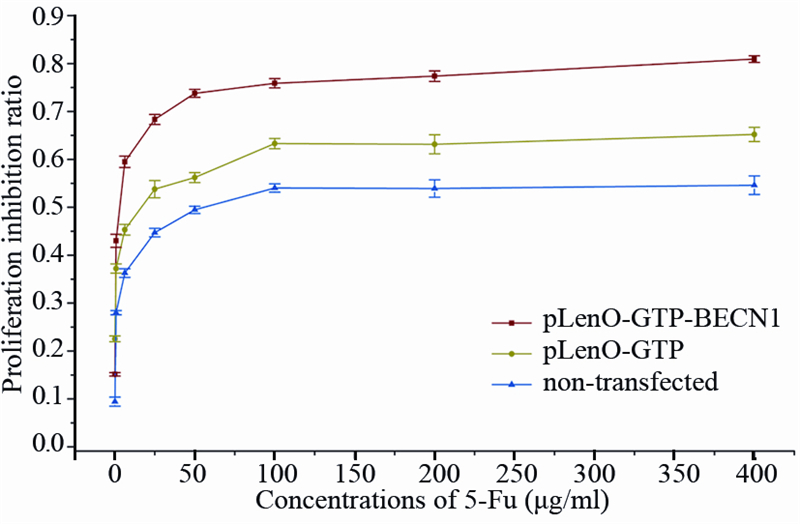
|
| 图 2 5-Fu对BT-549细胞增殖的影响 Figure 2 Effect of 5-Fu on proliferation of BT-549 cells |
为了明确Beclin 1增强BT-549细胞对5-Fu的敏感度是否同凋亡相关,对5-Fu作用前后细胞凋亡情况进行检测。5-Fu作用前,pLenO-GTP-BECN1组凋亡率为(12.14±0.76)%,同pLenO-GTP组(13.57±1.04)%和空白组(13.75±1.29)%(F=2.096;P=0.204)之间差异并无统计学意义;5-Fu作用后,pLenO-GTP-BECN1组凋亡率为(51.01±3.26)%,显著高于pLenO-GTP组(42.17±4.6)%和空白组(38.42±2.93)%(F=9.32;P < 0.01),见图 3。Hoechst33342染色结果显示,5-Fu作用后BT-549细胞变圆,数目减少,细胞核均呈现为不均一的亮蓝色荧光,串珠状或分叶状,出现核染色质固缩、核裂解等凋亡特征性形态改变,尤以pLenO-GTP-BECN1组最为明显,见图 4。
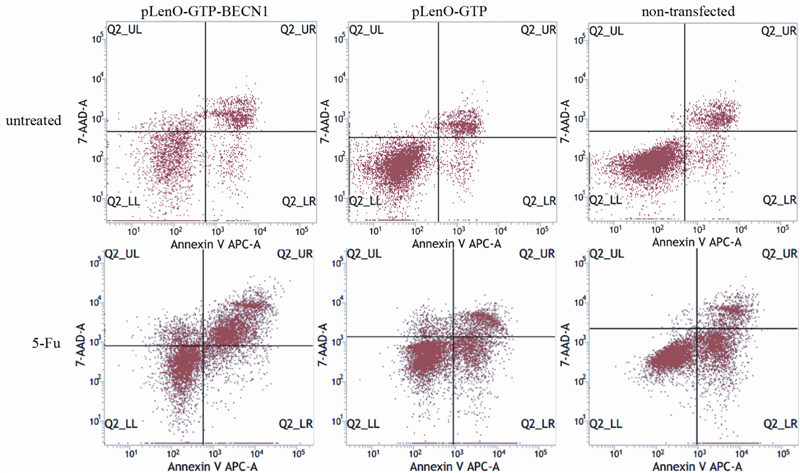
|
| 图 3 5-Fu对BT-549细胞凋亡的影响 Figure 3 Effect of 5-Fu on apoptosis of BT-549 cells |
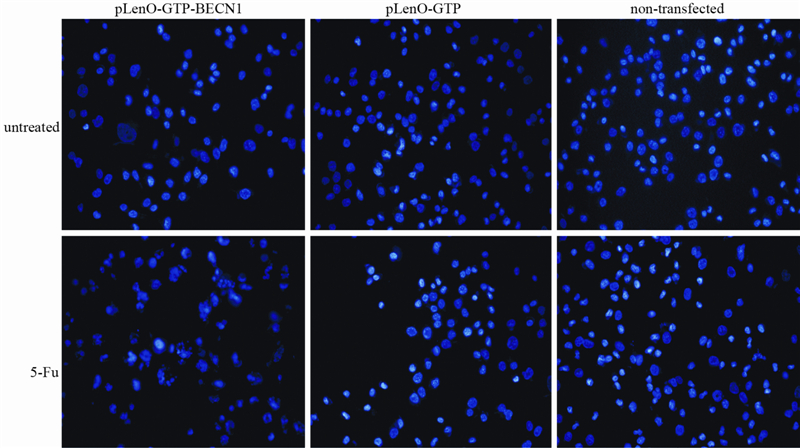
|
| 图 4 5-Fu对BT-549细胞核形态的影响 Figure 4 Effect of 5-Fu on nuclear morphology of BT-549 cells |
为了进一步研究5-Fu处理后凋亡发生情况,我们对凋亡相关蛋白Caspase-3和Caspase-8表达情况进行检测。5-Fu作用后,pLenO-GTP-BECN1组细胞Caspase-3相对表达量为(0.57±0.0028)显著高于pLenO-GTP组(0.42±0.010)和空白组(0.30±0.046)(F=46.134;P < 0.01); pLenO-GTP-BECN1组细胞Caspase-8相对表达量为(0.44±0.0038)显著高于pLenO-GTP组(0.18±0.0095)和空白组(0.27±0.00060)(F=1006.757;P < 0.00),见图 5。
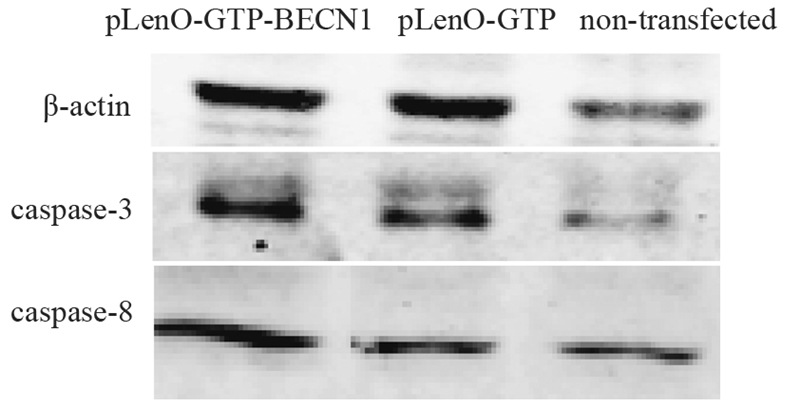
|
| 图 5 5-Fu对BT-549细胞凋亡相关蛋白表达的影响 Figure 5 Effect of 5-Fu on expression of apoptosis-related proteins in BT-549 cells |
乳腺癌是世界女性最常见的恶性肿瘤之一,严重威胁女性的身体健康。据《中国肿瘤登记年报》报道,我国女性乳腺癌患者为43/10万人,位居女性恶性肿瘤发病之首,其中死亡人数为10/10万人[7]。目前,TNBC的全身治疗方案主要是化疗,含有5-Fu的化疗方案如CMF[8]、FEC-DTX[9]等在TNBC化疗中仍在广泛应用。
5-Fu既可以影响DNA合成又可以伪代谢产物形式掺入RNA干扰蛋白质的合成而对各期细胞均有影响。但由于脂溶性和生物利用度较低,以及越来越多的患者对5-Fu产生耐药性,使得5-Fu治疗剂量与中毒剂量接近,临床应用时易引起严重的不良反应,导致其并不能满足临床需求[5]。因此,提高5-Fu化疗敏感度是对临床医生和科研人员来说是一个充满挑战性的课题。
目前,除了化疗药物联合、研制衍生物等传统的提高化疗敏感度的方法外,基因治疗正逐渐成为增强5-Fu化疗敏感度的新方法而走入人们的视线。Beclin 1蛋白除了在自噬中的作用,还可抑制细胞增殖、诱导肿瘤细胞凋亡、停滞细胞周期及炎症扩散和预防细胞基因组突变等[10]。本课题组前期研究发现,Beclin 1具有提高BT-549细胞自噬水平、抑制细胞增殖和阻滞细胞周期等作用[11]。而国内外对于Beclin 1和TNBC的化疗敏感度关系的研究目前仍甚少。
本研究发现,Beclin 1蛋白可通过促进凋亡发生显著增强细胞对5-Fu的敏感度,而Beclin 1又可显著提高BT-549细胞受5-Fu处理后凋亡相关蛋白Caspase-3和Caspase-8表达。Caspase-3是Caspase家族中的最重要的凋亡执行者之一,是细胞凋亡过程中的主要效应因子,其活化是凋亡进入不可逆阶段的标志;Caspase-8几乎能激活所有凋亡级联反应下游的Caspase而诱发凋亡[12]。Caspase-3和Caspase-8表达增加提示细胞凋亡过程发生显著增加。因此,Beclin 1可通过促进5-Fu诱导凋亡的发生而增强TNBC对5-Fu的敏感度。
乳腺癌的发生是细胞增殖和凋亡平衡失调的结果,细胞周期失控导致细胞过度增殖,但更重要的仍是细胞凋亡受阻[13]。凋亡异常是乳腺癌细胞脱离正常调控机制无限增殖和化疗耐受最常见的原因之一。本研究证实,Beclin 1通过提高5-Fu诱导凋亡发生的能力而增强TNBC对5-Fu的敏感度。该结论与以下多项研究一致:Beclin 1可增强线粒体凋亡途径提高肿瘤细胞对多种化疗药物诱导凋亡的敏感度,进而增强宫颈癌化疗敏感度[14];Beclin 1也可增强化疗药物诱导凋亡的作用而提高甲状腺癌和卵巢癌细胞对蛋白酶体抑制剂的敏感度[15, 16]。本研究前期实验也证实,Beclin l可通过促进凋亡的激活而增强TNBC对表柔比星的敏感度[17]。因此,Beclin 1单独存在仅能抑制TNBC细胞增殖和阻滞细胞周期,而Beclin 1与5-Fu联合却显著提高BT-549细胞凋亡激活,表明凋亡发生增加是Beclin 1提高TNBC对5-Fu敏感度的重要机制。
总之,本研究成功证实Beclin 1可通过促进5-Fu诱导凋亡的发生显著提高TNBC对5-Fu的敏感度。这为未来基于Beclin 1的基因治疗应用于TNBC治疗提供了一定的依据和支持,也为增强TNBC化疗敏感度提供了一个新的探索方向。但本研究仅选用了体外培养的细胞株进行观察,进一步的体内外药效及机制有待深入研究。
| [1] | Siegel R, Ma J, Zou Z, et al. Cancer statistics, 2014[J]. CA Cancer J Clin, 2014, 64(1): 9-29. |
| [2] | Montagna E, Maisonneuve P, Rotmensz N, et al. Heterogeneity of triple-negative breast cancer: histologic subtyping to inform the outcome[J]. Clin Breast Cancer, 2013, 13(1): 31-9. |
| [3] | Foulkes WD, Smith IE, Reis-Filho JS. Triple-negative breast cancer[J]. N Engl J Med, 2010, 363(20): 1938-48. |
| [4] | Tan L, Zhou X, Wang YZ, et al. Molecular classification of triple negative breast cancer and its applications[J]. Zhong Liu Fang Zhi Yan Jiu, 2015, 42(3): 300-4. [谭莉, 周茜, 王艺蓁, 等. 三阴性乳腺癌的分子分型及应用[J]. 肿瘤防治研究, 2015, 42(3): 300-4.] |
| [5] | Han Y. The mechanisms involved in 5-FU efficacy[J]. Zhongguo Zhong Liu Lin Chuang, 2010, 37(21): 1255-9. [韩勇. 影响5-Fu疗效的研究进展[J]. 中国肿瘤临床, 2010, 37(21): 1255-9.] |
| [6] | Boya P, Kroemer G. Beclin 1: a BH3-only protein that fails to induce apoptosis[J]. Oncogene, 2009, 28(21): 2125-7. |
| [7] | He J, Chen WQ. Chinese Cancer Registry Annual Report[M]. Beijing: Military Medical Science Press, 2012. [赫捷, 陈万青. 中国肿瘤登记年报[M]. 北京: 军事医学科学出版社, 2012.] |
| [8] | Wang S, Shi Y, Yuan Z, et al. Classical CMF regimen as adjuvant chemotherapy for triple-negative breast cancer may be more effective compared with anthracycline or taxane-based regimens[J]. Med Oncol, 2012, 29(2): 547-53. |
| [9] | Yagata H, Kajiura Y, Yamauchi H. Current strategy for triple-negative breast cancer: appropriate combination of surgery, radiation, and chemotherapy[J]. Breast Cancer, 2011, 18(3): 165-73. |
| [10] | Liang XH, Jackson S, Seaman M, et al. Induction of autophagy and inhibition of tumorigenesis by beclin 1[J]. Nature, 1999, 402(6762): 672-6. |
| [11] | Wang MC, Wu AG, Wang RW, et al. Influence on cell survival by transfecting beclin 1 to induce autophagy in triple-negative breast cancer BT-549 cells[J]. Zhonghua Ru Xian Bing Za Zhi(Dian Zi Ban), 2013, 7(1): 12-7. [王梦川, 吴爱国, 王日玮, 等. 转染beclin 1基因诱导自噬对三阴性乳腺癌BT-549细胞生长的影响[J]. 中华乳腺病杂志(电子版), 2013, 7(1): 12-7.] |
| [12] | Scatena R, Bottoni P, Botta G, et al. The role of mitochondria in pharmacotoxicology: a reevaluation of an old, newly emerging topic[J]. Am J Physiol Cell Physiol, 2007, 293(1): C12-21. |
| [13] | Jiang Z, Sun CG, Zhuang J, et al. Effect of PUMA gene transfection in breast cancer cells (MCF-7) on enhancing the sensitivity of epirubicin- induced apoptosis[J]. Zhongguo Zhong Liu Lin Chuang, 2013, 40(1):12-5. [姜真, 孙长岗, 庄静, 等. PUMA基因转染乳腺癌MCF-7细胞增强表柔比星致凋亡敏感性的研究[J]. 中国肿瘤临床, 2013, 40(1): 12-5.] |
| [14] | Sun Y, Liu JH, Jin L, et al. Beclin 1 influences cisplatin-induced apoptosis in cervical cancer CaSki cells by mitochondrial dependent pathway[J]. Int J Gynecol Cancer, 2012, 22(7): 1118-24. |
| [15] | Zhang HY, Du ZX, Meng X, et al. Beclin 1 enhances proteasome inhibition-mediated cytotoxicity of thyroid cancer cells in macroautophagy-independent manner[J]. J Clin Endocrinol Metab, 2013, 98(2): E217-26. |
| [16] | Liu C, Yan X, Wang HQ, et al. Autophagy-independent enhancing effects of Beclin 1 on cytotoxicity of ovarian cancer cells mediated by proteasome inhibitors[J]. BMC Cancer, 2012, 12: 622. |
| [17] | Wang RW, Wu AG, Wang MC, et al. Beclin 1 gene enhances TNBC BT-549 cells sensivity to Doxorubicin[J]. Shi Yong Yi Xue Za Zhi, 2013, 29(6): 870-3. [王日玮, 吴爱国, 王梦川, 等. Beclin1基因增强三阴性乳腺癌细胞BT-549对多柔比星的敏感性[J]. 实用医学杂志, 2013, 29(6): 870-3.] |
 2015, Vol. 42
2015, Vol. 42


