文章信息
- 丁莉,许娜,黄彬涛,高冠论,肖雅娟,周璇,卢绮思,李琳,李玉玲,黄继贤,刘晓力. 2015
- DING Li, XU Na, HUANG Bintao, GAO Guanlun, XIAO Yajuan, ZHOU Xuan, LU Qisi, LI Lin, LI Yuling, HUANG Jixian, LIU Xiaoli. 2015
- 干扰素治疗慢性骨髓增殖性肿瘤的临床意义
- Therapeutic Effect of Interferon on Chronic Myeloproliferative Neoplasm Patients
- 肿瘤防治研究, 2015, 42(04): 385-388
- Cancer Research on Prevention and Treatment, 2015, 42(04): 385-388
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.04.015
-
文章历史
- 收稿日期:2014-07-02
- 修回日期:2014-08-26
2. 512000 韶关,韶关市粤北人民医院血液科
2.Department of Hematology Medicine, Yuebei People’s Hospital,Shaoguan 512000, China
经典骨髓增殖性肿瘤(myelopr olif er ative neoplasm,MPN)患者依据疾病分类及危险分层,治疗上强调个性化。低危原发性血小板增多症(essential thrombocytosis,ET)及真性红细胞增多症(polycythemia vera,PV)患者常予小剂量阿司匹林等抗血小板凝集药物控制病情,必要时PV患者常联合静脉放血;进展期患者为减少血栓及出血事件,传统方案曾使用放射剂和烷化剂等骨髓抑制剂治疗,虽能一定程度上减轻患者症状,但难以阻止疾病进展,且可增加转化为急性白血病的风险。JAK2V617F突变存在于95%~98%的PV、50%~60%的ET及特发性骨髓纤维化(primary myeofibrosis,PMF)患者中,临床上该突变常与更高的血细胞负荷及血栓事件相关[1]。有研究表明[2]IFN-α可减少JAK2V617F等位基因负荷,使MPN患者获得较好的血液学反应甚至完全缓解。但目前尚未见有关IFN治疗对JAK2V617F突变阳性MPN患者有无特殊治疗意义的报道,故本研究旨在评价IFN治疗对特定JAK2V617F突变阳性MPN患者的临床疗效和不良反应。1 资料与方法 1.1 病例选择
临床随访2007年12月至2014年6月就诊于南方医科大学南方医院血液科并确诊为MPN的患者110例,年龄19~82岁,中位年龄54岁。ET患者按照JAK2V617F突变阳性和阴性分组,分别接受干扰素-α(IFN-α)和羟基脲(hydroxyurea,HU)治疗,对于PV患者因JAK2V617F阳性突变率超过90%,未将阴性突变组纳入实验研究,仅对比阳性突变组中IFN-α和HU疗效,见图 1。由于PMF患者临床特征、危险分层及治疗方案的特殊性,与ET及PV患者差异性大,故未纳入本次究。所有入组治疗患者,定期监测血常规、肝肾功能,评估病情进展情况。中位随访38(6~72)月。
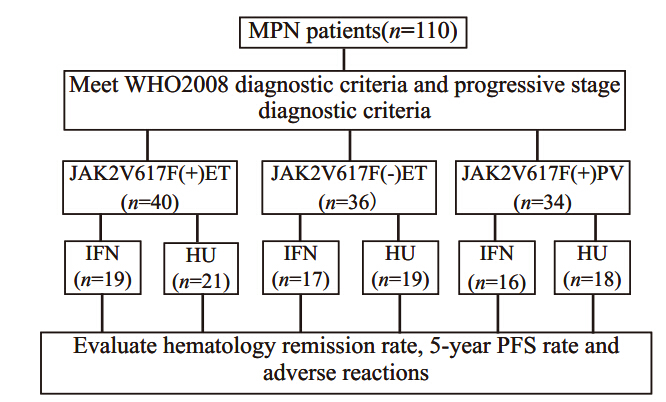 |
| MPN: myeloproliferative neoplasm; WHO: World Health Organization; JAK2V617F(+)ET: essential thrombocytosis patients with JAK2V617F mutations; JAK2V617F(-) ET: essential thrombocytosis patients without JAK2V617F mutations; JAK2V617F(+)PV: polycythemia vera patients with JAK2V617F mutations; IFN: interferon therapy group; HU: hydroxyurea therapy group; PFS: progression-free survival 图 1 实验设计与疗效评价 Figure 1 Experimental design and therapeutic evaluation |
(1)低危组:年龄<60岁,无血栓、栓塞病史;(2)低危伴异常血小板升高组:符合低危组标准且血小板计数>1000×109/L;(3)高危组:年龄≥60岁且(或)有血栓、栓塞病史。 1.3 纳入标准
(1)符合WHO2008诊断标准[4]的进展期[5](据危险分层,包括符合低危伴异常血小板升高组及高危组)MPN患者。(2)初治时肝肾功能未超过正常值上限1.5倍,无严重心功能不全并发症,无IFN及HU使用禁忌证。(3)按规定完成治疗疗程。(4)患者身体状况满足KPS评分60分以上。1.4 治疗方案
(1)羟基脲组:患者H U起始剂量为每天(15~20)mg/kg口服,根据治疗反应调整用药剂量,血象恢复正常后予小剂量HU(0.25~0.5)g/d维持治疗,同时加用阿斯匹林100 mg/d辅助治疗。(2)干扰素组:患者接受IFN-α 1b治疗,ET及PV患者起始剂量均为(30~50)μg/d 或1次/隔日皮下注射,缓解后1次/隔日,逐步减量至l~2次/周维持,总疗程2年以上。并予阿斯匹林100 mg/d辅助治疗。PV患者(红细胞压积>50%)在接受IFN或HU治疗的同时联合静脉放血以降低血液黏滞度,减小血栓事件风险。1.5 疗效及不良反应评价
疗效评价:缓解标准参照参考文献[5]。无疾病进展生存期:从入组之日起,至第一次发生疾病进展(新发血栓、出血事件,脾脏进行性肿大,转变为骨髓增生异常综合征MDS,ET或PV进展为骨髓纤维化MF或原有骨髓纤维化网染程度加重或伴外周血细胞减少,进展为急性髓性白血病AML[6])或任何原因死亡的时间。不良反应评价按美国国立癌症研究所3.0标准。 1.6 统计学方法
应用SPSS 17.0统计学软件进行统计分析。t检验用于两样本均数比较,数据以中位数和范围表示。率的比较采用χ2检验或Fisher精确检验。P<0.05为差异有统计学意义。2 结果2.1 MPN患者的临床特征
ET及PV患者,接受IFN和HU治疗组之间在中位年龄、性别、初诊血象及危险分层无明显差异,处于良好平衡状态(P>0.05),见表 1。
对于JAK2V617F(+)的ET患者,IFN治疗组及HU治疗组间患者总缓解率间差异无统计学意义(P=0.720),但IFN治疗组5年无疾病进展生存率为84.2%,显著高于HU治疗组(52.4%,P=0.032)。JAK2V617F(-)的ET患者,IFN和HU治疗组间患者总缓解率及5年无疾病进展生存率间差异均无统计学意义(P>0.05)。JAK2V617F(+)的PV患者,IFN治疗组及HU治疗组间患者总的缓解率间差异无统计学意义(P=0.732),但IFN治疗组5年无疾病进展生存率为87.5%,显著高于羟基脲组(50.0%,P=0.020),见表 2。
在疾病进展的病例中,IFN治疗组共有1 2例(23.1 %)患者发生疾病进展,HU治疗组27例(46.6 %),两组比较差异有统计学意义(P=0.010)。在血栓事件、脾肿大、骨髓纤维化等发生方面,IFN治疗组均较HU治疗组低,差异有统计学意义(P<0.05)。HU治疗组中,有6例患者脾脏进行性肿大伴骨髓活检网染程度加深,1例转化为MDS伴骨髓纤维化。血栓事件以脑梗死发生为主,其次为冠心病心绞痛或心肌梗死,1例HU治疗组的PV患者同时发生颅内静脉窦血栓及脑梗死。共观察到3例出血事件,均发生在ET患者,IFN及HU治疗组中各有1例消化道出血,1例经IFN治疗的患者病程中发生自发性硬膜下血肿。两组治疗患者中,均未观察到向AML转化事件。2.3 经治疗后PV患者的放血比率
PV患者经治疗6月后,IFN及HU组分别有12例患者获得血液学反应,但IFN组有1例患者红细胞压积反复>50%需继续静脉放血,明显低于HU组。未获得血液学反应的患者治疗组间继续放血率差异无统计学意义,见表 3。
IFN治疗组血液学不良反应轻微(1~2级),未发现严重血液学不良事件(3~4级),仅观察到6例患者血红蛋白减少;非血液学不良反应主要以发热、头痛、肌肉痛、关节痛等流感样症状(69.2%,1~2级)多见,常在治疗初期出现,未发现3~4级非血液学严重不良事件;由于随访时间不足,长期干扰素治疗影响患者生活质量方面的不良反应(如消瘦、抑郁)未得到系统评估。HU治疗组血液学不良反应(27.6%)较IFN组(11.5%)多见(P=0.036,1~2级),主要表现为白细胞和血小板减少,缓慢减量及停药后可恢复正常。HU治疗组发现3例血液学严重不良反应,粒细胞缺乏1例,血小板<25×109/L,2例。HU非血液学不良反应主要为消化道症状(10.3%,1~2级),较干扰素治疗组(0)多见,未观察到非血液学严重不良事件(3~4级),见表 4。
 |
干扰素(IFN)是细胞因子家族成员之一,临床用于淋巴瘤、白血病、病毒性肝炎和类风湿性关节炎等多种肿瘤性、感染性和风湿相关疾病的治疗[7]。JAK2V617F突变的发现赋予MPN新的诊断标准及治疗前景,JAK2V617F突变体对MPN患者临床表型的影响及IFN对其有效性已被多个研究证实。Tefferi等[8, 9]研究表明:MPN患者JAK2V617F突变基因负荷量常与疾病严重程度及持续时间关系密切。Hasan等[10]在小鼠体内的研究发现:IFN-α通过特异性阻断JAK2V617F突变体造血干细胞的增殖优势,从而阻止MPN发展甚至根除;有文献[11, 12]报道经IFN治疗的部分MPN患者可获完全血液学及分子生物学缓解。然而,目前临床并未见IFN对JAK2V617F突变阳性与阴性患者临床疗效间差异性相关研究,是否JAK2V617F突变阳性的MPN患者更适用IFN治疗尚不明确。
本研究通过评价ET及PV患者经IFN或HU治疗后的临床疗效及不良反应发现,尽管IFN对比HU治疗对JAK2V617F突变阳性ET患者在总的缓解率间无明显差异,但IFN治疗组远期持续无进展生存明显优于HU治疗组。接受IFN治疗的JAK2V617F突变阳性ET患者,其远期持续无进展生存较IFN治疗的JAK2V617F突变阴性ET患者明显受益。同样对于PV患者,IFN对比HU治疗对JAK2V617F突变阳性PV患者在总的缓解率间无明显差异,但IFN治疗组持续无进展生存明显优于HU治疗组。接受干扰素治疗的患者在治疗过程中血栓事件、脾肿大、骨髓纤维化的发生率均较羟基脲治疗组低。干扰素治疗不良反应以“流感样”症状为主,停药或辅以对症治疗后可缓解,多数患者能耐受。对于PV患者,干扰素治疗亦可减少患者的放血需求。
JAK2V617F突变阴性的ET患者,IFN在总缓解率和远期生存上,未占有治疗优势。这可能与JAK2V617F突变阴性的ET患者存在与疾病相关的其他基因突变如钙网蛋白基因(CALR)突变相关,该突变被证实在JAK2V617F突变阴性的MPN患者中检出率较高[13, 14],其促使MPN发病的具体分子机制尚未清楚,这为研究MPN的发病机制提供了新的视角,也将为MPN患者依据特定分子生物学特征来设计个体化治疗方案提供新的思路。
干扰素治疗在降低M P N患者血细胞,缓解瘙痒、乏力、脾脏肿大等临床症状体征上疗效确切[2]。通过本次临床随访研究分析得出:JAK2V617F突变阳性的ET和PV患者使用干扰素治疗可获得较好的血液学无进展生存,特别是对于JAK2V617F阳性PV患者,持续干扰素治疗有助于减低患者对放血治疗的依赖。但此类疾病在血液系统疾病中发病率低,发展相对滞后,目前国内外与治疗相关的大样本及长期随访研究少见。我们的研究在样本量及随访时间上亦不足,研究结果仍需临床进一步完善求证。
| [1] | Gotlib J. JAK inhibition in the myeloproliferative neoplasms: lessons learned from the bench and bedside[J]. Hematology Am Soc Hematol Educ Program, 2013, 2013: 529-37. |
| [2] | Sliver RT, Kiladjian JJ, Hasselbalch HC. Interferon and the treatment of polycythemia vera, essential thrombocythemia and myelofibrosis[J]. Expert Rev Hematol, 2013, 6(1): 49-58. |
| [3] | Tefferi A. Annual clinical updates in hematological malignancies: a continuing medical education series: polycythemia vera and essential thrombocythemia:2011 update on diagnosis, riskstratification, and management[J]. Am J Hematol, 2011, 86(3): 292-301. |
| [4] | Thiele J, Kvasnicka HM. The 2008 WHO diagnostic criteria for polycythemia vera, essential thrombocythemia, and primary myelofibrosis[J]. Curr Hematol Malig Rep, 2009, 4(1): 33-40. |
| [5] | Quintás-Cardama A, Kantarjian H, Manshouri T, et al. Pegylated interferon alfa-2a yields high rates of hematologic and molecular response in patients with advanced essential thrombocythemia and polycythemia vera[J]. J Clin Oncol, 2009, 27(32): 5418-24. |
| [6] | Spanoudakis E, Bazdiara I, Pantelidou D, et al. Dynamics of telomere’s length and telomerase activity in Philadelphia chromosome negative myeloproliferative neoplasms[J]. Leuk Res, 2011, 35(4): 459-64. |
| [7] | Zhu YF, He YK. Mechanisms of the actions of interferons[J].Zhonghua Gan Zang Bing Za Zhi, 2007, 15(11): 845-6. [朱幼芙, 贺玉凯.干扰素的作用机制[J]. 中华肝脏病杂志, 2007, 15(11): 845-6.] |
| [8] | Tefferi A. Mutational analysis in BCR-ABL-negative classic myeloproliferative neoplasms: impact on prognosis and therapeutic choices[J]. Leuk Lymphoma, 2010, 51(4): 576-82. |
| [9] | Silver RT, Vandris K,Wang YL, et al. JAK2(V617F) allele burden in polycythemia vera correlates with grade of myelofibrosis, but is not substantially affected by therapy[J]. Leuk Res, 2011, 35(2): 177-82. |
| [10] | Hasan S, Lacout C, Marty C, et al. JAK2V617F expression in mice amplifies early hematopoietic cells and gives them a competitive advantage that is hampered by IFNα[J]. Blood, 2013, 122(8): 1464-77. |
| [11] | Kiladjian JJ, Cassinat B, Chevret S, et al. Pegylated interferonalfa-2a induces complete hematologic and molecular responses with low toxicity in polycythemia vera[J]. Blood, 2008, 112(8): 3065-72. |
| [12] | Larsen TS, M?ller MB, de Stricker K, et al. Minimal residual disease and normalization of the bone marrow after long-term treatment with alpha-interferon2b in polycythemia vera. A report on molecular response patterns in seven patients in sustained complete hematological remission[J]. Hematology, 2009, 14(6): 331-4. |
| [13] | Nangalia J, Massie CE, Baxter EJ, et al. Somatic CALR mutations in myeloproliferative neoplasms with nonmutated JAK2[J]. N Engl J Med, 2013, 369(25): 2391-405. |
| [14] | Klampfl T, Gisslinger H, Harutyunyan AS, et al. Somatic mutations of calreticulin in myeloproliferative neoplasms[J]. N Engl J Med, 2013, 369 (25): 2379-90. |
 2015, Vol. 42
2015, Vol. 42