文章信息
- 王子静,毕学汉,张梦婷,杨永秀. 2015
- WANG Zijing, BI Xuehan, ZHANG Mengting, YANG Yongxiu.2015
- 盆腔炎与卵巢肿瘤发生风险的Meta分析
- Pelvic Inflammatory Disease and Risk of Ovarian Tumor: A Meta-analysis
- 肿瘤防治研究, 2015, 42(04): 263-268
- Cancer Research on Prevention and Treatment, 2015, 42(04): 263-268
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.04.010
-
文章历史
- 收稿日期:2013-12-30
- 修回日期:2014-08-08
730000兰州,兰州大学第一医院妇产科
卵巢肿瘤是最常见的女性生殖系统肿瘤之一, 卵巢癌病死率居女性生殖系统恶性肿瘤首位,尤 其在中欧、东欧地区的发病率和死亡率最高[1]。近 年来,我国部分地区卵巢癌发病率呈上升趋势, 2009年72个地区共覆盖登记人口85470522人,卵 巢癌新发病例3360例,死亡病例1454例[2]。
除了未生产、不孕、初潮早、绝经延迟、卵 巢癌家族史等这些公认的危险因素,还发现使用 滑石粉、子宫内膜异位症、促排卵治疗等也是卵 巢恶性肿瘤的危险因素[3],这些因素都涉及到共同 的环节—盆腔局部炎性反应的发生,或加重了局 部炎性反应。1989年在上海的一项研究中首次报 道了盆腔炎(pelvicinflammatorydisease,PID) 与卵巢癌发生的风险关系,但无统计学意义[4]。之 后在Booth等[5]研究中发现PID可以增加卵巢癌的 发生风险,尤其在多次复发性PID和患病年龄较早 者中。但对两者的因果关系,学术界至今没有定 论,故有必要对现有的队列研究和病例-对照研究 结果进行Meta分析,从而为PID与卵巢肿瘤的发生 关系提供循证医学证据。 1 资料与方法 1.1 纳入标准 1.1.1 研究设计
队列研究或病例-对照研究。 1.1.2 研究对象
无语言限制。(1)队列研究: 曾经或目前正暴露于PID者,观察结局为卵巢肿 瘤;(2)病例-对照研究:经病理诊断证实的 卵巢肿瘤(包括侵袭性、交界性和良性卵巢肿 瘤),回顾性调查了PID史者。 1.1.3 研究指标
纳入文献的研究指标为优势比 (OR)、危险比(HR)或相对危险度(RR)或 提供的原始数据能够进行上述指标的计算。 1.2 排除标准
(1)功能性卵巢囊肿者;(2)来自同一研究重 复发表的文献取其中资料最详细者;(3)数据无法 提取者;(4)设计方法不准确,文献质量较差者。 1.3 检索策略
两位评价员按照共同制定的检索策略,独立 检索PubMed、EMbase、CochraneLibrary、中国生 物医学文献数据库、中国知网(含期刊、学位、 杂志、会议)和万方(含期刊、学位、会议)数 据库,检索时限均从建库至2013年10月。英文 检索词为:ovar*cancer,ovar*neoplasm,ovar* cancer,ovar*carcinoma,pelvicinflammatory, pelvisinfection,Oophoritis,Salpingitis,cohort, case—control等。英文检索式参照Collaborative ReviewGroupSearchStrategy标准。中文检索词 为:卵巢肿瘤、卵巢癌、盆腔炎、附件炎、卵巢 炎、输卵管炎、队列、病例-对照等。 1.4 文献筛选
两位评价员独立阅读所获文献文题和摘要,在 排除明显不符合纳入标准的研究后,对可能符合 纳入标准的研究阅读全文,以确定是否真正符合纳 入标准,并交叉核对纳入文献,对有分歧者通过讨 论达成共识,必要时听取第三位研究者的意见。 1.5 资料提取
两位评价员根据资料提取表独立地提取数据并 交叉核对,如有分歧者,听取第三位研究者的意见。 提取资料主要包括研究的基本情况、各组患者的基 线情况、研究设计、研究对象纳入及排除标准、随 访时间、结局测量指标和反映研究质量的指标等。 1.6 质量评价
两 位 评 价 员根 据 纽 卡 斯 尔 — 渥 太 华 量 表 (Newcastle—OttawaScale,NOS)独立评价纳入文 献质量,评价内容包括研究对象选择(se1ection)、 组间可比性(comparability)、暴露(exposure)评 价和结局(outcome)评价 [6] 。满分为9分,除了组间 可比性为2分外,其余项目下的每条标准均为1分。 1.7 统计学方法
采用RevMan5.2软件进行Meta分析。队列研 究均能获得原始的HR值及95%CI,通过RevMan 5.2的转化功能计算Log(OddsRatio)值及SE 值,病例-对照研究均能获得原始数据(即病例、 对照各组人数及PI D病史人数),同法计算Lo g (OddsRatio)值及SE值。由于卵巢癌发病率较低 (<20%),遂使用OR值代替RR值解释统计分析 结果。队列、病例-对照研究均用OR值及95%CI 来表示盆腔炎与卵巢肿瘤的发生关系。通过F检验 对纳入研究进行异质性检验,如检验结果无统计 学异质性(P≥0.10),采用固定效应模型进行分 析;如果存在异质性(P<0.10),采用随机效应 模型进行分析,并对可能导致异质性的因素行亚 组分析或敏感度分析。当纳入文献≥10篇时采用倒 漏斗图分析发表偏倚。 2 结果 2.1 文献检索结果
通过检索电子数据库、相关文献以及参考文献 共检出189篇文献,排除重复文献6篇,阅读文题及摘 要后排除不符合纳入标准文献共162篇,通过进一步 查阅全文复筛,排除11篇,最终纳入10篇文献(2个队 列,8个病例-对照),均为英文文献并获得全文。 2.2 纳入研究的一般情况 共纳入的2个队列研究[7,8]均为前瞻性研究。 Lin等[7]研究人群为台湾地区健康保健数据库2005 记录的人群,观察结局为卵巢癌的发生,随访1~3 年,Stewart等[8]研究人群为西澳大利亚地区不孕症 患者,观察结局是交界性肿瘤的发生,平均随访 16.9年,根据是否有PID病史分为暴露组和非暴露 组,其中暴露组共71821例,非暴露组共153626 例,以卵巢癌的发生、意外死亡或研究截止时间 等作为随访终止时间。
共纳入8个病例-对照研究[4,5,9,10,11,12,13,14],病例组共5 420例,对照组共8777例,卵巢肿瘤的诊断标准均 采用组织学诊断,盆腔炎的诊断标准均为研究人群 的自我报告。8个研究以健康人群或来自相同医院者 作为对照组。除了Parazzini等[11]研究未描述,其余 研究的病例组和对照组之间均进行了年龄匹配。8 个研究的病例组和对照组均通过采用相同的调查问 卷,回顾性调查获取研究数据,明确病例组和对照 组既往是否暴露于盆腔炎性疾病,见表 1。
根据纽卡斯尔-渥太华量表对每篇纳入文献进 行方法学质量评价。 2.3.1 队列研究
质量评价Stewart等[8]研究为5 分,Lin等[7]研究为8分。由于Stewart等对PID暴 露情况未进行详细描述致评分偏低,但组间可比 性、结局指标的评价做得较好均得分,随访时间 也足够长,失访情况未描述。Lin等在研究对象 选择方面做得较好,组间可比性中控制了年龄、 月收入、城市化程度、心血管疾病、糖尿病、慢 性肝病、风湿病、子宫内膜异位症等混杂因素, 但对于生殖、遗传等这些重要的混杂因素并未控 制,随访时间在1~3年,失访率小于20%。 2.3.2 病例-对照研究
8个研究[4,5,9,10,11,12,13,14]在病例的确 定、病例的代表性、组间可比性以及采用相同方法 确定病例和对照组暴露因素方面均得分;在暴露因 素确定方面均未得分;除了Parazzini [11]和Booth等[5] 的研究,其余研究在对照的选择方面均得分;在无 应答率方面只有Parazzini等[11]得分。6个研究[9,10,11,12,13,14]均 获得7分的评分,而Booth等[5]为5分,Shu等[4]为6分。 2.4 Meta分析结果 2.4.1 PID暴露于卵巢肿瘤的发生风险
(1)队 列研究的Meta分析:共纳入2个队列研究[7,8],异 质性检验结果提示研究间同质性尚可(I2 =45%, P=0.18),故采用固定效应模型进行合并分析。 Meta分析结果显示,PID暴露者患卵巢癌的风险是 未暴露者的1.07倍(OR=0.1.72,95%CI:1.17~2.52, P=0.0006),且差异有统计学意义,见图 1。(2) 病例-对照研究的Meta分析:共计纳入8个病例-对照研究[4,5,9,10,11,12,13,14],异质性检验结果提示各研究间差 异有统计学意义(I2 =48%,P=0.06),采用随机 效应模型的Meta分析结果示(OR=0.1.07,95%CI: 0.86~1.33,P=0.55),见图 2。分析8个病例对照 研究的临床异质性进行亚组分析。

|
| A: transfected with blank plasmid; B: transfected with IL-1RAP 图 1 PID与卵巢肿瘤发生关系的队列研究的Meta分析 Figure 1 Meta-analysis of cohort studies on association between PID and ovarian tumor |

|
| A: transfected with blank plasmid; B: transfected with IL-1RAP 图 2 盆腔炎与卵巢肿瘤发生关系的病例-对照研究的Meta分析 Figure 2 Meta-analysis of case-control studies on association between PID and ovarian tumor |
以卵巢肿瘤的组织学类型进行亚组分析: 只有3个研究[5,12,14]给出了各组织学类型的人群数 量,故仅按(1)上皮性卵巢肿瘤(侵袭性和交界 性)(2)上皮、非上皮卵巢癌(3)上皮性良性 卵巢肿瘤、皮样囊肿进行亚组分析。其中上皮性 卵巢肿瘤(侵袭性和交界性)共纳入6个研究, 异质性检验结果提示各研究间差异有统计学意义 (I2 =49%,P=0.08),采用随机效应模型进行合 并分析提示PID暴露者患卵巢癌的风险是未暴露 者的1.05倍,但差异无统计学意义(OR=0.1.05, 95%CI:0.85~1.30,P=0.66)。当病例组为上皮、 非上皮卵巢癌者或上皮性良性卵巢肿瘤、皮样囊 肿者时,各纳入1个研究,且样本量较小,容易受 抽样误差的影响,无明确意义。
以对照组与病例组来自同一人群的研究进行 亚组分析:共纳入6个研究[4,9,10,12,13,14],异质性检验 结果提示各研究间差异无统计学意义(I2 =38%, P=0.15),遂采用固定效应模型进行合并分析。 Me ta分析结果显示,PI D暴露者患卵巢癌的风 险是未暴露者的1.11倍,但差异无统计学意义 (OR=0.1.11,95%CI:0.97~1.27,P=0.14),见图 3。

|
| A: transfected with blank plasmid; B: transfected with IL-1RAP 图 3 PID与卵巢肿瘤发生关系的病例-对照研究的Meta分析(对照组与病例组来自同一人群) Figure 3 Meta-analysis of case-control studies on the association between PID and ovarian tumor(case group and control group from the same population) |
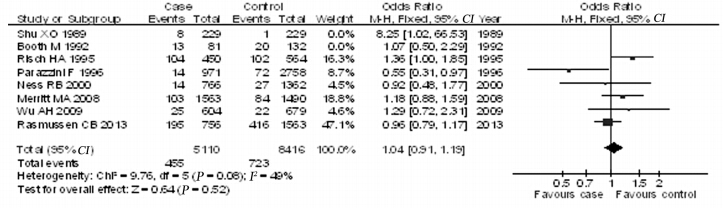
对高质量研究(评分≥7分)进行亚组分析: 根据纽卡斯尔-渥太华量病例-对照研究质量评价 后,共纳入6个病例-对照研究[4,9,10,12,13,14]。异质性检 验示I2 =49%,P=0.08,使用固定效应模型,合并 分析结果显示PID暴露者患卵巢癌的风险是未暴 露者的1.04倍,但差异无统计学意义(OR=0.1.04, 95%CI:0.91~1.19,P=0.41),见图 4。
|
| A: transfected with blank plasmid; B: transfected with IL-1RAP 图 4 PID与卵巢肿瘤发生关系的病例-对照研究的Meta分析(文献质量评分≥7分) Figure 4 Meta-analysis of case-control studies on the association between PID and ovarian tumor (literature quality score ≥ 7) |
只 有Risch等[10](病例对照)和Lin等[7](队列)研究 了暴露次数与卵巢肿瘤发生的关系。Risch等研究 提示在调整了年龄、分娩次数、哺乳时间、使用 口服避孕药的时间、输卵管结扎史、子宫切除史 及家族性卵巢癌/乳腺癌病史等混杂因素后,PID 暴露≥2次者患卵巢癌风险是无PID病史者的1.88 倍,且差异有统计学意义(OR=0.1.88,95%CI: 1.13~3.12,P=0.0065)。而当只有1次PID病史者与 无PID史者相比,患卵巢癌风险差异则无统计学意 义(OR=0.1.36,95%CI:0.91~2.02,P=0.0065)。 Lin等研究也提示随着PID暴露次数增多患卵巢癌 的风险也随之上升,该研究在调整了混杂因素,当 PID暴露次数超过5次时,患卵巢癌的风险增加2.46 倍(OR=0.2.46,95%CI:1.48~4.09)。 2.4.3 发表偏倚
采用RevMan5.2的漏斗图分析 纳入研究有无发表偏倚。结果显示漏斗图基本对 称,本Meta分析受发表偏倚影响较小,见图 5。

|
| A: transfected with blank plasmid; B: transfected with IL-1RAP 图 5 PID与卵巢肿瘤发病风险的漏斗图分析 Figure 5 Funnel plot analysis of association between PID and ovarian tumor |
多项研究发现肿瘤环境中伴随着大量并广泛的 的促炎因子和趋化因子,而炎性反应产生的生物活 性物质如细胞因子、生长因子、前列腺素等促进肿 瘤的发生、进展 [3,15,16]。根据二元论模型理论和卵巢 癌外起源学说,认为高级别卵巢浆液性癌主要起源 于输卵管伞端,输卵管浆液癌细胞脱落种植到卵巢 上;而低级别卵巢浆液性癌主要起源于卵巢皮质内 的包涵体[17]。不论是起源于输卵管、卵巢还是其他 盆腔组织,它们均容易暴露于各种促炎介质中。炎 性反应可产生有毒的氧化剂破坏DNA起到直接的 致癌作用,同时慢性炎性反应伴随的细胞分裂增多 可增加DNA修复错误的可能性[3]。根据排卵假说排 卵过程本身就伴随着炎性反应和突变的潜在特性, 流行病学研究也证实初潮早、绝经晚、未生育等与 排卵次数相关的因素是卵巢癌发生的危险因素[4,18]。 卵巢癌患者手术切除的输卵管通常存在慢性炎性反 应,在Seidman等的研究中,从卵巢恶性肿瘤患者切 除的输卵管中,有50%的输卵管存在炎性反应,而 在非肿瘤患者切除的输卵管中只有27%的患者存在 炎性反应[19]。根据经血逆流假说,经血逆流可使输 卵管纤毛暴露于红细胞融解产生的活性氧的基因毒 性效应和铁的催化作用的炎性反应环境中[16]。
根据幽门螺杆菌、乙肝病毒慢性感染相关的胃 癌、肝癌,可以推测微生物参与的致癌机制可能是 通过由慢性感染引起的持续性炎性反应。机体免 疫系统在清除病原体过程中产生的炎性反应、吞 噬细胞释放的氧化剂,在努力清除病原体的同时, 可能也会导致机体细胞和基因的损伤[20]。流行病学 研究发现可直接诱导盆腔炎症的因素如子宫内膜 异位症、石棉、滑石粉的接触均可增加患卵巢癌的 风险,而作为卵巢癌保护因素的子宫切除术或双 侧输卵管结扎术可阻断感染炎性反应或污染物如 滑石粉蔓延到上生殖道及盆腔[3,15]。此外高危因素 中的不孕不育又是PID的常见并发症。故有学者推 测PID尤其是慢性或多次复发性PID可能增加患卵 巢癌的风险。
本研究中2个队列研究的Meta分析结果也支持 这一推测。虽然病例-对照研究的Meta分析结果与 队列研究结论相矛盾,但唯一一个涉及PID暴露次 数的病例-对照研究[10]却发现复发性PID者患卵巢 肿瘤风险是明显增加的,与队列研究Lin等[7]的结 论相一致。Kelly等[21]研究发现性生活活跃的曾有 过PID病史的青少年女性,有47%的人会复发PID。 Lin等[8]也证实了对于性活跃、PID复发率较高的人 群(年龄≤35岁)发生卵巢癌的风险高于年龄>35 岁者。卵巢癌的危险因素大都涉及到炎性反应,非 甾体抗炎药亦能降低患卵巢癌的风险以及目前的生 物学研究均表明慢性炎症参与了卵巢肿瘤的发生、 发展。研究应更倾向于复发性或慢性PID与卵巢肿 瘤的发生关系。 3.2 本文纳入研究的质量情况 3.2.1 队列研究
(1)纳入的2个队列研究均为前 瞻性大样本研究。(2)Stewart等[8]只关注了交界 性卵巢肿瘤结局,平均随访16.9年,失访情况未描 述,但不能明确在这种长期随访非暴露组中有无新 发PID可能;Lin等[7]随访了1~3年,但前6月内无卵 巢肿瘤发生,失访率小于20%。(3)两研究的结局 指标均使用HR,减少了删失数据对结果的影响。 (4)Stewart等以研究不孕症者接受体外受精这个 暴露因素为主,而Lin等以研究PID这个暴露因素为 主。(5)2个研究虽然控制了一定的混杂因素,但 未控制最重要的几个混杂因素。(6)Lin等的研究 在暴露组、非暴露组的代表性,暴露因素的确定这 些方面Lin等的研究质量和研究结论的可靠性要优 于Stewart等的研究。 3.2.2 病例-对照研究
(1)8个病例-对照研究 中,有6个研究的样本量较大,且NOS评分均在7 分,但研究间存在一定异质性,经亚组分析后减小 了统计学异质性。(2)所有研究均未介绍如何确定 暴露因素的,大部分研究都未描述无应答率。(3) 个别研究病例、对照的代表性不理想。(4)纳入的 研究均是以问卷调查的形式进行收集数据,研究间 调查问卷设计及内容有差异,且属于回顾性研究, 存在一定的暴露怀疑偏倚、回忆性偏倚、诊断怀疑 偏倚等信息偏倚。比如此次纳入研究之间PID的报 告率相差明显。5个研究[4,9,11,12,13]中只有1.5%~6%人群 报告了PID病史,而另外3个研究[5,10,14]有15%~26%研 究人群报告了PID病史,研究之间PID史的报告率已 存在明显差异。(5)多个混杂因素(包括危险因素 和保护因素)与卵巢肿瘤的发生相关,7个研究进行 了年龄匹配,但控制的混杂因素不同,Meta分析的 结果自然也会受到这些混杂因素的影响,增强或者 减弱PID对卵巢肿瘤发生的风险效应。
鉴于本系统评价的局限性建议今后多进行前 瞻性的研究,能将暴露组和非暴露组主要混杂因 素进行匹配,对卵巢癌的各项危险、保护因素如 遗传、生殖等进行分层分析,着重PID暴露次数或 慢性PID与卵巢肿瘤发生关系的研究分析,详细报 告反映研究质量的数据。 3.3 结论
综上所述,队列研究的Meta分析结果提示PID 暴露史可增加卵巢肿瘤的发生风险,而病例-对照 研究发现PID暴露史并未明显增加卵巢肿瘤的发生 风险。但有关复发性PID的研究,均提示随着PID 暴露次数增多,卵巢肿瘤的发生风险随之增加。 鉴于病例对-照研究的局限性,以及大部分研究只 是回顾有无PID病史并未调查患有PID次数,建议 多开展前瞻性的研究以进一步验证复发性或慢性 PID与卵巢肿瘤的发生风险关系。
致谢:感谢甘肃省循证医学与临床转化重点实验室田 金徽老师和杨克虎老师给予我们的帮助。
| [1] | Cramer DW. The epidemiology of endometrial and ovariancancer[J]. Hematol Oncol Clin North Am, 2012, 26(1): 1-12. [2] Yang NN, Yan YQ, Zheng RS, et al. An analysis of incidence andmortality for ovarian cancer in China, 2009[J]. Zhongguo ZhongLiu, 2013, 22(8): 617-21. [杨念念, 严亚琼, 郑荣寿, 等. [1] Cramer DW. The epidemiology of endometrial and ovariancancer[J]. Hematol Oncol Clin North Am, 2012, 26(1): 1-12. |
| [2] | Yang NN, Yan YQ, Zheng RS, et al. An analysis of incidence andmortality for ovarian cancer in China, 2009[J]. Zhongguo ZhongLiu, 2013, 22(8): 617-21. [杨念念, 严亚琼, 郑荣寿, 等. 中国2009年卵巢癌发病与死亡分析[J]. 中国肿瘤, 2013, 22(8): 617-21.] |
| [3] | Ness RB, Cottreau C. Possible role of ovarian epithelialinflammation in ovarian cancer[J]. J Natl Cancer Inst, 1999,91(17): 1459-67. |
| [4] | Shu XO, Brinton LA, Gao YT, et al. Population-based case-controlstudy of ovarian cancer in Shanghai[J]. Cancer Res, 1989, 49(13):3670-4. |
| [5] | Booth M, Beral V, Maconochie N, et al. A case-control study ofbenign ovarian tumours[J]. J Epidemiol Community Health, 1992,46(5): 528-31. |
| [6] | Chen ZX, Liu H, Pan YF, et al. Methods of quality evaluation ofmedical literatures[J]. Zhongguo Xun Zheng Yi Xue Za Zhi, 2011,11(11): 1229-36. [陈泽鑫, 刘慧, 潘益峰, 等. 试验性和观察性研究相关医学文献质量评价方法[J]. 中国循证医学杂志, 2011,11(11): 1229-36.] |
| [7] | Lin HW, Tu YY, Lin SY, et al. Risk of ovarian cancer in womenwith pelvic inflammatory disease: a population-based study[J].Lancet Oncol, 2011, 12(9): 900-4. |
| [8] | Stewart LM, Holman CD, Finn JC, et al. In vitro fertilization isassociated with an increased risk of borderline ovarian tumours[J].Gynecol Oncol, 2013, 129(2): 372-6. |
| [9] | Merritt MA, Green AC, Nagle CM, et al. Talcum powder, chronicpelvic inflammation and NSAIDs in relation to risk of epithelialovarian cancer[J]. Int J Cancer, 2008, 122(1): 170-6. |
| [10] | Risch HA, Howe GR. Pelvic inflammatory disease and the risk ofepithelial ovarian cancer[J]. Cancer Epidemiol Biomarkers Prev,1995, 4(5): 447-51. |
| [11] | Parazzini F, La Vecchia C, Negri E, et al. Pelvic inflammatorydisease and risk of ovarian cancer[J]. Cancer EpidemiolBiomarkers Prev, 1996, 5(8): 667-9. |
| [12] | Ness RB, Grisso JA, Cottreau C, et al. Factors related toinflammation of the ovarian epithelium and risk of ovariancancer[J]. Epidemiology, 2000, 11(2): 111-7. |
| [13] | Wu AH, Pearce CL, Tseng CC, et al. Markers of inflammation andrisk of ovarian cancer in Los Angeles County[J]. Int J Cancer,2009, 124(6): 1409-15. |
| [14] | Rasmussen CB, Faber MT, Jensen A, et al. Pelvic inflammatorydisease and risk of invasive ovarian cancer and ovarian borderlinetumors[J]. Cancer Causes Control, 2013, 24(7): 1459-64. |
| [15] | Shan W, Liu J. Inflammation: a hidden path to breaking the spellof ovarian cancer[J]. Cell Cycle, 2009, 8(19): 3107-11. |
| [16] | MacciòA, Madeddu C. Inflammation and ovarian cancer[J].Cytokine, 2012, 58(2): 133-47. |
| [17] | Li YF, Li RX, Shi SH. Neodoxy of epithelial ovarian cancer cellsorigin[J]. Xian Dai Fu Chan Ke Jin Zhan, 2013, 22(2): 152-3.[李艳芳, 李荣霞, 史淑红. 上皮性卵巢癌细胞起源新学说[J]. 现代妇产科进展, 2013, 22(2): 152-3.] |
| [18] | Gong TT, Wu QJ, Vogtmann E, et al. Age at menarche and risk ofovarian cancer: a Meta-analysis of epidemiological studies[J]. IntJ Cancer, 2013, 132(12): 2894-900. |
| [19] | Seidman JD, Sherman ME, Bell KA, et al. Salpingitis salpingoliths,and serous tumors of the ovaries: is there a connection?[J]. IntGynecol Pathol, 2002, 21(2): 101-7. |
| [20] | Kisielewski R, Tolwinska A, Mazurek A, et al. Inflammation andovarian cancer--current views[J]. Ginekol Pol, 2013, 84(4): 293-7. |
| [21] | Kelly AM, Ireland M, Aughey D. Pelvic inflammatory disease inadolescents: high incidence and recurrence rates in an urban teenclinic[J]. J Pediatr Adolesc Gynecol, 2004, 17(6): 383-8. |
 2015, Vol. 42
2015, Vol. 42