文章信息
- 熊羽,樊青霞,赵国强. 2015
- XIONG Yu, FAN Qingxia, ZHAO Guoqiang. 2015
- 索拉非尼对食管癌EC9706细胞的生长抑制作用
- Inhibitory Effect of Sorafenib on Growth of Human Esophageal Cancer Cells EC9706
- 肿瘤防治研究, 2015, 42(04): 324-327
- Cancer Research on Prevention and Treatment, 2015, 42(04): 324-327
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.04.002
-
文章历史
- 收稿日期:2014-04-21
- 修回日期:2014-07-22
2. 450001 郑州,郑州大学基础医学院微生物免疫研究室
2. Department of Microbiology and Immunology, School of Basic Medical Sciences, Zhengzhou University, Zhengzhou 450001, China
食管癌是最常见的恶性肿瘤之一,全球年新发病约为48.2万例,年死亡约40.7万例,中国食管癌粗发病率和粗死亡率均居世界第1位,在我国恶性肿瘤中,食管癌发病率居第4位、死亡率居第5位[1, 2]。我国食管癌一直以食管鳞癌为主,食管腺癌的发病率未见明显的增长[3]。在治疗方面,早中期食管癌普遍采用手术或放疗为主、化疗为辅的治疗模式,晚期则采用放、化疗联合治疗模式。目前药物治疗仍是晚期食管癌治疗的重要手段之一,但总的疗效并不令人满意[4]。
食管癌的靶向治疗是当前研究热点,索拉非尼(sorafenib)作为一种小分子多激酶抑制剂,能有效抑制Raft丝裂原活化的细胞外信号调节激酶的激酶(MEK)/细胞外信号调节激酶(ERK)信号通路[5]。2005年,sorafenib被美国食品和药品管理局(FDA)批准用于治疗晚期肾细胞癌。2007年,美国临床肿瘤学会年会公布的研究结果显示,sorafenib可有效延长晚期肝细胞癌患者的生存时间[6]。临床前及临床研究显示,索拉非尼具有明显的抗肿瘤效应,Ⅰ、Ⅱ期临床试验发现索拉非尼在肺癌、恶性黑色素瘤等肿瘤中具有抗肿瘤效应[7, 8]。目前,关于sorafenib对食管癌作用尚未报道,本研究旨在初步探讨sorafenib对人食管鳞癌EC9706细胞株的生长抑制作用及其机制。1 材料与方法1.1 材料
人食管鳞癌EC9706细胞由郑州大学基础医学院重点实验室馈赠。索拉非尼购自德国Bayer公司,RPMI 1640培养液、2.5 g/L胰蛋白酶均购自北京Solarbio公司,胎牛血清购自杭州四季青公司,二甲基亚砜、Hoechst/PI 双染试剂盒购自南京凯基生物公司,反转录试剂盒购自上海诺论生物公司,引物购自上海生工生物工程有限公司,抗体购自美国Santa Cruz公司。1.2 方法1.2.1 细胞培养
常规培养EC9706细胞,用含体积分数10%胎牛血清的RPMI 1640培养液(内含青霉素100 ku/L、 链霉素100 mg/L)于37℃ CO2培养箱中培养,用0.25%胰酶消化传代,每2天换液传代1次。1.2.2 细胞划痕实验
取对数生长期细胞,胰酶消化后制成单细胞悬液,细胞密度为5×105个/孔,接种于6孔板中,培养24 h贴壁后,用10 μl标准无菌枪头垂直于6孔板底面划痕,以sorafenib终浓度3、6 μmol/L加药分组,对照组不加药,用含体积分数为10%胎牛血清的RPMI 1640培养液培养,作用24 h后于倒置显微镜下观察药物作用后细胞形态变化、取样,拍照,测量细胞向划痕区迁移的相对距离,实验重复5次。 1.2.3 Hoechst/PI凋亡检测
实验组按sorafenib终浓度3、6 μmol/L加药分组,对照组不加药。细胞培养48 h后,吸除培养液,胰蛋白酶消化,悬液转移至离心管离心后,去上清液,经吹打、收集、离心,PBS洗后,将1×106个细胞悬浮于1 ml培养液,加入10 μl Hoechst染液混匀,37℃孵育10 min后,4℃离心5 min后去上清液,用1 ml Buffer A重悬细胞,加5 μl PI染液后室温暗室孵育15 min。荧光显微镜观察细胞形态变化、取样、拍照,实验重复3次。 1.2.4 q RT- PCR检测5种基因mRNA的表达水平
实时荧光定量PCR:实验组按6 μmol/L加药,对照组不加药。细胞培养48 h后,收集细胞,按 Trizol试剂盒说明提取总RNA,电泳鉴定、定量,反转录合成cDNA。PCR反应前3~15个循环的荧光信号作为荧光本底信号,调节基线至适宜处,各荧光曲线与基线交叉点的循环数即为Ct值。根据公式ΔCt=Ct目的基因-Ctβ-actin和ΔΔCt=2-ΔΔCt,计算检测基因mRNA相对表达量,每组重复3次并取平均值。所检测目的基因AKT、Bcl-2、MMP-2、MMP-9、TIMP1和β-actin的相关PCR引物序列,见表 1。
实验组按6 μmol/L加药,对照组不加药。细胞培养48 h后,用预冷的PBS冲洗3次后,冰上裂解15 min,4℃、13 000 g 离心30 min;将上清液转移至1.5 ml离心管,加入5×SDS smple buffer混匀,蛋白变性,分装,置于-80℃保存。测定样品蛋白浓度:将蛋白样品加入10% SDS-聚丙烯凝胶中电泳分离,电泳完毕后,切胶,冰上转膜;经5%脱脂奶粉封闭,分别加入AKT(1:1 000),p-AKT(1:1 000),Bcl-2(1:1 000),MMP-2(1:300),TIMPl(1:300),β-actin(1:1 000)后4℃孵育过夜,再加入二抗(1:5 000)后常温孵育1 h,最后暗室曝光,拍照。1.3 统计学方法
采用SPSS 17.0软件进行统计学分析。各实验至少重复3次,数据资料用x±s表示,两样本采用t检验,经方差齐性检验,多组均数比较采用单因素方差分析,组间比较用LSD-t法,P<0.05为差异有统计学意义。2 结果2.1 sorafenib对EC9706细胞迁移的影响
通过细胞划痕实验发现,培养24 h后,对照组细胞迁移入划痕区的相对距离较3 μmol/L组和6 μmol/L组细胞明显减少12.5 μm和15.4 μm,差异具有统计学意义(P<0.05),见图 1。
 |
| A-C: effects of sorafenib on the migration of EC9706 cells detected by cell wound healing assay; A: control group;B: 3μmol/L group; C: 6μmol/L group; D: relative average distance of cell migration after cultured for 24 hours detected by cell wound healing assay; *: P<0.05, compared with the control group图 1 划痕实验检测sorafenib对EC9706细胞迁移的作用(×100)Figure 1 Effect of sorafenib on the migration of EC9706 cells detected by cell wound healing assay(×100) |
sorafenib作用EC9706细胞48 h后,同对照组相比,实验组(3 μmol/L组和6 μmol/L组)红染细胞增多,且随着药物浓度的增加,凋亡细胞明显增加(P<0.05),见图 2。
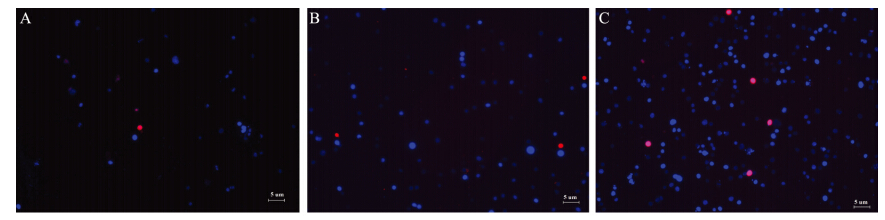 |
| A: control group; B: 3μmol/L sorafenib group; C: 6μmol/L sorafenib group图 2 Hoechst/PI 染色阳性细胞(×100)Figure 2 Positive staining cells detected by Hoechst/PI(×100) |
结果显示,与对照组相比,加药组(6 μmol/L组)AKT、Bcl-2、MMP-2、MMP-9表达下调,TIMP1表达上调,见表 2。
 |
同对照组相比,6 μmol/L组sorafenib能够明显降低AKT、p-AKT、MMP-2、Bcl-2蛋白的表达水平,提高TIMP1蛋白表达水平,见图 3A、3B。
 |
| 1: control group; 2: drug group 图 3 sorafenib对EC9706细胞5种蛋白水平表达的影响(n=5)Figure 3 Effect of sorafenib on the expression of five proteins in EC9706 cells (n=5) |
已有研究报道 ,单靶点EGFR TKI如gefitinib、erlotinib用于二线治疗晚期食管癌,效果不够理想[9, 10]。食管癌发病机制复杂,当抑制血管内皮生长因子(vascular endothelial growth factor,VEGF)旁路时,能够使绝大多数肿瘤临床症状明显改善[11]。因此多靶点可能比单靶点治疗食管癌更有效。
sorafenib作为一种小分子多激酶抑制剂,它不仅能够有效抑制丝氨酸激酶、苏氨酸激酶的活性,还可以抑制血管内皮生长因子受体,血小板衍生生长因子受体以及c-Kit、Flt-3、RET等受体,从而抑制多条下游信号通路的激活[12]。血管内皮生长因子(VEGF)和金属基质蛋白酶(MMPs)相互影响、相互作用,能够共同促进肿瘤细胞浸润及转移[13]。基质金属蛋白酶抑制剂(TIMPs)是MMPs的特异性组织抑制物,TIMP-1低浓度表达与肿瘤的远处转移相关[14]。PI3K-AKT信号通路在肿瘤发生、发展中起着重要作用,当其发生突变时,调控基因表达,从而诱导肿瘤的生成[15]。Bcl-2 蛋白是一种能够抑制细胞凋亡的抗凋亡蛋白,该蛋白表达上调与不良预后有着直接关联,表达下调能够增强肿瘤对凋亡的敏感度。有研究表明,PI3K-AKT信号通路可以通过上调基质金属蛋白酶(MMP)的表达促进肿瘤血管生成等途径增强肿瘤细胞的侵袭[16]。sorafenib由于能够抑制血管内皮生长因子受体的表达,进而阻断 PI3KAKT通路,显示出抗肿瘤活性。
在本实验中,s o r af en ib能够抑制食管鳞癌EC9706细胞的迁移,促进其坏死凋亡,同时降低MMP-2、MMP-9、AKT、p-AKT、Bcl-2的表达水平,上调TIMP1表达水平,提示sorafenib可能是通过抑制VEGF来抑制PI3K-AKT信号通路而下调 Bcl-2及MPPs的表达,这些方式可能是其抗肿瘤的机制之一。由于sorafenib为多靶点的抗肿瘤药物,其抗肿瘤机制复杂,仍需今后进一步研究与探讨。
| [1] | Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2): 69-90. |
| [2] | Zhang SW, Zhang M, Li GL, et al. An analysis of incidence and mortality of esophageal cancer in China, 2003-2007[J].Zhongguo Zhong Liu, 2012, 21(4): 241-7.[张思维, 张敏, 李光琳, 等. 2003-2007年中国食管癌发病与死亡分析[J]. 中国肿瘤, 2012, 21(4): 241-7.] |
| [3] | He J, Shao K. The epidemiology, current status of management, challenge and future strategy for esophageal cancer in China[J].Zhongguo Ai Zheng Za Zhi, 2011, 21(7): 501-4.[赫捷, 邵康. 中国食管癌流行病学现状、诊疗现状及未来对策[J]. 中国癌症杂志, 2011, 21(7): 501-4.] |
| [4] | Cheng X, Chen SY, Liu FG. Advances in chemotherapy of esophageal cancer[J]. Ai Zheng Jin Zhan, 2013, 11(5): 425-30. [程欣, 陈思禹, 刘福国. 食管癌化疗进展[J]. 癌症进展, 2013, 11(5): 425-30.] |
| [5] | Hahn O, Stadler W. Sorafenib[J]. Curr Opin Oncol, 2006, 18(6):615-21. |
| [6] | Llovet JM, Ricci S, Mazzaferro V, et a1. Sorafenib in advanced hepatocellular carcinoma[J]. N Engl J Med, 2008, 359(4): 378-90. |
| [7] | Sharma N, Pennell N, Nickolich M, et a1. Phase Ⅱ trial of Sor af enib in conjunction with chemother apy and as maintenance therapy in extensive-stage small cell lung cancer[J]. Invest New Drugs, 2014, 32(2): 362-8. |
| [8] | Monk P, Lam E, Mortazavi A, et al. A phase Ⅰ study of high-dose interleukin-2 with sorafenib in patients with metastatic renal cell carcinoma and melanoma[J]. J Immunother, 2014, 37(3): 180-6. |
| [9] | Ferry DR, Anderson M, Beddard K, et al. A phase Ⅱ study of gefitinib monotherapy in advanced esophageal adenocarcinoma: evidence of gene expression, cellular, and clinical response[J].Clin Cancer Res, 2007, 13(19): 5869-75. |
| [10] | Ilson DH, Kelsen D, Shah M, et al. A phase 2 trial of erlotinib in patients with pr eviously tr eated squamous cell and adenocarcinoma of the esophagus[J]. Cancer, 2011, 117(7): 1409-14. |
| [11] | Hasumi Y, Klosowska-Wardega A, Furuhashi M, et al. Identification of a subset of pericytes that respond to combination therapy targeting PDGF and VEGF signaling[J]. Int J Cancer, 2007, 121(12): 2606-14. |
| [12] | Kim A, Balis FM, Widemann BC. Sorafenib and sunitinib[J]. Oncologist, 2009, 14(8): 800-5. |
| [13] | Shi YL, Xu T, Li LP, et al. Over-expression of VEGF and MMP-9 in residual tumor cells of hepatocellular carcinoma after embolization with lipidol[J]. J Huazhong Univ Sci Technolog Med Sci, 2013, 33(1): 90-5. |
| [14] | O'Grady A, Dunne C, O'Kelly P, et al. Differential expression of matrix metalloproteinase (MMP)-2,MMP-9and tissue inhibitor of metalloproteinase (TIMP)-l and TIMP-2 in non-melanoma skin cancer: implications for tumour progression[J]. Histopathology, 2007, 51(6): 793-804. |
| [15] | Villegas-Comonfort S, Castillo-Sanchez R, Serna-Marquez N, et a1. Arachidonic acid promotes migration and invasion through a PI3K/Akt-dependent pathway in MDA-MB-231 breast cancer cells[J]. Prostaglandins Leukot Essent Fatty Acids, 2014, 90(5): 169-77. |
| [16] | Chetty C, Lakka SS, Bhoopathi P, et al. MMP-2 alters VEGF expression via alphaVbeta3 integrin-mediated PI3K/AKT signaling in A549 lung cancer cells[J]. Int J Cancer, 2010, 127(5): 1081-95. |
 2015, Vol. 42
2015, Vol. 42