文章信息
- 曾令成,叶飞,韩林,郭东生,雷霆. 2015.
- ZENG Lingcheng, YE fei, HAN Lin, Guo Dongsheng, LEI Ting. 2015.
- 脂肪酸结合蛋白5和细胞维甲酸结合蛋白2在脑胶质瘤中的表达
- Expression of Fatty Acid-binding Protein 5 and Cellular Retinoic Acid-binding Protein 2 in Gliomas
- 肿瘤防治研究, 2015, 42(03): 242-245
- Cancer Research on Prevention and Treatment, 2015, 42(03): 242-245
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.03.007
-
文章历史
- 收稿日期:2014-03-21
- 修回日期:2014-10-09
胶质瘤是颅内最常见的恶性肿瘤,尽管经手 术、放疗及化疗等综合治疗,患者总体预后仍较 差[1]。近10余年研究进展发现,胶质瘤内的胶质瘤 干细胞为放、化疗抵抗及肿瘤复发的根源,因此 诱导该类原始细胞分化,增强其对术后辅助治疗 的敏感度,为一重要的研究策略[2]。
在众多的促分化药物中,维甲酸因较显著地 促白血病干细胞的分化效应在胶质瘤的研究中受 到了关注。维甲酸促分化治疗已开始用于脑胶质 瘤的Ⅱ期临床研究,但疗效欠佳,提示胶质瘤细 胞可能对维甲酸诱导分化存在着抵抗[3]。可能抵 抗机制众多,而维甲酸在肿瘤细胞内的代谢、转运异常可作为一重要的研究切入点[4]。在乳腺 癌中的研究表明维甲酸可与细胞质内维甲酸结 合蛋白2(cellular retinoic acid-binding protein 2, CRABP2)结合,发挥促细胞分化或凋亡效应,或 与脂肪酸结合蛋白5(fatty acid-binding protein 5, FABP5)结合,发挥促增殖效应[4]。FABP5的异常 高表达、CRABP2的异常低表达导致维甲酸促增殖 效应的发挥,可为肿瘤对维甲酸抵抗机制之一[4]。 因此,我们推测胶质瘤细胞质内维甲酸转运蛋白 FABP5和CRABP2的表达可能存在异常,基于此我 们进行了上述两分子在脑胶质瘤中的表达研究。 1 材料和方法 1.1 材料
收集2011年9月—2012年9月期间华中科技大学 同济医学院附属同济医院神经外科行手术治疗并经 病理证实的脑胶质瘤标本,共125例,其中男70例、 女55例;年龄15~77岁,平均年龄(45±28)岁; 按 WHO病理分级为:Ⅱ级25例、Ⅲ级34例、Ⅳ级66例。 胶质瘤细胞株NCH82、NCH87及NCH89由德国海德 堡大学神经外科研究室Herold-Mende教授惠赠。 1.2 试剂
鼠抗人FABP5单克隆抗体(稀释度1:50) 及鼠抗人CRABP2单克隆抗体(稀释度1:50) 均购自英国Abcam公司;生物素化羊抗鼠二抗 (1:200)、ABC法试剂盒及AEC显色试剂盒均购 自美国Vector Laboratories公司。RNA提取试剂盒 RNEasy Mini Kit购自德国Qiagen公司。荧光定量 ABsoluteTM QPCR Capillary Mix Kit试剂盒购自美 国Thermo scientific公司。FABP5、CRABP2及内参 PitPNB实时定量PCR引物设计采用Universal probe finder网络软件,引物均由德国Tibmol公司合成。 Brdu-ELISA试剂盒购自德国Roche公司。全反式 维甲酸(all trans retinoic acid,ATRA)购自美国 Sigma-Aldrich公司。 1.3 免疫组织化学染色法
采用ABC法。石蜡切片经二甲苯脱蜡,梯度乙 醇水化,磷酸盐缓冲液(PBS)洗5 min,以pH 9.9枸 椽酸盐抗原修复液,94℃孵育20 min行抗原修复。 PBS洗涤3次,每次5 min,再滴加FABP5或CRABP2 一抗,4℃过夜孵育。PBS洗涤3次,每次5 min后, 以生物素化抗鼠二抗室温下孵育30 min。继以PBS 洗涤3次,每次5 min,加ABC复合物室温作用30 min。PBS洗涤3次,每次5 min后,加AEC显色5~30 min,显微镜下依据显色强度,适时在PBS中终止显 色反应,苏木精对比染色,自来水冲洗,封片。 1.4 免疫组织化学结果评判
在200倍视野下观察,随机选取4个视野,拍 照。每视野行阳性细胞计数,并计算百分比, 取平均值作为该样本的阳性细胞表达比例。同 时采用华中科技大学同济医学院病理教研室 HMIAS-2000型全自动医学彩色图像分析系统进行 图像分析,测量FABP5及CRABP2表达的吸光度 值,取平均值作为其表达强度。平均吸光度值≥ 0.04为阳性表达。 1.5 细胞培养
阳性细胞组为ATRA处理组,阴性对照组为无 ATRA处理组。阴性组胶质瘤细胞培养于添加10% 胎牛血清的DMEM培养液中,阳性组细胞培养于 含1 μmol/L ATRA的上述培养液中,ATRA作用时 间为1周。培养箱环境为37℃、含5% CO2和20% O2,每3天换液1次。 1.6 Brdu-ELISA细胞增殖测定
胶质瘤细胞以每孔5×103的密度接种于96孔板, 孵育48 h后,每孔加入10 μmol/L的Brdu标记液, 37℃孵育24 h后,按说明书步骤完成Brdu测定。 1.7 实时荧光定量PCR
胶质瘤细胞的RNA提取采用RNEasy MiniKit试剂盒并按说明书指导步骤进行。 cDNA的合成及PCR反应液的配制采用 ABsoluteTM QPCR Capillary Mix Kit试剂盒,依 据厂家指导步骤进行。FABP5上游引物序列: 5’-GCAGACCCCTCTCTGCAC-3’;下游引物 序列:5’-TCGCAAAGCTATTCCCACTC-3’。 CRABP2上游引物序列:5’-CGAGGAATTGCTCA AAGTGC-3’;下游引物序列:5’-TCCTGTTTGAT CTCCACTGCT-3’。PitPNB上游引物序列:5’-CGA GACTCAGAAAGAACTAGAAACAA-3’;下游引 物序列:5’-TGACCCTACAGGGGACTCAT-3’。反 应条件为:95℃ 15 min; 95℃ 15 s,59℃ 1 min, 72℃ 1 s,循环40次;40℃ 30 s。管家基因PitPNB 作为内参,FABP5 mRNA及CRABP2 mRNA定量结 果采用RelQuant 1.01软件分析得出。 1.8 统计学方法
计量资料以x ±s表示,各组间均数比较以Excel软 件t检验进行统计分析,P<0.05为差异有统计学意义。 2 结果 2.1 FABP5蛋白表达与胶质瘤患者病理级别的关系
免疫组织化学染色显示脑胶质瘤样本中FABP5 阳性染色主要定位于细胞质,见图 1。FABP5 蛋白表达随胶质瘤病理级别的升高而显著增加 (P<0.05):在WHOⅡ级星型细胞瘤中阳性细胞 比例为(16±9)% ,平均表达强度为(0.0686± 0.03); WHOⅢ级肿瘤中占(33±22)%,平均表 达强度为(0.0948±0.0476);在WHOⅣ级肿瘤中占(50±29)%,平均表达强度为(0.1541±0.044)。
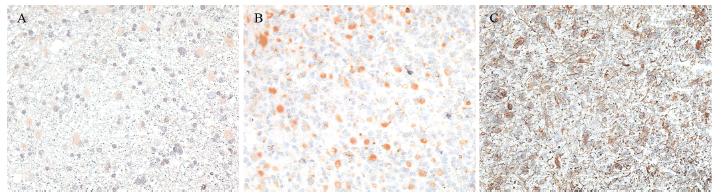
|
| A :WHO gradeⅡ glioma; B: WHO grade Ⅲ glioma; C: WHO grade Ⅳ glioma 图 1 FABP5蛋白在脑胶质瘤中的表达 (ABC ×200) Figure 1 Expression of FABP5 proteins in gliomas (ABC ×200) |
免疫组织化学染色显示脑胶质瘤样本中 CRABP2阳性染色主要定位于细胞质,见图 2。 CRABP2表达随胶质瘤病理级别的升高而显著减少 (P<0.05):在Ⅱ级星型细胞瘤中阳性细胞比例为 (46±12)%,平均表达强度为(0.210±0.056);Ⅲ 级肿瘤中占(30±15)%,平均表达强度为(0.160± 0.064);在Ⅳ级肿瘤中占(10±9)%,平均表达强 度为(0.080±0.055)。
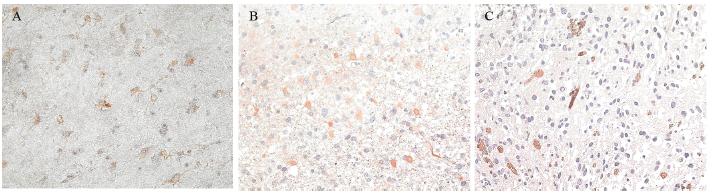
|
| A :WHO grade Ⅱ glioma; B: WHO grade Ⅲ glioma; C: WHO grade Ⅳ glioma 图 2 CRABP2蛋白在脑胶质瘤中的表达 (ABC×200) Figure 2 Expression of CRABP2 proteins in gliomas (ABC×200) |
用Brdu-ELISA法检测并比较了ATRA对胶质瘤 细胞株NCH82、NCH87及NCH89作用前后的细胞 增殖状况,结果显示ATRA作用后,细胞增殖显著 增加(P<0.05),见图 3。
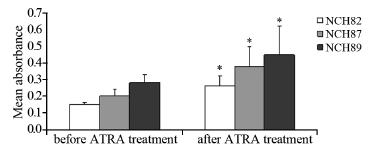
|
| *:P<0.05,compared with the data before ATRA treatment 图 3 ATRA对胶质瘤细胞株的增殖效应检测 Figure 3 Proliferative effect of ATRA on glioma cell lines |
以实时荧光定量PCR检测ATRA作用前后胶 质瘤细胞株NCH82、NCH87及NCH89中FABP5及 CRABP2在mRNA水平的表达,显示ATRA作用 后FABP5表达显著上调(P<0.05),见图 4A,而 CRABP2显著下调(P<0.05),见图 4B。
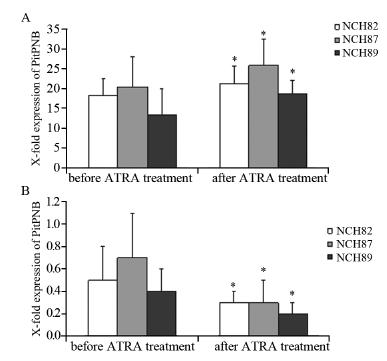
|
| A: FABP5; B: CRABP2 *: P<0.05,compared with the data ATRA treatment 图 4 ATRA作用前后胶质瘤细胞株中FABP5及CRABP2在mRNA水平的表达 Figure 4 Expression of FABP5 and CRABP2 mRNA in glioma cell lines before and after ATRA treatment |
本研究表明在脑胶质瘤中FABP5蛋白表达与 胶质瘤恶性级别呈显著正相关,FABP5可能与脑胶 质瘤的恶性进展相关。FABP5属于脂质结合蛋白超 家族的一员,主要参于细胞脂肪酸的代谢、转运, 并可与细胞内维甲酸结合,将其转运至PPARβ/δ信 号通路,从而发挥促细胞增殖功能[4]。已有研究表 明,FABP5促增殖效应参与了许多人类肿瘤的发生 及发展。例如,在胆管癌细胞的研究中,FABP5沉 默后,细胞增殖明显降低,而过表达后,细胞增殖 及侵袭能力明显增高;在临床样本中,FABP5蛋白 表达与肿瘤大小、淋巴结转移、血管侵袭及病变分 期呈显著正相关[5]。在雌激素阴性表达的乳腺癌细 胞中,FABP5敲除后,细胞增殖降低;在乳腺癌组 织中,FABP5蛋白表达与肿瘤级别及患者预后显著 相关[6]。因此,FABP5在脑胶质瘤中的效应与在其 他人类肿瘤中的效应体现了一致性。
CRABP2蛋白也为细胞内维甲酸的结合转运 蛋白,但其负责将维甲酸转运至维甲酸受体信号 通路,继而发挥了促细胞分化及凋亡功能[4]。有关 CRABP2蛋白与人类肿瘤之间关系的报道较少。本 研究表明,在脑胶质瘤中,CRABP2蛋白表达与胶 质瘤恶性级别呈显著负相关,提示CRABP2扮演了抑癌基因的角色。
生理状况下,细胞通过调控FABP5/CRABP2 表达比例,对机体内源性维甲酸的促分化或促增 殖效应进行调节,继而保持了自身稳态。而病理 状况下,上述比例失控,如肿瘤细胞中FABP5过 度高表达,而CRABP2过度低表达,则造成了维 甲酸被竞争性的转运至PPARβ/δ,导致促增殖通路 持续活化,肿瘤细胞异常增殖,促进肿瘤发生发 展;同时,因维甲酸受体促分化通路持续失活,肿 瘤细胞表现出对维甲酸分化的抵抗效应[4]。例如, Schug等[7]在维甲酸抵抗的鼠乳癌模型中观察到 FABP5/CRABP2表达比例高于正常,维甲酸发挥 了明显的促增殖效应,但将上述比例逆转后,维 甲酸则表现出促分化的抗癌效应。Gupta等[8]在胰 腺癌中依据FABP5/CRABP2表达比例的不同,同 样发现了维甲酸的截然相反效应。本研究在脑胶 质瘤标本中发现FABP5及CRABP2蛋白表达随胶质 瘤级别呈截然相反的变化,在WHO Ⅳ级胶质母细 胞瘤中,FABP5/CRABP2比例可达最高。进一步 在培养的胶质瘤细胞中显示维甲酸处理组相对于 未处理组,细胞增殖明显增强,FABP5表达显著上 调,而CRABP2显著下调,因此维甲酸作用后胶质 瘤细胞中FABP5/CRABP2比例显著增高,提示维 甲酸可能被竞争性转运至FABP5-PPARβ/δ 增殖通 路,发挥了促增殖效应,与此同时,胶质瘤细胞 体现了对维甲酸的分化抵抗效应。
在已报道的部分实验研究中证实了维甲酸对胶 质瘤细胞显著的促分化、凋亡效应[9, 10],而本研究 观察到与上述研究不一致的维甲酸效应,该差异 可归因于胶质瘤为一显著的异质性群体。不同个 体的胶质瘤细胞可在其基因表达、调控、细胞构 成以及对辅助治疗的敏感度上存在区别[11]。例如并 非所有的胶质瘤细胞对化疗药物替莫唑胺敏感, 其中表达DNA修复蛋白O6-甲基鸟嘌呤DNA甲基转 移酶 (O6-methylguanine-DNA methyltransferase, MGMT)的胶质瘤细胞体现了明显的耐药性,同 理,也并非所有的胶质瘤细胞可体现敏感的维甲 酸治疗效应。基于本研究结果,未来可构想,依据 肿瘤组织中FABP5/CRABP2表达比例判断肿瘤对 维甲酸疗效的敏感度,或通过抑制FABP5的表达, 促进CRABP2的表达,以降低FABP5/CRABP2比 例,从而促进维甲酸促分化信号通路的活化,以增 加维甲酸的治疗敏感度,并以此作为可能治疗策 略,展开相应研究。
| [1] | Omuro A, DeAngelis LM. Glioblastoma and other malignantgliomas: a clinical review[J]. JAMA, 2013, 310(17): 1842-50. |
| [2] | Binello E, Germano IM. Targeting glioma stem cells: a novelframework for brain tumors[J]. Cancer Sci, 2011, 102(11):1958-66. |
| [3] | Puduvalli VK, Yung W K, Hess K R, et al. North American BrainTumour Consortium.Phase Ⅱ study of fenretinide (NSC 374551)in adults with recurrent malignant gliomas: A North AmericanBrain Tumour Consortium study[J]. J Clin Oncol, 2004, 22(21):4282-9. |
| [4] | Schug TT, Berry DC, Shaw NS, et al. Opposing effects ofretinoic acid on cell growth result from alternate activation of twodifferent nuclear receptors[J]. Cell, 2007, 129(4): 723-33. |
| [5] | Jeong CY, Hah YS, Cho BI, et al. Fatty acid-binding protein 5promotes cell proliferation and invasion in human intrahepaticcholangiocarcinoma[J].Oncol Rep, 2012, 28(4): 1283-92. |
| [6] | Liu RZ,Graham K,Glubrecht DD, et al.Association of FABP5expression with poor survival in triple-negative breast cancer:implication for retinoic acid therapy[J]. Am J Pathol, 2011,178(3): 997-1008. |
| [7] | Schug TT, Berry DC, Toshkov IA, et al. Overcoming retinoicacid-resistance of mammary carcinomas by diverting retinoic acidfrom PPARbeta/delta to RAR[J]. Proc Natl Acad Sci U S A, 2008,105(21): 7546-51. |
| [8] | Gupta S, Pramanik D, Mukherjee R, et al. Molecular determinantsof retinoic acid sensitivity in pancreatic cancer[J]. Clin CancerRes, 2012, 18(1): 280-9. |
| [9] | Shi Z, Lou M, Zhao Y, et al. Effect of all-trans retinoic acid on thedifferentiation of U87 glioma stem/progenitor cells[J]. Cell MolNeurobiol, 2013, 33(7): 943-51. |
| [10] | Li J, Zhang L, Fei Z, et al. Expression of Bcl-2 and Caspase-3 inapoptosis induced by all-trans-retinoic acid of C6 glioma cells inrat[J]. Zhonghua Shen Jing Wai Ke Ji Bing Yan Jiu Za Zhi, 2010,9(1): 23-6. [李娟, 张磊, 费舟, 等. ATRA诱导胶质瘤C6细胞凋亡过程中Bcl-2和Caspase-3表达的研究[J].中华神经外科疾病研究杂志, 2010, 9(1): 23-6.] |
| [11] | Jov?evska I, Ko?evar N, Komel R. Glioma and glioblastoma -how much do we (not) know? [J]. Mol Clin Oncol, 2013, 1(6):935-41. |
 2015, Vol. 42
2015, Vol. 42
