
文章信息
- 汪珊珊,彭朝阳,张宁波,陈丽芳,张丽沙,李伟. 2015.
- WANG Shanshan, PENG Zhaoyang, ZHANG Ningbo, CHEN Lifang, ZHANG Lisha, LI Wei. 2015.
- 小分子化合物PHA-767491对白血病K562细胞抑制增殖和诱导凋亡的作用
- PHA-767491 Inhibits Proliferation and Induces Apoptosis of Leukemia Cells K562
- 肿瘤防治研究, 2015, 42(03): 238-241
- Cancer Research on Prevention and Treatment, 2015, 42(03): 238-241
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.03.006
-
文章历史
- 收稿日期:2014-03-24
- 修回日期:2014-10-23
2.310003 杭州,浙江大学医学院附属儿童医院检验科
2.Clinical Laboratory, The Children’s Hospital of Zhejiang University School of Medicine, Hangzhou 310003, China
肿瘤的发生和发展是一个复杂的过程,在这 一过程中有多种调控因子参与,Cdc7 激酶(cell division cycle 7)就是一个重要的细胞周期调控因 子,Cdc7激酶可以通过磷酸化激活MCM家族的 多个成员来促进细胞周期的起始,研究表明Cdc7 在肿瘤细胞的增殖过程中具有重要作用,Cdc7已 被认为是今后的肿瘤治疗中很有前景的靶标[1, 2, 3, 4]。 PHA-767491是类似ATP分子构型的一类小分子 化合物,其作为Cdc7激酶的抑制剂对多种肿瘤细 胞表现出了极强的抑制能力,不仅可以通过抑制 Cdc7而抑制肿瘤细胞的增殖,也可以通过抑制 CDK9而促进肿瘤细胞的凋亡[5, 6, 7, 8]。慢性髓系白血病 细胞K562具有很强的增殖和耐药能力,本研究将 PHA-767491作用于K562细胞,探讨其对K562细胞 增殖的抑制能力,并进一步研究其作用机制。 1 材料与方法 1.1 材料
K562细胞为本实验室所有,PHA-767491购 自Tocris公司,四甲基偶氮唑盐(MTT)购自 Sigma公司,二甲基亚砜(DMSO) 购自无锡展 望化工试剂有限公司,Hochest33342购自Amresco 公司,Caspase-3一抗购自CST公司,β-actin一抗 购自Apitomics公司,DMEM培养液购自Gibco公 司,Trizol购自Invitrogen公司,反转录试剂盒购自 Ferments公司,sygreen荧光定量PCR试剂盒购自 TOYOBO公司,Mcl-1一抗购自Santa cruz公司, Annexin V-FITC/PI凋亡检测试剂盒购自Becton Dickinson公司。 1.2 细胞增殖的检测
用含10%血清的DMEM按105/ml将K562细胞稀 释后,以每孔100 μl接种到96孔板中,培养12 h后, PHA-767491按5、10、15、20、25 μmol/L的5个浓 度,不加药为对照组,每组均设6个复孔。培养 48 h后每孔加入浓度为5 mg/ml的MTT溶液20 μl, 37℃孵育4 h后吸去上清液,各孔分别加入150 μl的 DMSO溶液,在摇床摇育20 min,酶标仪590 nm检 测A590值。相同实验重复两次。对照组,将浓度为5 μmol/L 的PHA-767491加入96孔板中,每组均设6个 复孔。分别于24、48和72 h用MTT法检测细胞存活 率,方法同上。 1.3 qRT-PCR检测Xiap和Mcl-1的mRNA水平
在六孔板中接种5×105个K562 细胞,培养 12 h后,在PHA-767491组中加入5 μ m o l / L的 PHA-767491,加等体积磷酸盐缓冲液于对照组, 37℃培养24 h后,吸去细胞培养液,利用Trizol 抽提细胞总RNA,总RNA按照Fermentas公司的 cDNA合成试剂盒操作说明进行mRNA的反转 录,转录产物进行相关基因表达水平的荧光定量 PCR(ABI7300)分析,内参为GAPDH。其中Xiap基 因的引物序列为:上游:5’-GGTGA TAAAGTAA AGTGCTTTCACTGT-3’,下游:5’-TCAGTAGTTC TTACCAGACACTCCTCAA -3’。Mcl-1基因的引物序 列为:上游:5’-CTTTTGGCTACGGAGA AGGAG-3’, 下游:5’- GAGTCTGGCGTGAGGGTG-3’;GAPDH 基因的引物序列为:上游:5’ - CATGAGAAG TATGACAACAGCCT-3’,下游:5’-AGTCCTTCCAC GATACCAAAGT-3’。 1.4 Western blot检测相关蛋白的表达
在六孔板中接种5×105个K562细胞12 h后, PHA-767491组加5 μmol/L的PHA-767491,对照 组加等体积的磷酸缓冲液,37℃培养24 h后,吸 去培养液,加入细胞裂解液,冰浴1 min后,刮下 细胞,所有液体移至EP管中,13 000 r/min离心5 min,取上清液定量,加入loading buffer于12%的 SDS-PAGE 电泳后转膜。用10%的牛血清封闭过 夜,分别加入1∶1 000的Caspase-3抗体、Mcl-1抗 体以及β-actin抗体,37℃摇育2 h。TBST洗两遍, 加入荧光二抗,37℃摇育1 h。TBST洗两次,在红 外激光成像系统进行蛋白分析。 1.5 流式细胞仪检测细胞凋亡水平
在六孔板中接种5×105个K562细胞,加药组加 5 μmol/L的PHA-767491,对照组加等体积的磷酸 盐缓冲液,37℃培养24 h后,吸去培养液,用预冷 的PBS洗两遍,加入胰酶将细胞从壁上消化下来后 加入400 μl的1×binding buffer将细胞吹匀悬浮,分 别加入1.5 μl的Annexin V和1.5 μl的PI。遮光室温 置15 min后,流式细胞仪分析。 1.6 统计学方法
相同实验重复三次,使用SPSS 11.0统计软件 进行分析,组间比较采用t检验。 2 结果 2.1 细胞增殖检测
细胞增殖和抑制实验结果见图 1。如图 1A所示, 随着PHA-767491浓度的逐渐增加,K562细胞存活 率逐渐降低(P<0.05),表明PHA-767491对K562 细胞有较强的杀伤力。同时,图 1B显示5 μmol/L 的PHA-767491处理K562细胞后,PHA-767491可 以长时间的抑制K562细胞的增殖。以上结果显示 PHA-767491可以长期高效地抑制K562细胞的增殖。

|
| A:Concentration gradient of PHA-767491;B:Time gradient of PHA-767491 图 1 PHA-767491抑制K562细胞增殖 Figure 1 Proliferation of K562 cells inhibited by PHA-767491 |
PHA-767491处理K562细胞后,抗凋亡蛋白 Xiap和Mcl-1的表达实验结果见图 2。如图 2A所 示,PHA-767491处理K562细胞后,抗凋亡蛋白 Xiap和Mcl-1的mRNA水平被显著下调(P<0.05)。 Western blot结果表明,PHA-767491处理K562细胞 后,Xiap和Mcl-1蛋白表达水平被显著抑制,且随着PHA-767491浓度的增大,Xiap和Mcl-1蛋白表达被 抑制增强,且随浓度的增加,发生凋亡细胞的数量 显著增加,见图 2B。以上结果显示,PHA-767491可 以显著下调抗凋亡蛋白Xiap和Mcl-1的表达。

|
| Xiap: X-linked inhibitor of apoptosis protein; Mcl-1: myeloid cell leukemia-1;A:Xiap and Mcl-1 mRNA levels down-regulated by PHA-767491;B:Protein expression levels of Xiap and Mcl-1 downregulated by PHA-767491 图 2 PHA-767491下调Xiap和Mcl-1的表达 Figure 2 Expression of Xiap and Mcl-1 down-regulated by PHA-767491 |
PHA-767491诱导K562细胞凋亡实验结果见 图 3。图 3A为不同浓度PHA-767491作用48 h后, 诱导K562细胞凋亡程度的比较。作为荧光探针 的Hoechst 33342可与DNA分子结合,可见细胞凋 亡过程中细胞核发生片段化,且随浓度的增加, 发生凋亡细胞的数量显著增加,见图 3A箭头所 指。图 3B为浓度为2.5 μmol/L的PHA-767491作用 于K562细胞的不同时间,细胞发生凋亡程度与 空白对照的比较。Hoechst染色结果表明,随着 PHA-767491作用时间的增加,出现核小体凋亡的 K562细胞显著增多,见图 3B箭头所指。
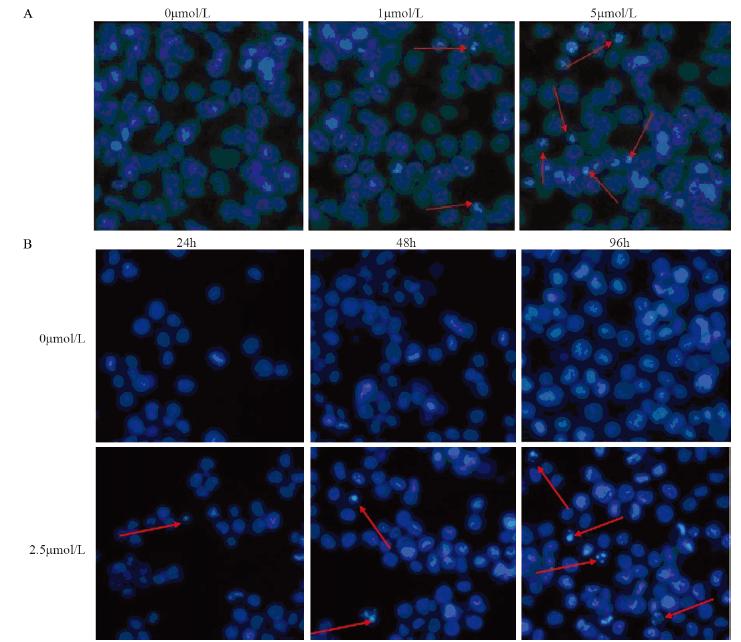
|
| A: concentration gradient of PHA-767491; B: time gradient of PHA-767491 图 3 hoechst33342检测K562细胞凋亡现象 Figure 3 Apoptosis of K562 cells examined by examined fluorescent probe hoechst33342 |
PHA-767491处理K562细胞后,Annexin V和 PI双染后流式细胞仪检测结果表明,PHA-767491 可以明显诱导K562细胞凋亡,进一步检测细胞 凋亡信号通路表明,PHA-767491可以显著诱导 Caspase3蛋白的降解,实验结果见图 4。

|
| A:The apoptosis levels of K562 cells were detected by flow cytometry; B: The effect of PHA-767491 on the expression of Caspase3 图 4 流式细胞仪检测PHA-767491诱导K562细胞凋亡 Figure 4 PHA-767491 induced the apoptosis of K562 cells detected by FCM |
肿瘤细胞DNA复制中的一些关键因子已成为 肿瘤治疗的关键靶点。作为DNA复制起始复合 物激活因子的Cdc7激酶,其过度激活大大促进了 肿瘤细胞的增殖。多个研究表明,Cdc7是肿瘤 中一个重要的靶标[1, 2, 3]。2008年Vanotti E最先发现 PHA-767491是类似ATP分子构型的一类小分子 化合物,其具有最佳的分子构型,可以竞争性地 与Cdc7结合,抑制Cdc7结合ATP进而导致Cdc7 失去磷酸化能力[4]。Montagnoli[3]进一步研究发现 PHA-767491在肿瘤细胞中可以高效地抑制Cdc7和 CDK9的磷酸化能力,Cdc7和CDK9被抑制后,细 胞增殖被显著抑制,细胞凋亡率显著升高[3]。本课 题组先前的研究结果表明,PHA-767491对多种实 体瘤细胞表现出了极强的杀伤抑制能力[5]。
慢性髓系白血病细胞K562由于多个信号通 路过度激活,导致其具有极强的耐药性和抗凋亡 能力。本研究利用抗肿瘤新药PHA-767491处理 K562细胞,以期利用PHA-767491极强的抗肿瘤 能力,抑制K562细胞的增殖。本研究结果显示, PHA-767491可以显著抑制K562细胞的增殖,而且 这种抑制能力随着时间和浓度的增加而增强。进 一步研究PHA-767491抑制K562细胞的分子机制发 现,PHA-767491处理K562细胞后,Xiap和Mcl-1 蛋白的表达被显著下调,Xiap和Mcl-1是重要的抗 凋亡蛋白,其被下调后我们发现K562细胞凋亡途 径中的Caspase3剪切水平显著上升,细胞凋亡水 平显著增加。故PHA-767491对K562细胞较强的 抑制杀伤作用可能表现在以下两个方面:(1) PHA-767491抑制Cdc7后,K562细胞的细胞周期被 抑制,生长减缓[3]。(2)PHA-767491抑制CDK9 后,其下游的抗凋亡蛋白Xiap和Mcl-1被显著下 调,这也大大增加了K562细胞的凋亡水平。
本研究结果表明C d c 7 和CDK9 的抑制剂 PHA-767491可以显著抑制K562细胞的增殖,并可 以显著诱导K562细胞通过caspase途径凋亡。同时, 多个研究表明,Cdc7激酶和肿瘤的耐药性有很密切 的关系[2, 7],而我们先前的研究表明PHA-767491联合 其他药物具有很强的协同抑制肿瘤的能力[6]。上述 结果提示PHA-767491可以作为一个很有前景的候 选药物用于今后的白血病治疗。
| [1] | Hess GF, Drong RF, Weiland KL, et al. A human homolog ofthe yeast CDC7 gene is overexpressed in some tumors andtransformed cell lines[J]. Gene, 1998, 211(1): 133-40. |
| [2] | Li W, Tian XJ, Liu L, et al. huCdc7 kinase and relationship withtumor[J]. Sheng Wu Hua Xue Yu Sheng Wu Wu Li Jin Zhan,2009, 36(7): 810-6. [李伟, 田雪君, 刘立, 等. huCdc7激酶及其与肿瘤的关系[J].生物化学与生物物理进展, 2009, 36(7): 810-6 .] |
| [3] | Montagnoli A,Valsasina B, Croci V, et al. A Cdc7 kinase inhibitorrestricts initiation of DNA replication and has antitumoractivity[J]. Nat Chem Biol, 2008, 4(6): 357-65. |
| [4] | Vanotti E, Amici R, Bargiotti A, et al. Cdc7 kinase inhibitors:pyrrolopyridinones as potential antitumor agents. 1. Synthesisand structure-activity relationships[J]. J Med Chem, 2008, 51(3):487-501. |
| [5] | Li W, Zhang J, Hu XP, et al. PHA-767491 inhibited theproliferation of kinds of tumors cell[J]. Zhongguo Sheng Wu HuaXue Yu Fen Zi Sheng Wu Xue Bao, 2010, 26(5): 455-61.[李伟,张静, 胡徐旁, 等. PHA-767491抑制多种肿瘤细胞生长[J].中国生物化学与分子生物学报, 2010, 26(5): 455-61.] |
| [6] | Li W, Zhang J, Luo JJ, et al. Study of the anti-tumor efficacy byPHA-767491 combined with IL-24 in hepatocellular carcinomacells[J]. Zhejiang Li Gong Da Xue Xue Bao, 2010, 27(4): 641-4.[李伟, 张静, 骆菁菁, 等. PHA-767491联合IL-24基因对肝癌细胞的杀伤研究[J]. 浙江理工大学学报, 2010, 27(4): 641-4.] |
| [7] | Montagnoli A, Tenca P, Sola F, et al. Cdc7 inhibition reveals ap53-dependent replication checkpoint that is defective in cancercells[J]. Cancer Res, 2004, 64(19): 7110-6. |
| [8] | Natoni A, Murillo LS, Kliszczak AE, et al. Mechanisms of actionof a dual Cdc7/Cdk9 kinase inhibitor against quiescent andproliferating CLL cells[J].Mol Cancer Ther, 2011, 10(9): 1624-34. |
 2015, Vol. 42
2015, Vol. 42


