
文章信息
- 张荣,姜涛,龙炽慧,孙贝贝,鄢志雄,师海蓉. 2015.
- ZHANG Rong, JIANG Tao, LONG Chihui, SUN Beibei, YAN Zhixiong, SHI Hairong. 2015.
- 沉默I2PP2A基因对胃癌BGC-823细胞增殖和迁移能力的影响
- Effect of Down-regulated I2PP2A Expression on Proliferation and Migration of Gastric Carcinoma Cell Line BGC-823
- 肿瘤防治研究, 2015, 42(03): 233-237
- Cancer Research on Prevention and Treatment, 2015, 42(03): 233-237
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.03.005
-
文章历史
- 收稿日期:2014-03-20
- 修回日期:2014-11-18
2. 430056 武汉,江汉大学医学院病理学与病理生理学教研室
2. Department of Pathology and Pathophysiology, School of Medicine, Jianghan University, Wuhan 430056, China
蛋白磷酸酶2A抑制剂-2(inhibitor of protein phosphatase2 A-2,I2PP2A),又称SET(patient SE translocation)基因[1]、模板活化因子-1(template activating factor 1β,TAF1β)[2]等。 通过对不同 肿瘤组织进行I2PP2A cDNA表达分析,发现在子 宫、胃、结肠、直肠肿瘤组织,I2PP2A的表达是 相应正常组织的2倍或更高[3]。目前对于I2PP2A基因和蛋白表达、功能调控的机制研究尚不丰富。 为此,本研究进一步探讨沉默I2PP2A基因表达对 人胃癌细胞增殖和迁移能力的影响,并探讨其可 能的分子机制,为I2PP2A成为预防和治疗胃癌的 新靶点提供必要的实验依据,也为最终阐明胃癌 发生和发展机制奠定理论基础。 1 材料和方法 1.1 材料
靶向I2PP2A的shRNA表达载体为本实验室 保存,阴性对照(shRNA_con)经BLAST检测 证实与I2PP2A mRNA及其他基因编码序列无同 源性。shRNA序列:shRNA_con 正义5’-CACCGTTCTCCGAACGTGTCACGTCAAGAGATTACGTGACACGTTCGGAGAATTTTTTG- 3’; 反义5’-GATCCAAAAAATTCTCCGAAGCTG T C A C G TA AT C T C T T G A C G T G A C A C - GTTCGGAGAAC-3’ ;shRNA_I2PP2A正义 5’-CACCGCTCTAATGCCAAGTTATACATTCAAGAGATGTATAACTTGGCATTAGAGCTTTTTTG- 3’ 反义5’-GATCCAAAAAAGCTCTAATGCCAAGTTATACATCTCTTGAATGTATAACTTGGCATTAGAGC- 3’。胃癌细胞株MKN-28(高分化)、AGS (中分化)和BGC-823(低分化)和正常胃黏膜 上皮细胞GES-1购自美国ATCC公司;去内毒素质 粒大量提取试剂盒为德国Qiagen公司产品;质粒 转染试剂LipofectamineTM2000购自美国Invitrogen 公司;抗体I2PP2A、β-actin以及辣根过氧化物酶 标记的羊抗兔IgG购自美国Santa Cruz公司;抗体 cyclin D1购自美国CST公司;抗体MMP-9购自美 国PTG公司。 用于Western blot检测的增强化学发 光试剂ECL和BCA蛋白定量试剂盒购自美国Pierce 公司;PVDF转印膜购自美国Millipore公司;引物 合成由上海英骏生物技术有限公司完成;WST-1细 胞增殖及细胞毒性检测试剂盒购自武汉博士德生 物工程有限公司;Transwell小室(24孔,8 μm)购 自美国Corning公司。 1.2 方法 1.2.1 细胞转染
细胞传至6孔板,在对数生长期 进行转染,采用LipofectaminTM2000脂质体转染 试剂,按质粒: 转染试剂为1.6 μg∶5 μl的比例配 比转染,将shRNA_I2PP2A表达质粒瞬时转染入 BGC-823细胞,同时转染shRNA_con质粒为对照, 细胞转染24 h后置于荧光显微镜下观察,计算转 染效率。转染效率=(发出绿色荧光的细胞数/可 见光下的总细胞数)×100%,转染后细胞分为三 组: 未转染组(blank);转染对照shRNA_con组 (siRNA con)和转染shRNA_I2PP2A组(siRNA I2PP2A)。 1.2.2 Real-time RT-PCR
收集三组胃癌BGC-823 细胞,以TRIzol试剂提取细胞总RNA,紫外分 光光度计定量RNA,琼脂糖凝胶电泳验证RNA 完整性。以基因特异性引物进行PCR扩增,检 测结果用Δ ΔCt值判定,以GAPDH作为内参。 I2PP2A引物序列:上游引物为5’-CAGAAGAGGTCAGAATTGATCGC- 3’,下游引物为5’-TGGTTGACAAATGTTGTTACCCA- 3’,扩增片段长 度为62 bp。GAPDH引物序列: 上游引物为5’- CATGAGAAGTATGACAACAGCCT- 3’,下游引物为5’- AGTCCTTCCACGATACCAAAGT-3’,扩增片段长 度为113 bp。PCR扩增产物电泳结果显示PCR产物 大小正确,无杂带说明无非特异性扩增,实验重 复3次。 组间表达差异通过计算2-ΔΔCt予以表示。 1.2.3 蛋白质印迹分析
收集对数生长期的正常 胃黏膜上皮细胞GES-1和3株胃癌细胞MKN-28、 AGS和BGC-823,以及转染后的三组胃癌BGC-823 细胞,分别利用细胞裂解液提取细胞的总蛋白, 进行SDS-PAGE电泳,电泳后湿转至PVDF膜, 含5%脱脂奶粉的TBS-T(含0.05% Tween-20的 TBS)37℃封闭60 min,加1∶1 000稀释的抗I2PP2A 蛋白的多克隆抗体4℃孵育过夜。TBS-T漂洗5 min ×3次,加入1∶2 000稀释的辣根过氧化物酶标记 的羊抗兔IgG 37℃孵育45 min。TBS-T漂洗5 min ×3次,ECL化学发光试剂检测。图像应用Gel-Pro Analyzer软件进行灰度分析,目的蛋白表达的相对 强度=目的条带的灰度值/β-actin条带的灰度值。 1.2.4 细胞增殖实验
取96孔细胞培养板内对数 生长期的三组细胞,按照WST-1细胞增殖检测试剂 盒说明书进行,在全自动酶联免疫检测仪上测定 波长450 nm处吸光度值。细胞生长抑制率=(对照 组A450值-实验组A450值)/对照组A450值×100%。 1.2.5 细胞迁移实验
实验在Transwell小室中进 行,滤膜孔径为8 μm。 将三组BGC-823细胞分别 悬浮在含BSA的无血清培养液中并调整浓度至5× 104/ml,6孔板下室加入1 ml含FBS的培养液,细 胞悬液2 ml接种于Transwell小室,置于细胞培养 箱中培养72 h后取出小室。 用棉签擦去上室内的 细胞,预冷甲醇固定15~20 min。苏木精染色10 min。小室风干后放入孔中,倒置显微镜下取5个 视野,拍照计数。最后通过计算滤膜下层的细胞数来评估其迁移的细胞数目。 1.3 统计学方法
采用SPSS13.0统计软件进行方差分析、t检 验。P<0.05为差异有统计学意义。 2 结果 2.1 胃癌细胞中I2PP2A蛋白表达的检测
胃癌细胞株BGC-823、AGS和MKN-28中 I2PP2A蛋白表达水平均高于正常胃黏膜上皮细 胞GES-1,且差异具有统计学意义(P=0.000; 0.019;0.001)。此外,胃癌BGC-823细胞中 I2PP2A蛋白的表达水平高于MKN-28和AGS细胞, 差异有统计学意义(P=0.003;0.000),见图 1。

|
| A: Western blot; B: Quantitative analysis; *: P<0.05,compared with GES-1 cells; Δ: P<0.05,compared with BGC-823 cells 图 1 正常胃黏膜上皮细胞和胃癌细胞中I2PP2A蛋白的表达 Figure 1 Expression of I2PP2A protein in normal gastric mucosal epithelial cells and gastric carcinoma cells |
BGC-823细胞转染重组质粒24 h后,荧光显微 镜观察表达绿色荧光蛋白的细胞所占比例,见图 2。重组质粒24 h转染效率为70%以上。
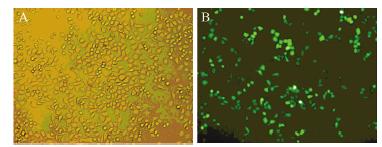
|
| A: normal view; B: fluorescence view 图 2 重组质粒转染BGC-823细胞后绿色荧光蛋白的表达 Figure 2 The expression of green fluorescent protein (GFP) in BGC-823 cells transfected with recombinant plasmids |
Real-time RT- PCR结果显示重组质粒 shRNA_I2PP2A对BGC-823细胞I2PP2A mRNA的表 达有显著的抑制效果,见图 3。

|
| * : P<0.01,compared with blank and siRNA con groups 图 3 Real-time RT-PCR检测I2PP2AmRNA的表达 Figure 3 I2PP2A mRNA expression detected by real-time RT-PCR |
Western blot结果显示重组质粒shRNA_I2PP2A 对BGC-823细胞I2PP2A mRNA的表达有显著的抑 制作用,见图 4。
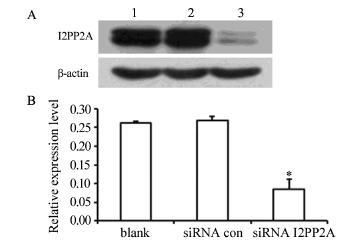
|
| A: Western blot; B: Quantitative analysis; 1: blank; 2: siRNA con; 3: siRNA I2PP2A; *: P<0.01,compared with blank and siRNA con groups 图 4 Western blot检测I2PP2A蛋白的表达 Figure 4 I2PP2A protein expression detected by Western blot |
siRNA con与blank两组间比较差异无统计学意 义(P=0.288),而siRNA I2PP2A与siRNA con、 blank组相比差异均有统计学意义(P=0.000; P=0.000),提示下调I2PP2A基因对BGC-823细胞 增殖具有明显抑制作用。应用上述公式计算细胞生 长抑制率,siRNA I2PP2A组约为57.6%,见表 1。
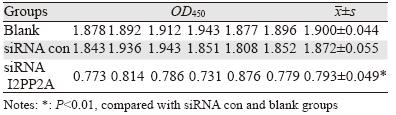 |
细胞迁移实验结果显示,与未转染组(细胞数 130±7.8)及对照siRNA con组(细胞数129±5.9) 相比,siRNA I2PP2A组中胃癌BGC-823细胞的穿膜数(62±6.6)下降(P=0.000;P=0.000),而未 转染组及对照siRNA con组之间细胞穿膜数差异无 统计学意义(P=0.894),见图 5。
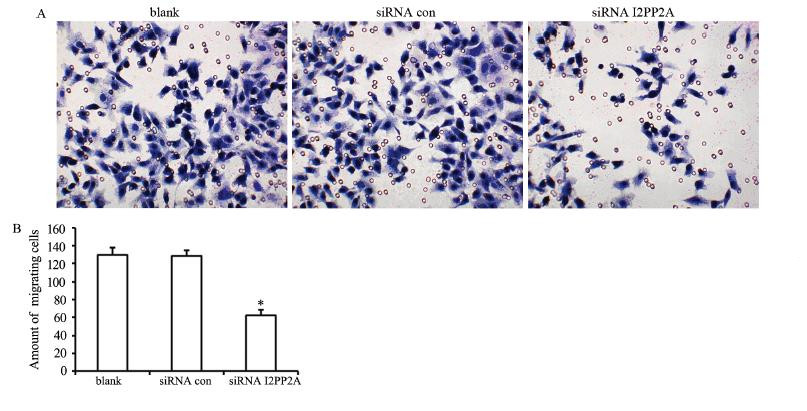
|
| A: transwell assay; B: counting statistics of penetrating cells; *: P<0.01, compared with blank and siRNA con groups 图 5 Transwell小室检测I2PP2A基因沉默对胃癌BGC-823细胞迁移能力的影响 Figure 5 Effect of I2PP2A gene silencing on migration of BGC-823 cells detected by transwell chamber |
转染后48h,siRNA I2PP2A组中cyclin D1和 MMP-9蛋白的表达均低于未转染组(blank)和对 照siRNA组(Cyclin: P=0.000;P=0.000;MMP-9: P=0.000;P=0.000),而未转染组和对照siRNA con 组之间cyclin D1和MMP-9蛋白的表达差异无统计 学意义(P=0.116;P=0.881),见图 6。
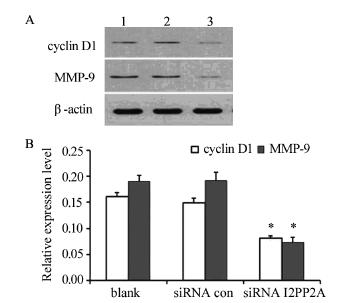
|
| A: Western blot; B: Quantitative analysis; 1: blank; 2: siRNA con; 3: siRNA I2PP2A; *: P<0.01,compared with blank and siRNA con groups 图 6 I2PP2A表达下调对BGC-823胃癌细胞中cyclin D1和MMP-9蛋白表达的影响 Figure 6 Effect of down-regulated I2PP2A expression on expression of cyclin D1 and MMP-9 proteins in gastric carcinoma cells BGC-823 |
I2PP2A与多种生物活动相关,如细胞周期调控[4]、 细胞凋亡[5, 6, 7]、迁移[8, 9]和DNA损伤修复[10]及氧化应 激[11]等多个生物过程,是重要的细胞因子。Cervoni 等[3]报道,在胃肿瘤组织,I2PP2A mRNA表达是相 应正常组织的2倍以上,因此下调在胃癌中过表达 的I2PP2A可作为一个潜在的肿瘤治疗靶点。
I2PP2A在人胃癌中的作用报道较少。本研 究结果显示,在RNA干扰技术特异性沉默I2PP2A 的表达后,胃癌细胞的增殖能力明显下降,这与 胰腺癌、人乳腺癌和头颈部鳞状细胞癌中的结果 一致[11, 12, 13],但是上述变化的具体分子机制尚不清 楚,因此我们进一步利用蛋白质印迹分析检测 细胞增殖相关蛋白cyclin D1表达的变化,结果发 现,I2PP2A表达下调能抑制cyclin D1蛋白的表 达,细胞周期循环由细胞周期蛋白cyclins严格控 制,cyclin D1控制着G1/S期,cyclin D1蛋白表达下 降,使细胞停滞在G1期,因此推测增殖能力的减 弱主要是由于细胞被阻滞在G1期。
基质金属蛋白酶(MMPs)在恶性肿瘤中过度表 达,已被证明有助于肿瘤的增殖、侵袭和转移[14], MMPs,MMP-9与肿瘤的转移密切相关,被认为 是促进胃癌侵袭和转移的重要因素[15, 16, 17]。本研究结果显示,下调I2PP2A的表达后,细胞迁移相关 蛋白MMP-9表达明显下降,细胞的迁移能力明显 下降,提示I2PP2A表达下调介导的迁移能力降低 可能与MMP-9蛋白表达的下降密切相关。然而, 最近Sobral等[11]在头颈部鳞状细胞癌研究中发现, 在HN12细胞中,过表达I2PP2A促进肿瘤生长的 同时限制细胞的迁移和侵袭,而敲除I2PP2A可上 调MMP-2和MMP-9的表达,与本研究的结果不一 致,这可能是由于组织、细胞类型的种属特异性 造成的。
综上所述,I2PP2A基因对增殖和迁移的调控可 能与cyclin D1和MMP-9蛋白表达密切相关,此发现 有助于我们进一步理解I2PP2A基因致胃癌作用的 具体机制,为开展以I2PP2A作为一个新的胃癌标 志物和以I2PP2A基因为靶点的胃癌基因治疗提供 实验依据,详细的机制有待于进一步实验研究。
| [1] | von Lindern M, van Baal S, Wiegant J, et al. Can, a putativeoncogene associated with myeloid leukemogenesis, may beactivated by fusion of its 3’ half to different genes: characterizationof the set gene[J]. Mol Cell Biol, 1992, 12(8): 3346-55. |
| [2] | Nagata K, Kawase H, Handa H, et al. Replication factorencoded by a putative oncogene, set, associated with myeloidleukemogenesis[J]. Proc Natl Acad Sci U S A, 1995, 92(10):4279-83. |
| [3] | Cervoni N, Detich N, Seo SB, et al. The oncoprotein Set/TAF-1beta, an inhibitor of histone acetyltransferase, inhibits activedemethylation of DNA, integrating DNA methylation andtranscriptional silencing[J]. J Biol Chem, 2002, 277(28):25026-31. |
| [4] | Canela N, Rodriguez-Vilarrupla A, Estanyol JM, et al. The SETprotein regulates G2/M transition by modulating cyclin B-cyclindependentkinase 1 activity[J]. J Biol Chem, 2003, 278(2):1158-64. |
| [5] | Madeira A, Pommet JM, Prochiantz A, et al. SET protein(TAF1beta, I2PP2A) is involved in neuronal apoptosis induced byan amyloid precursor protein cytoplasmic subdomain[J]. FASEB J,2005, 19(13): 1905-7. |
| [6] | Christensen DJ, Chen Y, Oddo J, et al. SET oncoproteinoverexpression in B-cell chronic lymphocytic leukemia and non-Hodgkin lymphoma: a predictor of aggressive disease and a newtreatment target[J]. Blood, 2011, 118(15): 4150-8. |
| [7] | Saddoughi SA, Gencer S, Peterson YK, et al. Sphingosine analoguedrug FTY720 targets I2PP2A/SET and mediates lung tumoursuppression via activation of PP2A-RIPK1-dependent necroptosis[J]. EMBO Mol Med, 2013, 5(1): 105-21. |
| [8] | Ten Klooster JP, Leeuwen lv, Scheres N, et al. Rac1-induced cellmigration requires membrane recruitment of the nuclear oncogeneSET[J]. EMBO J, 2007, 26(2): 336-45. |
| [9] | Lam BD, Anthony EC, Hordijk PL. Cytoplasmic targeting of theproto-oncogene SET promotes cell spreading and migration[J].FEBS Lett, 2013, 587(2): 111-9. |
| [10] | Almeida LO, Goto RN, Pestana CR, et al. SET overexpressiondecreases cell detoxification efficiency: ALDH2 and GSTP1 aredownregulated, DDR is impaired and DNA damage accumulates[J]. FEBS J, 2012, 279(24): 4615-28. |
| [11] | Sobral LM, Sousa LO, Coletta RD, et al. Stable SET knockdownin head and neck squamous cell carcinoma promotes cell invasionand the mesenchymal-like phenotype in vitro, as well as necrosis,cisplatin sensitivity and lymph node metastasis in xenograft tumormodels[J]. Mol Cancer, 2014, 13: 32. |
| [12] | Farrell AS, Allen-Petersen B, Daniel CJ, et al. Targeting inhibitorsof the tumor suppressor PP2A for the treatment of pancreaticcancer[J]. Mol Cancer Res, 2014, 12(6): 924-39. |
| [13] | Loganathan J, Jiang J, Smith A, et al. The mushroom Ganodermalucidum suppresses breast-to-lung cancer metastasis throughthe inhibition of pro-invasive genes[J]. Int J Oncol, 2014, 44(6):2009-15. |
| [14] | Egeblad M, Werb Z. New functions for the matrix metalloproteinasesin cancer progression[J]. Nat Rev Cancer, 2002,2(3): 161-74. |
| [15] | Kabashima A, Yao T, Sugimachi K, et al. Relationship betweenbiologic behavior and phenotypic expression in intramucosalgastric carcinomas[J]. Hum Pathol, 2002, 33(1): 80-6. |
| [16] | Cai H, Kong ZR, Chen HM. Matrix metalloproteinase-2 andangiogenesis in gastric cancer[J]. Ai Zheng, 2002, 21(1): 25-8. |
| [17] | Takahashi Y, Kitadai Y, Ellis LM, et al. Multiparametric in situmRNA hybridization analysis of gastric biopsies predicts lymphnode metastasis in patients with gastric carcinoma[J]. Jpn J CancerRes, 2002, 93(11): 1258-65. |
 2015, Vol. 42
2015, Vol. 42




