
文章信息
- 郭隽馥,王艳杰,苗兰英,丛培玮. 2015.
- GUO Junfu, WANG Yanjie, MIAO Lanying, CONG Peiwei. 2015.
- 沉默Toll样受体4表达对肺腺癌A549细胞凋亡及细胞周期的影响
- Effect of Silencing Toll-like Receptor 4 Expression on Cell Cycle and Apoptosis of Human Lung Adenocarcinoma Cells A549
- 肿瘤防治研究, 2015, 42(03): 225-228
- Cancer Research on Prevention and Treatment, 2015, 42(03): 225-228
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.03.003
-
文章历史
- 收稿日期:2014-09-03
- 修回日期:2014-11-11
2. 110847 沈阳, 辽宁中医药大学基础医学院
2. College of Basic Medicine, Liaoning University of Traditional Chinese Medicine, Shenyang 110847, China
随着对肿瘤发生机制研究的不断深入,研究人 员发现慢性炎性反应在促进肿瘤的发生和进展中发 挥着重要的作用。许多肿瘤均已被证实起源于一系 列慢性炎性反应[1]。Toll样受体(Toll-like receptors, TLRs)可介导对细菌及真菌感染的免疫[2],能够通 过对病原相关分子模式(PAMPs)进行模式识别, 最终激活NF-κB,进而参与肿瘤形成、凋亡抵抗及 化疗抵抗等过程。TLR4是人类发现的第一个TLRs 家族蛋白,其介导炎性反应,在多种肿瘤细胞系和 组织中表达上调促进肿瘤的发生和进展,如肝癌[3]、 前列腺癌[4]、卵巢癌[5]、胃癌[6]和肺癌[7]等。因此本研究以TLR4为靶标,化学合成靶向TLR4的小干扰 RNA(small interfering RNA,siRNA),沉默人肺 腺癌A549细胞中TLR4的表达,进一步检测TLR4沉 默对A549细胞凋亡及细胞周期的影响,以期为肺癌 的基因治疗提供新的靶点。 1 材料与方法 1.1 细胞系和试剂
人肺腺癌细胞系A549购于中国科学院典型 培养物保藏委员会。DMEM培养液、胎牛血清、 双抗、Trizol试剂和Lipofectamine2000均购于美 国Invitrogen公司;Real-time PCR试剂盒购于大 连TaKaRa公司;细胞培养瓶和培养板购于美国 Costar公司;Annexin V-FITC细胞凋亡检测试剂盒 和细胞周期试剂盒购自江苏碧云天公司;小鼠抗 人TLR4单克隆抗体(ab22048)购于美国ABcam 公司;FITC标记的兔抗小鼠Ⅱ抗购于北京鼎国昌 盛生物技术有限公司。 1.2 细胞培养
A549细胞培养于含10%胎牛血清、100 u/ml 青霉素和100 μg/ml链霉素的DMEM培养液中, 37℃、5%CO2饱和湿度培养,常规消化传代,选 取处于指数生长期细胞进行实验。 1.3 TLR4-siRNA的设计合成
siRNA目的片段的选取及合成:根据GenBank 数据库提供的人TLR4全长基因设计RNAi的靶 区,Blast查询验证,排除与其他基因同源。设 计一条TLR4-siRNA序列:sense 5’-GGGCUUA GAACAACUAGAATT-3’,antisense 5’-UUCUA GUUGUUCUAAGCCCTT-3’;另外设计一条阴 性对照(negative control,NC)序列:sense 5’- UUCUCCGAACGUGUCACGUTT-3’,antisense 5’-ACGUGACACGUUCGGAGAATT-3’,以上核酸 分子由上海吉玛制药有限公司设计合成。 1.4 实验分组及细胞转染
实验分为:NC组和TLR4-siRNA组。(1) 转染前一天,取生长状态良好的指数生长期A549 细胞,胰酶消化,将其接种到6孔细胞培养板中 培养。(2)12~24 h后(融合度:50%~70%), 弃完全培养液,PBS洗一次,加入1500 μl无抗 DMEM培养液培养。(3)5 μl Lipofectamine 2000与250 μl双无DMEM培养液混匀后,室温孵 育5 min。(4)NC组取5 μl NC-siRNA,TLR4- siRNA组取5 μl TLR4-siRNA与250 μl双无DMEM 培养液混匀后,室温孵育5 min。(5)将以上两 步(3)(4)所得溶液混匀,室温放置20 min, 即siRNA转染液。(6)将siRNA转染液加入已换 成无抗DMEM培养液的6孔板中,混匀,继续培养 4~6 h后,更换为无抗DMEM培养液培养。(7)24 h 后更换为含10% FBS的完全DMEM培养液。 1.5 Real-time PCR检测TLR4 mRNA的表达
细胞转染72 h后收集实验组和对照组细胞, 按Trizol试剂说明书的方法提取细胞总RNA。采用 特异性下游引物法将其反转录成cDNA。反转录成 cDNA后,以GAPDH为内参,Real-tine PCR检测 干扰效率,反应条件为95℃预变性30 s、95℃变 性5 s、60℃退火及延34 s、进行45个循环,每个 样品设置3个复孔,在ABI 7500实时定量PCR系统 上进行,实验重复3次。TLR4引物序列[8]:上游为 5’-CGAGGAAGAGAAGACACCAGT-3’,下游为 5’-CATCATCCTCACTGCTTCTGT-3’。GAPDH序 列[8]:上游为5’-GGATTTGGTCGTATTGGG-3’, 下游为5’-GGAAGATGGTGATGGGATT- 3’。 1.6 流式细胞仪检测细胞表面TLR4蛋白表达
(1)细胞转染72 h后,常规胰酶消化各组细 胞,收集细胞;(2)PBS轻洗细胞2次;(3)加入 小鼠抗人TLR4抗体(1∶250)4℃摇床孵育2 h; (4)PBS轻洗细胞1次;(5)加入FITC标记兔抗 小鼠Ⅱ抗(1:1000)4℃摇床避光孵育1 h;(6) PBS轻洗细胞1次;(7)送检分析,实验重复3次。 1.7 流式细胞仪检测细胞凋亡
(1)细胞转染72 h后,常规胰酶消化各组细 胞,收集细胞;(2)PBS轻洗细胞1次;(3)加 入195 μl Binding Buffer重悬细胞;(4)细胞悬液 中加入5 μl Annexin V-FITC试剂,混匀后4℃避光 孵育20 min;(5)1 000 g离心5 min,小心弃上 清液;(6)加入190 μl Binding Buffer重悬细胞; (7)细胞悬液中加入10 μl PI轻轻混匀,4℃避光 孵育5 min,1 h内送检分析,实验重复3次。 1.8 流式细胞仪检测细胞周期
(1)细胞转染72 h后,常规胰酶消化各组细 胞,收集细胞;(2)PBS轻洗细胞1次;(3)加入1 ml冰浴预冷的70%乙醇,轻轻混匀,4℃固定12~24 h;(4)1000 g离心5 min,小心弃上清液;(5) PBS轻洗细胞1次;(6)加入0.5 ml PI染色液,缓慢 并充分重悬细胞沉淀,37℃避光温浴30 min;(7) 送检分析,实验重复3次。 1.9 统计学方法
采用SPSS16. 0软件进行独立样本t检验,数据用 (x ±s)表示,P<0.05或P<0.01为差异有统计学意义。 2 结果 2.1 TLR4-siRNA下调人肺腺癌A549细胞中TLR4
mRNA和蛋白的表达 Real-time PCR结果显示,转染72 h后,TLR4- siRNA组与NC组相比TLR4 mRNA水平明显下降 (P=0.002),干扰效率达到了70%,见图 1。同时 采用流式细胞仪分析A549细胞表面TLR4蛋白的表 达情况发现,转染72 h后,TLR4-siRNA组检测到 的TLR4蛋白的表达率只有(12.17 ± 1.36)%明显 低于NC组的(27.33 ± 7.86)%(P=0.03),见图 2。可见,本实验设计合成的TLR4-siRNA能够有 效抑制人肺腺癌A549细胞中TLR4 mRNA和蛋白的 表达。
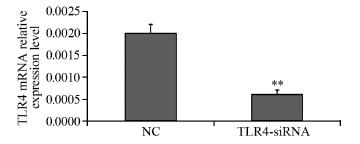
|
| NC: negative control; TLR4:Toll-like receptors 4; **: P<0.01, compared with NC group 图 1 转染72h后A549细胞中TLR4 mRNA的相对表达水平 Figure 1 Expression level of TLR4 mRNA in A549 cells 72h after transfection |
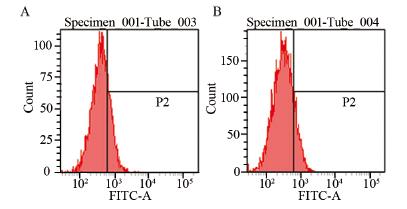
|
| A: NC group; B: TLR4-siRNA group 图 2 转染72h后A549细胞表面TLR4蛋白的表达情况 Figure 2 Expression of TLR4 protein on A549 cells 72h after transfection |
流式细胞仪检测结果显示,转染72 h后,与 NC组相比TLR4-siRNA组A549细胞的凋亡率明 显增加(P=0.002),由(1.73 ± 0.32)%上升至 (7.40 ± 0.75)%,见图 3。可见TLR4表达下调能 够促进人肺腺癌A549细胞的凋亡。
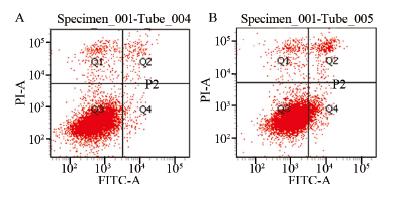
|
| A: NC group; B: TLR4-siRNA group 图 3 转染72h后A549细胞凋亡情况 Figure 3 Apoptosis of A549 cells 72h after transfection |
流式细胞仪检测结果显示,转染72 h 后, 与NC组相比TLR4-siRNA组G0/G1期细胞增多, 分别为(48.21 ± 1.15)%与(66.26 ± 2.45)%, (P=0.01),S期细胞明显减少分别为(34.25 ± 1.46)%与(22.63 ± 3.39)%,(P=0.005),而G2/M 期细胞两组间比较,差异无统计学意义,见图 4。
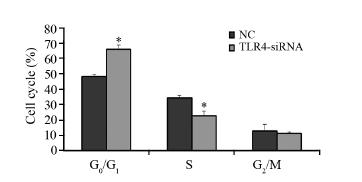
|
| *: P<0.05,compared with NC group 图 4 转染72h后A549细胞细胞周期分布情况 Figure 4 Cell cycle distribution of A549 cells 72h after transfection |
肺癌是源于支气管黏膜或腺体的恶性肿瘤,发 病率及死亡率高,是世界范围内恶性肿瘤的主要 死因[9]。研究发现,Toll样受体在多种肿瘤中表达 上调,许多实验证据也表明肿瘤的发展过程可能 与TLR信号转导途径的激活有关,在肿瘤的治疗过 程中值得注意[10, 11]。赵卉等[12]研究了40例肺癌患者 (其中鳞癌21例、腺癌17例、大细胞癌2例)和40 例癌旁组织中TLR4和TLR9的表达情况,发现肺癌 组织中TLR4和TLR9在mRNA和蛋白水平都有强阳 性表达,且提出TLR4的阳性表达和肺癌的恶性程 度呈正相关。Fu等[13]采用免疫组织化学方法检测53 例非小细胞癌患者和15例正常肺组织中TLR4蛋白 的表达情况,发现与正常肺组织相比较,TLR4蛋 白的表达水平在非小细胞癌患者的肺组织中显著上 调,TLR4表达与肿瘤分化程度密切相关。
siRNA是近年来新兴的一种在转录后水平高 效特异的沉默基因表达的有效工具,进入哺乳动 物细胞后能够对同源的mRNA产生特异性降解, 作为后基因组时代的一种下调基因表达工具,已广泛应用于基因功能的研究[8]。在肿瘤的研究方 面,siRNA可明显抑制多种癌基因的表达,使癌 细胞生长受到抑制,并诱导肿瘤细胞凋亡。刘秀 娟等[14]设计合成了针对TLR4 mRNA的siRNA,发 现其可以有效地抑制缺氧复氧诱导的肾小管上皮 细胞的凋亡和炎性反应。Yang等[15]也选用siRNA 沉默MDA-MB-231细胞中TLR4的表达后细胞因子 IL-6和IL-8的水平也显著下降,同时抑制了细胞的 增殖能力。Hua等[16]采用TLR4-siRNA转染高转移 的人前列腺癌PC3细胞,发现TLR4-siRNA能够有 效抑制PC3细胞的迁移和侵袭能力并且促进细胞 的凋亡,裸鼠成瘤实验也证明TLR4-siRNA能够有 效抑制肿瘤的生长。本研究结果显示TLR4-siRNA 组TLR4的mRNA及蛋白表达均明显低于NC组, 证实TLR4-siRNA转染可以从转录及翻译水平有效 抑制A549细胞中TLR4的表达。此外,实验结果还 显示,TLR4-siRNA转染A549细胞后,与NC组相 比,不仅细胞凋亡显著增加,而且出现细胞周期 G0/G1期停滞,S期细胞比例明显减少,表明RNA 干扰TLR4表达使A549细胞凋亡增加,且细胞分裂 速度减慢,提示TLR4参与人肺腺癌A549细胞周期 的调控,并与细胞的凋亡有关。肿瘤的恶性增长 与细胞的增殖密切相关,而细胞停滞在G0/G1期分 裂速度减慢及凋亡增加将明显降低肿瘤的生长速 度。
综上所述,TLR4-siRNA能有效沉默A549细胞 中TLR4的表达,促进细胞的凋亡并改变细胞周期 的分布从而影响细胞增殖等生物学行为,其可能 的机制仍需要我们进一步探讨研究,以便为肺癌 的治疗提供新的思路。
| [1] | Zheng LY, Zhang M, Li WP. Tumorigenesis vis-a-vis Toll-likereceptors[J]. Zhongguo Shen Jing Zhong Liu Za Zhi, 2012,10(4):286-90.[郑燎源, 张猛, 李维平. TOLL样受体与肿瘤发病机制相关性的研究进展[J].中国神经肿瘤杂志, 2012, 10(4):286-90.] |
| [2] | Hashimoto C, Hudson KL, Anderson KV. The Toll gene ofDrosophila, required for dorsal-ventral embryonic polarity,appears to encode a transmembrane protein[J]. Cell, 1988, 52(2):269-79. |
| [3] | Dapito DH, Mencin A, Gwak GY, et al. Promotion ofhepatocellular carcinoma by the intestinal microbiota andTLR4[J]. Cancer Cell, 2012, 21(4): 504-16. |
| [4] | Kundu SD, Lee C, Billips BK, et al. The toll-like receptorpathway: a novel mechanism of infection-induced carcinogenesisof prostate epithelial cells[J]. Prostate, 2008, 68(2): 223-9. |
| [5] | Kelly MG, Alvero AB, Chen R, et al. TLR-4 signaling promotestumor growth and paclitaxel chemoresistance in ovarian cancer[J].Cancer Res, 2006, 66(7): 3859-68. |
| [6] | Yuan X, Zhou Y , Wang W, et al. Activation of TLR4 signalingpromotes gastric cancer progression by inducing mitochondrialROS production[J]. Cell Death Dis, 2013, 4: e794. |
| [7] | Xu X, Zhu H, Wang T, et al. Exogenous high mobility groupbox 1 inhibits apoptosis and promotes the proliferation of lewiscells via RAGE/TLR4-dependent signal pathways[J]. Scand JImmunol, 2014, 79(6): 386-94. |
| [8] | McCaffrey AP, Meuse L, Pham TT, et al. RNA interference inadult mice[J]. Nature, 2002, 418(6893): 38-9. |
| [9] | Tsai JR, Liu PL, Chen YH, et al. Ginkgo biloba extract decreasesnon-small cell lung cancer cell migration by downregulatingmetastasis-associated factor heat-shock protein 27[J]. PLoS One,2014, 9(3): e91331. |
| [10] | Yang H, Zhou H, Feng P, et al. Reduced expression of Toll-likereceptor 4 inhibits human breast cancer cells proliferation andinflammatory cytokines secretion[J]. J Exp Clin Cancer Res,2010, 29: 92. |
| [11] | Cherfils-Vicini J, Platonova S, Gillard M, et al. Triggering ofTLR7 and TLR8 expressed by human lung cancer cells inducescell survival and chemoresistance[J]. J Clin Invest, 2010, 120(4):1285-97. |
| [12] | Zhao H, He FL, Fang M, et al. High level of Toll-like receptorexpressions in the oncogenesis and development of lung cancer[J].Shi Yong Yi Xue Za Zhi, 2009, 25(9): 1392-5.[赵卉, 何凤莲, 方明, 等. 高表达的Toll样受体在肺癌发生发展中的初步探讨[J].实用医学杂志, 2009, 25(9): 1392-5.] |
| [13] | Fu HY, Li C, Yang W, et al. FOXP3 and TLR4 protein expressionare correlated in non-small cell lung cancer: implications fortumor progression and escape[J]. Acta Histochem, 2013, 115(2):151-7. |
| [14] | Liu XJ, Huang GM, Ding ZR, et al. Inhibitory effects of specialsiRNA targeting TLR4 gene on the apoptosis of renal proximaltubule epithelial cells induced by hypoxia-reoxygenation[J].Zhonghua Lin Chuang Yi Shi Za Zhi, 2011, 5(22): 6648-52.[刘秀娟, 黄国明, 丁仲如, 等. TLR4基因小干扰RNA对缺氧复氧诱导肾小管上皮细胞凋亡的影响[J].中华临床医师杂志, 2011,5(22): 6648-52.] |
| [15] | Yang H, Zhou H, Feng P, et al, Reduced expression of Toll-likereceptor 4 inhibits human breast cancer cells proliferation andinflammatory cytokines secretion[J]. J Exp Clin Cancer Res,2010, 29: 92. |
| [16] | Hua D, Liu MY, Cheng ZD, et al, Small interfering RNA-directedtargeting of Toll-like receptor 4 inhibits human prostate cancercell invasion, survival, and tumorigenicity[J]. Mol Immunol,2009, 46(15): 2876-84. |
 2015, Vol. 42
2015, Vol. 42




