文章信息
- 李子煌,李先明,杨东,徐钢,周亚燕,吴事海,李壮玲. 2015.
- LI Zihuang, LI Xianming, YANG Dong, XU Gang, ZHOU Yayan, WU Shihai, LI Zhuangling. 2015.
- 替莫唑胺联合放疗治疗高级别脑胶质瘤的临床分析
- Clinical Analysis of Temozolomide Combined with Radiotherapy on High-grade Glioma
- 肿瘤防治研究, 2015, 42(02): 185-189
- Cancer Research on Prevention and Treatment, 2015, 42(02): 185-189
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.02.019
-
文章历史
- 收稿日期:2014-10-14
- 修回日期:2014-12-19
高级别胶质瘤(high-grade glioma,HGG)包括WHO分级Ⅲ级的间变性少突胶质瘤(anaplastic oligodendrogliomas,AO)、间变性少突星形细胞瘤(anaplastic oligoastrocytomas,AOA)、间变性星形细胞瘤(anaplastic astrocytomas,AA)和Ⅳ级的多形性胶质母细胞瘤(g lio b las to ma multiforme,GBM),其中以AA和GBM最为常见,占HGG的80%以上[1]。HGG具有高侵袭性的生物学行为,单纯手术后复发率较高。术后放化疗的应用可明显改善生存,但成人GBM和AA的1年及5年生存率仅分别为35.7%和60.1%及4.7%和25.9%[2]。近年来多个临床试验证实采用替莫唑胺(temozolomide,TMZ)同步联合放疗,后续6周期TMZ辅助化疗的治疗模式可明显改善HGG患者的生存[3,4,5,6,7,8,9,10]。本研究回顾性分析深圳市人民医院肿瘤放疗科采用TMZ联合放疗治疗50例初诊HGG患者的临床资料,观察其疗效及安全性,并分析影响患者预后的因素。1 资料与方法1.1 一般临床资料
收集2008年10月—2012年12月深圳市人民医院肿瘤放疗科采用TMZ联合放疗治疗的HGG患者50例,全组病例均在手术后获得病理诊断。男、女各25例,年龄20.5~73.8岁(中位年龄43.5岁),KPS评分40~90分(中位评分70分),其他相关资料,见表 1。
全组患者中手术完全切除35例,近全和大部分切除15例;手术至开始放疗的间隔时间为16~67天(中位时间32.5天)。放疗前均采用热解塑料面罩进行体位固定,采用直线加速器6~8 MV X线照射;11例患者采用三维适形放疗(3DCRT),39例采用调强放疗(IMRT)技术。大体肿瘤体积(GTV)的勾画参照患者术前及术后MRI片上显示的病变范围在CT模拟定位扫描图像上勾画完成;临床靶体积1(CTV1)范围为术前及术后MRI T1W增强区域+FLAIR/T2W异常信号区域外扩2 cm,放疗剂量为50 Gy/25次;缩野后临床靶体积2(CTV2)的范围为术前及术后MRI T1W增强区域外扩2 cm,推量至60 Gy/30次。1.3 化疗方法
放疗期间同步口服T MZ,剂量为7 5 m g /(m2·d);放疗结束4周后开始行TMZ辅助化疗,方案为(150~200)mg/(m2·d),连续服用5天,28天为1个周期。辅助化疗周期数为0~28周期(中位周期数6个),持续口服TMZ至肿瘤进展或患者无法耐受为止。1.4 随访情况
自患者手术之日起,随访至患者疾病进展、死亡、失访或截止日期,随访的截止时间为2013年12月31日。全组随访时间为 6.6~57.5月(中位时间为21.4月),1例失访,随访率为98%。失访患者按最后一次随访时间计算生存时间。随访期间确诊为肿瘤进展或复发的依据为患者出现神经系统症状,并经头颅增强MRI扫描或再次手术后病理证实。1.5 评价指标
治疗期间及时评估患者的不良反应,化疗的不良反应采用NCI-CTC4.0进行评估。以总生存率(overall survival,OS)及无进展生存率(progression-free survival,PFS)作为患者生存观察指标。总生存时间定义为自手术之日起至患者死亡或最后一次随访的时间间隔;无进展生存时间定义为自手术之日至患者出现颅内病灶进展或复发时间间隔。1.6 统计学方法
采用SPSS20.0软件进行统计分析,KaplanMeier法计算生存率,Log rank法对生存率进行显著性检验和单因素预后分析,Cox法进行多因素分析。P<0.05为差异有统计学意义。2 结果 2.1 治疗效果
5 0例患者中,死亡2 2例,死亡时间为术后6.6~48.0月(中位时间18.4月),均死于颅内病灶进展出现的脑疝。全组出现肿瘤局部进展或复发28例(56%),发生时间为4.0~48.5月(中位时间12.2月),28例中行再次手术治疗8例,手术+TMZ治疗4例,手术+γ刀治疗1例,单纯γ刀治疗1例,单纯TMZ治疗4例,仅对症支持治疗10例。现生存患者28例,其中6例出现局部进展或复发,行相应治疗后病情稳定。全组1、2和3年OS和PFS分别为85.8%和71.8%、54.9%和44.2%及51.2 %和44.2 %,见图 1~2。其中Ⅲ级和Ⅳ级脑胶质瘤的中位生存时间分别为48.0和22.0月,2年及3年OS分别为82.6%和29.8%、75.1%和29.8%。
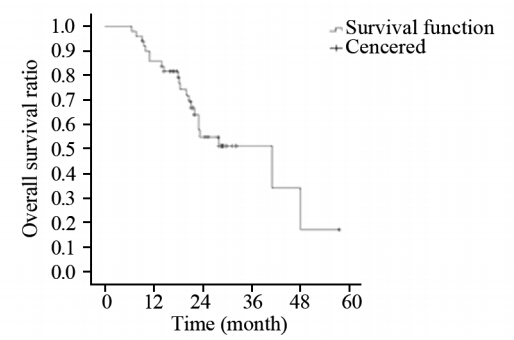 |
| 图 1 50例HGG患者总生存率曲线图 Figure 1 Overall survival curves of 50 HGG patients |
 |
| 图 2 50例HGG患者无进展生存率曲线图 Figure 2 Progression-free survival curves of 50 HGG patients |
对可能影响患者预后的因素包括性别、年龄、KPS评分、手术切除程度、病理分级、手术至放疗开始间隔时间、放疗技术及TMZ辅助化疗周期数等临床及病理特征进行单因素分析,结果显示KPS评分、病理分级和TMZ辅助化疗周期数对OS的影响有显著性意义;年龄、手术切除程度、病理分级和TMZ辅助化疗周期数对PFS的影响有显著性意义,见表 2。
将单因素分析中有意义的因素纳入多因素分析,结果显示KPS评分、病理分级和辅助化疗周期数是影响OS的独立预后因素;手术切除程度、病理分级和辅助化疗周期数是影响PFS的独立预后因素,见表 3。
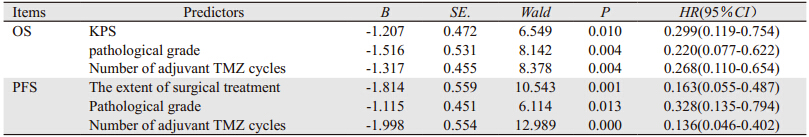 |
全组患者均完成同步放化疗方案。16例患者辅助TMZ化疗<6周期,其中5例患者因治疗期间出院进展或复发未完成预定周期数,11例患者因无法耐受严重不良反应而停止化疗。服用TMZ期间的不良反应主要为血液学及胃肠道等不良反应,见表 4。本组患者中未观察到肝、肾及心脏的相关毒性。
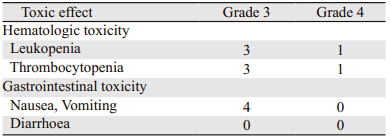 |
HGG呈浸润性侵袭性生长,手术不易完全切除,术后易出现局部复发,因此术后需要配合放化疗以提高疗效[1]。Stupp等方案证实TMZ联合同步放疗后继以6周期TMZ辅助化疗可延长GBM生存,中位生存时间由术后单纯放疗的12.1月延长到14.6月,2年OS由10.4%提高到26.5%[3]。5年OS由1.9%提高到9.8%[4]。 日本Oike等[5]近期回顾性分析结果显示TMZ联合放疗组和对照组的中位生存时间分别为15.8和12月;2年OS分别为27.7%和14.6%,结果有统计学差异。本组26例GBM患者的中位生存时间为22月,2年OS为29.8%,疗效稍好于相关文献报道的疗效,这或许与本组患者例数较少及随访时间较短有关,此外本组患者完成6周期辅助化疗比例也较Stupp[3,4](47.1%)和Oike等[5](57.7%)研究患者高。
Ⅲ级胶质瘤发病率相对较低,尽管目前证实TMZ联合放疗有生存获益的临床证据尚不足,大多数神经肿瘤专家仍推荐采用与GBM同样的治疗模式[6,7,8]。意大利肿瘤放疗协会的一项多中心研究对来自16家治疗中心共295例新诊断AA患者进行回顾性分析[9],其中2005—2007年间166例患者采用TMZ同步放疗+序贯TMZ治疗模式,与2002—2005年间采用术后单纯放疗的患者进行历史对照研究,结果显示全组中位生存时间为20.6月,1年及4年OS分别为70.2%和28.6%,多因素分析显示加用TMZ并非影响OS的独立预后因素。笔者也认识到该研究数据来自多个中心,病理结果的判定来源于多个神经病理学家,某些病理本为GBM而被低估,因而对研究的结论可能有一定的影响。国内Zhang等[10]一项Meta分析证实了Stupp方案对AA的生存获益,并提到两项应用TMZ治疗新诊断AA的临床试验——RTOG-9813和EORTC-26053试验正在进行,或许能够证实TMZ同步放疗+序贯TMZ化疗治疗模式对AA的生存益处。本组24例Ⅲ级脑胶质瘤的中位生存时间为48月,2年生存率为82.6%,疗效较部分文献报道的稍好,这是否与本组病例数较少、随访较短以及包含有其他预后较好的病理类型如AO、AOA和混合型胶质瘤有关,有待进一步观察证实。
目前较多的研究显示患者年龄、KPS评分、肿瘤病理分级、基因表达状态、手术切除程度、手术至放疗开始间隔时间、TMZ联合放疗模式及长周期TMZ治疗模式是影响HGG生存的独立预后因素[5,9,11]。Gutenberg等[11]发现在GBM中,年龄小于65岁者PFS和OS均更高。本研究中未发现年龄因素的预后意义,可能与研究对象包含有Ⅲ级和Ⅳ级脑胶质瘤患者有关,此外年龄组的界定(50岁)也有可能带来一定的偏倚。本研究发现KPS评分、病理分级和手术切除程度均对患者预后有显著影响,与大多数研究结论相似,但手术切除程度仅是PFS的独立预后因素,可能与TMZ治疗因素抵消了手术切除程度对OS的影响有关。Valduvieco等[12]对GBM全切术后至放疗开始间隔时间对生存的影响进行分析,结果显示6周内开始放疗是影响生存的独立预后因素,超过6周开始放疗者预后较差。本研究未发现术后至放疗间隔时间对患者预后的影响,这可能与本研究以30天为时间间隔标准,且本组患者中位间隔时间未超过6周有关。国内Chen等[13]研究显示采用3DCRT或IMRT治疗HGG仅在剂量分布方面有差异,但在疗效及神经毒性方面并无显著性差异。与上述研究结果一致,本研究也未发现放疗技术对患者预后的影响。
HGG预后较差,治疗后肿瘤进展或复发的发生率较高,而目前尚缺乏疗效较好的二线化疗药物,因此较多学者主张延长TMZ辅助化疗的周期数,以期改善生存。Roldán Urgoiti[14]和Seiz等[15]回顾性分析发现采用6周期TMZ辅助化疗的GBM患者,其OS和PFS明显低于辅助化疗>6周期的患者。本研究通过分析发现<6周期和≥6周期两组患者的OS和PFS有显著性差异,中位生存时间分别为21.2和41月,多因素分析提示辅助化疗周期数是影响OS和PFS的重要预后因素。此外,由于本组患者出现3~4级不良反应比例(24%)较Stupp等[3,4]研究结果(6.7%)高,提示亚裔患者可能耐受性较差,这也影响了用药>6周期患者比例。
总之,TMZ联合放疗治疗初诊HGG疗效肯定,安全性较好。本研究显示KPS评分、手术方式、病理分级和辅助化疗周期数是影响HGG患者预后的重要预后因素。为确切评估TMZ联合放疗在HGG治疗中的作用,尚需积累更多的病例资料,进行较长时间的随访观察并分层分析研究。
| [1] | Omuro A, DeAngelis LM. Glioblastoma and other malignant gliomas, a clinical review[J]. JAMA, 2013, 310(17): 1842-50. |
| [2] | Dolecek TA, Propp JM, Stroup NE, et al. CBTRUS statistical report: primary brain and central nervous system tumors diagnosed in the United States in 2005-2009[J]. Neuro Oncol, 2012, 14 suppl 5: v1-49. |
| [3] | Stupp R, Mason WP, van den Bent MJ, et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma[J]. N Engl J Med, 2005, 352(10): 987-96. |
| [4] | Stupp R, Hegi ME, Mason WP, et al. Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase Ⅲ study: 5-year analysis of the EORTC-NCIC trial[J]. Lancet Oncol, 2009, 10(5): 459-66. |
| [5] | Oike T, Suzuki Y, Sugawara K, et al. Radiotherapy plus concomitant adjuvant temozolomide for glioblastoma: Japanese mono-institutional results[J]. PLoS One, 2013, 8(11): e78943. |
| [6] | DeAngelis LM. Anaplastic glioma: how to prognosticate outcome and choose a treatment strategy[J]. J Clin Oncol, 2009, 27(35): 5861-2. |
| [7] | Omar AI, Mason WP. Temozolomide: the evidence for its therapeutic efficacy in malignant astrocytoma[J]. Core Evid, 2010, 4: 93-111. |
| [8] | Dresemann G. Temozolomide in malignant glioma[J]. Onco Targets Ther, 2010, 3: 139-46. |
| [9] | Scoccianti S, Magrini SM, Ricardi U, et al. Radiotherapy and temozolomide in anaplastic astrocytoma: a retrospective multicenter study by the Central Nervous System Study Group of AIRO (Italian Association of Radiation Oncology)[J]. Neuro Oncol, 2012, 14(6): 798-807. |
| [10] | Zhang L, Wu X, Xu T, et al. Chemotherapy plus radiotherapy versus radiotherapy alone in patients with anaplastic glioma: a systematic review and meta-analysis[J]. J Cancer Res Clin Oncol, 2013,139(5): 719-26. |
| [11] | Gutenberg A, Bock HC, Reifenberger G, et al. Toxicity and survival in primary glioblastoma patients treated with concomitant plus adjuvant temozolomide versus adjuvant temozolomide: results of a single-institution, retrospective, matched-pair analysis[J]. Acta Neurochir(Wien), 2013, 155(3): 429-35. |
| [12] | Valduvieco I, Verger E, Bruna J, et al. Impact of radiotherapy delay on survival in glioblastoma[J]. Clin Transl Oncol, 2013, 15(4): 278-82. |
| [13] | Chen YD, Feng J, Fang T, et al. Effect of intensity-modulated radiotherapy versus three-dimensional conformal radiotherapy on clinical outcomes in patients with glioblastoma multiforme[J]. Chin Med J(Engl), 2013, 126 (12): 2320-4. |
| [14] | Roldán Urgoiti GB, Singh AD, Easaw JC. Extended adjuvant temozolomide for treatment of newly diagnosed glioblastoma multiforme[J]. J Neurooncol, 2012, 108(1): 173-7. |
| [15] | Seiz M, Krafft U, Freyschlag CF, et al. Long-term adjuvant administration of temozolomide in patients with glioblastoma multiforme: experience of a single institution[J]. J Cancer Res Clin Oncol, 2010, 136(11): 1691-5. |
 2014, Vol. 42
2014, Vol. 42




