文章信息
- 俞媛洁,赵亮,陈继红,沈倩妮,谭诗云,罗和生.2015.
- YU Yuanjie, ZHAO Liang, CHEN Jihong, SHEN Qianni, TAN Shiyun, LUO Hesheng.2015.
- 双气囊小肠镜诊断小肠间质瘤致消化道
- Value of Double-Balloon Enteroscopy in Diagnosing Alimentary Tract Hemorrhage
- 肿瘤防治研究, 2015, 42(02): 177-180
- Cancer Research on Prevention and Treatment, 2015, 42(02): 177-180
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.02.017
-
文章历史
- 收稿日期:2014-05-09
- 修回日期:2014-09-30
正常成人小肠总长度约5~7米,为消化道最长的器官。常用的推进式插镜方法容易造成小肠肠管成袢和拉长,无法到达小肠深处,使得小肠深处成为常规消化道内镜检查的“盲区”。而双气囊小肠镜(double-balloonenteroscopy, DBE)能通过两个气囊交替固定肠管,交替插入内镜和外套管,将肠管套在外套管上,缩短其长度,从而完成小肠检查并获得直接的影像学依据和组织病理学依据,使小肠疾病的内镜诊断水平有了很大的提高。
胃肠道间质瘤(gastrointestinalstromaltumor, G I S T)是消化道最常见的间叶组织肿瘤,约30%~35%发生在小肠[1]。小肠间质瘤(stromaltumorofsmallbowel, STSB)早期临床表现缺乏特异性,症状、体征均不典型,诊断受限[1]。本研究收集武汉大学人民医院2009年1月至2014年3月间经DBE检查后经手术病理证实的40例小肠间质瘤致消化道出血患者资料,对其临床表现、内镜下形态及其他影像学检查结果进行回顾性比较分析,旨在探讨小肠间质瘤的临床表现、内镜形态特点及双气囊小肠镜的诊断价值,进一步提高小肠间质瘤的诊断水平。 1 资料与方法 1.1 临床资料
收集武汉大学人民医院消化内科2009年1月至2014年3月间收治的“不明原因消化道出血”(obscuregastrointestinalbleeding, OGIB)患者中经DBE检查及术后病理证实的40例STSB患者。其中男30例、女10例,男女比例为3∶1,年龄30~80岁,平均(50.50±10.21)岁,对其临床表现、内镜下形态及其他影像学检查结果进行回顾性比较分析。
OGIB需同时符合以下条件[2]:(1)具有持续或反复发作的黑便、血便或大便隐血测试阳性;(2)常规内镜检查(胃镜、结肠镜)未能发现病灶;(3)小肠钡餐或X线造影未能发现病灶。1.2 DBE操作方法与内镜下检查
DBE检查前给予患者支持治疗,改善一般状况,必要时给予输血治疗使血红蛋白≥80g/ml。根据临床表现决定进镜方式:黑便、呕吐或上腹痛者选择口侧进镜检查;暗红色血便、下腹痛者则选择肛侧进镜检查;无法确定进镜方式者首选肛侧进镜。DBE检查前3天禁食或进食少量流质,连续服用肠道清洁剂至排出无渣水样便为止。
应用FujingEN-450P5/20型双气囊小肠镜,参照Yamamoto等[3]介绍的方法进行操作,给予异丙酚静脉注射麻醉,全程行心电监护和氧饱和度监测。一侧进镜检查若发现可解释临床表现的病灶,可结束检查。如一侧进镜至无法继续进镜仍未发现可解释临床表现的病灶,则在进镜最深处注射0.2%靛胭脂,作为会合标记,并从另一端进镜,发现可解释临床表现的病变、到达会合标记或无法继续进镜时结束检查。
DBE检查发现向肠腔内生长的半球性或球形黏膜下隆起,边界清楚,质地较硬,表面伴或不伴溃疡可拟诊“间质瘤”,待手术切除后行病理组织学检查确诊。 1.3 小肠间质瘤的病理诊断及危险度分级
外科手术切除病灶后,进行病理组织学检查和免疫组织化学检测,测量肿瘤大小并计数核分裂数。光学显微镜下表现为梭形细胞或上皮样细胞排列成实性片状、束状、栅栏状等结构的间叶来源肿瘤,同时免疫标志物CD117表达阳性者可确诊为间质瘤[4]。测量手术完整切除病灶标本的最大直径作为肿瘤大小。选择核分裂最活跃区域累计邻近200个高倍视野核分裂数计数总核分裂相,测算每50个高倍视野的平均核分裂数作为核分裂相计数。
评估侵袭危险程度和预后采用参照美国国立卫生研究所(NIH)胃肠道间质瘤危险度分级(2008年)标准,分为极低、低、中、高危险度4级[5]。 2 结果 2.1 一般情况及临床表现
本研究纳入患者4 0例,出血(黑便、血便或大便隐血阳性)时间1周~ 5年,可伴有贫血(27/40)、腹部疼痛或不适(21/40)、体重下降(9/40)等症状。经术后病理及免疫组织化学确诊为小肠间质瘤。 2.2 前期影像学诊断
4 0例患者均因“不明原因消化道出血”行DBE检查,具有持续或反复发作的黑便、血便或大便隐血阳性,一次或多次胃镜、结肠镜检查、小肠钡餐或造影等均无阳性发现。有15.00%(6/40)的患者行DBE检查前,通过腹部CT(3例)、肠系膜血管造影(3例)及胶囊内镜(3例)发现病灶,提示“小肠间质瘤”可能。 2.3 DBE检查结果
4 0例患者均顺利进行DBE检查,未发生出血、穿孔、急性胰腺炎等并发症。38例患者首次DBE检查即发现边界清楚、质地较硬的半球形或球形黏膜下隆起,直径约为2~12cm。2例患者首次DBE检查漏诊,见图 1A;次年再次出血行DBE检查发现病变,见图 1B。
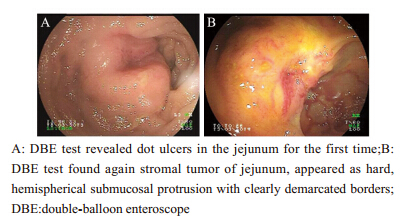 |
| 图 1 胃肠道间质瘤患者双气囊小肠镜检查结果 Figure 1 Double-balloon enteroscope result of gastrointestinal stromal tumor patients |
表面伴溃疡形成9例(22.50%),伴血管扩张9例(22.50%),表面凹陷7例(17.50%)。隆起位于十二指肠5例(12.50%)、空肠24例(60.00%)、回肠8例(20.00%)、空回肠交界处3例(7.50%)。 2.4 术后小肠间质瘤的病理诊断及危险度分级
40例患者经外科手术切除病灶,行病理组织学检查和免疫组织化学检测确诊小肠间质瘤。肿瘤直径<2cm者6例(15.00%),直径2~5cm者24例(60.00%),直径5~10cm者7例(17.50%),直径>10cm者3例(7.50%)。
镜下肿瘤细胞多为梭形细胞、上皮样细胞或混合型,部分核异型性和核分裂增加,间质淋巴细胞与浆细胞浸润,伴黏液变性、坏死、出血及钙化。免疫组织化学诊断结果:CD117阳性者35例(87.50%),CD34阳性者27例(67.50%),Vimentin阳性34例(85.00%),S-100阳性15例(37.50%)。
S B S T危 险 度 分 级 : 极 低 危 险 度6例(15.00%),低危险度15例(37.50%),中等危险度13例(32.50%),高危险度6例(15.00%)。 3 讨论
GIST是起源于胃肠道肌层Cajal间质细胞或同源间叶干细胞的非上皮肿瘤,具有恶性潜能,手术切除后仍具有复发和转移的风险[6,7]。GIST中STSB约占30%~35%,发病率仅次于胃间质瘤(50%~60%)[1],且50%以上为恶性,预后较胃间质瘤差,更值得引起关注[8,9,10]。
本研究发现STSB在以OGIB为临床表现的小肠疾病中并不少见,可能仅次于小肠憩室/重复畸形,为OGIB的第二常见病因,应引起临床医师的足够重视。 3.1 小肠间质瘤的临床表现
STSB起病隐匿,早期症状缺乏特异性,难以为其诊断提供有价值的线索,明确诊断仍需依赖于影像学检查与术后病理。本研究中,STSB临床表现具有以下特点:(1)表现为慢性消化道出血、小肠梗阻或非特异性腹痛,而消化道出血是其最主要的症状[11];(2)除贫血外,缺乏其他恶性肿瘤常见的全身症状;(3)病程较长的患者病情多稳定,缺乏肿瘤进展、转移的临床表现。 3.2 小肠间质瘤的影像学诊断
小肠稀钡造影、腹部CT、CT血管造影等放射影像学检查对判断小肠间质瘤的部位、形态、大小、内部结构、与邻近组织的关系、转移有一定帮助[12,13]。但本研究仅15.00%的患者通过腹部CT、血管造影等检查发现疑似病灶,并通过DBE及术后病理得以证实,且均为直径较大(>5cm)的间质瘤,提示上述放射影像学检查诊断价值和准确性有限,考虑与间接影像学依据有关,且受到多种干扰因素的影响、缺乏特异性征象有关。 3.3 胶囊内镜的诊断价值
胶囊内镜(capsuleendoscopy,CE)具有非侵入性、易于完成及指导DBE进入路径等优点,为OGIB首选或用于初筛检查。但其无法在肠道停留、不能通过充气、吸水及调控观察角度等方法对某些特殊部位或清洁欠佳的胃肠道黏膜进行准确和仔细的观察,因而诊断的准确性存在一定争议[13,14]。
本研究中,共有6例OGIB患者DBE检查前行CE检查,3例准确发现小肠间质瘤病灶,3例漏诊,考虑与以下因素有关:(1)部分肠段清洁度欠佳、活动性出血、蠕动过快或发生痉挛影响对病灶的准确观察;(2)部分间质瘤向肠腔外生长,肠腔内病灶较小或平坦容易被漏诊;(3)2例患者经手术证实发生胶囊滞留未能通过病灶所在肠段。因此,小肠间质瘤患者中CE检查的安全性及诊断价值尚有待进一步评估。
据此,认为放射影像学检查和CE可作为小肠间质瘤的初筛检查,避免漏诊、误诊或定位错误,仍有必要进行DBE检查进一步明确诊断。 3.4 DBE诊断小肠间质瘤的诊断价值
DBE检查理论上可完成全小肠检查,为观察小肠间质瘤的形态、部位提供准确的直接影像学信息,是诊断间质瘤和进行外科手术治疗的可靠依据。
本研究中40例小肠间质瘤患者均能顺利完成DBE检查,未发生出血、穿孔、死亡等严重并发症,95%(38/40)患者首次DBE检查即发现病灶,漏诊率低[5%(2/40)],表明DBE是一种较为安全有效的诊断小肠间质瘤的检查方法,具有较高的诊断价值,并能为患者的治疗策略提供参考。
小肠间质瘤的内镜下形态具有以下特点:(1)好发于空肠;(2)多为边界清楚、质地较硬的半球性或球形黏膜下隆起,表面覆盖黏膜形态正常;(3)部分表面可伴凹陷、溃疡形成、血管扩张;(4)部分向腔外生长者病灶可较小而平坦。但内镜下观察具有上述特点的黏膜下肿瘤仍需与平滑肌瘤、神经纤维瘤、类癌、淋巴瘤等肿瘤相鉴别。
由于间质瘤病变位于黏膜下层、固有肌层或浆膜层,常规组织活检难以作出定性诊断且存在肿瘤种植播散和出血的风险,一般不推荐DBE检查时行病理组织活检[2]。故内镜下拟诊为小肠间质瘤的病例,确诊仍需要依赖于外科手术切除病灶后进行病理组织学检查和免疫组织化学检测。此外,DBE检查是一种费用较高、耗时较长、需要麻醉辅助、存在发生并发症风险的侵入性检查。一般仅在患者出现明显临床症状如消化道出血、小肠梗阻或其他影像学检查疑诊小肠间质瘤时才推荐进行检查,尚无法进行小肠间质瘤的早期诊断或筛查。
肿瘤部位、大小、核分裂相及肿瘤是否破裂是评估GIST侵袭危险程度和临床预后的关键因素[6,15,16]。DBE检查缺乏组织病理活检则无法评估核分裂相,而内镜下观测到的肿瘤大小可能因为肿瘤侵润深度、生长方式的不同与完整手术切除标本的大小存在一定差异。因此,DBE检查虽可准确观察小肠间质瘤部位和形态,但无法为评估其侵袭危险程度和临床预后提供准确的信息。
此外,DBE检查亦无法了解肿瘤内部结构、与邻近组织的关系、转移等方面的信息。因此,DBE检查仍需结合其他影像学检查及分子生物学诊断信息进行综合分析,才能准确评估小肠间质瘤患者的病情和预后,制订适宜的治疗方案。如何结合其他影像学检查及分子生物学诊断早期发现小肠间质瘤并准确评估其侵袭危险程度和临床预后值得在今后临床工作中进一步研究和探讨。
| [1] | Joensuu H, Hohenberger P, Corless CL. Gastrointestinal stromaltumour[J]. Lancet, 2013, 382(9896): 973-83. |
| [2] | Raju GS, Gerson L, Das A, et al. American GastroenterologicalAssociation (AGA) Institute technical review on obscuregastrointestinal bleeding[J]. Gastroenterology, 2007, 133(5):1697-717. |
| [3] | Yamamoto H, Sekine Y, Sato Y, et al. Total enteroscopy with anonsurgical steerable double-balloon method[J]. GastrointestEndosc, 2001, 53(2): 216-20. |
| [4] | Miettinen M, Lasota J. Histopathology of gastrointestinal stromaltumor[J]. J Surg Oncol, 2011, 104(8): 865-73. |
| [5] | Joensuu H. Risk stratification of patients diagnosed withgastrointestinal stromal tumor[J]. Hum Pathol, 2008, 39(10):1411-9. |
| [6] | Miettinen M, El-Rifai W, H L Sobin L, et al. Evaluation ofmalignancy and prognosis of gastrointestinal stromal tumors: areview[J]. Hum Pathol, 2002, 33(5): 478-83. |
| [7] | Hasegawa T, Matsuno Y, Shimoda T, et al. Gastrointestinal stromaltumor: consistent CD117 immunostaining for diagnosis, andprognostic classification based on tumor size and MIB-1 grade[J].Hum Pathol, 2002, 33(6): 669-76. |
| [8] | Pidhorecky I, Cheney RT, Kraybill WG, et al. Gastrointestinalstromal tumors: current diagnosis, biologic behavior, andmanagement[J]. Ann Surg Oncol, 2000, 7(9): 705-12. |
| [9] | Levy AD, Remotti HE, Thompson WM, et al. Gastrointestinalstromal tumors: radiologic features with pathologic correlation[J].Radiographics, 2003, 23(2): 283-304, 456. |
| [10] | Grover S, Ashley SW, Raut CP. Small intestine gastrointestinalstromal tumors[J]. Curr Opin Gastroenterol, 2012, 28(2): 113-23. |
| [11] | Nishimura M, Yamamoto H, Kita H, et al. Gastrointestinalstromal tumor in the jejunum: diagnosis and control of bleedingwith electrocoagulation by using double-balloon enteroscopy[J]. JGastroenterol, 2004, 39(10): 1001-4. |
| [12] | Sandrasegaran K, Rajesh A, Rushing DA, et al. Gastrointestinalstromal tumors: CT and MRI findings[J]. Eur Radiol, 2005, 15(7):1407-14. |
| [13] | Kameda N, Higuchi K, Shiba M, et al. A prospective, single-blindtrial comparing wireless capsule endoscopy and double-balloonenteroscopy in patients with obscure gastrointestinal bleeding[J].J Gastroenterol, 2008, 43(6): 434-40. |
| [14] | Marmo R, Rotondano G, Casetti T, et al. Degree of concordancebetween double-balloon enteroscopy and capsule endoscopyin obscure gastrointestinal bleeding: a multicenter study[J].Endoscopy, 2009, 1(7): 587-92. |
| [15] | Dematteo RP, Lewis JJ, Leung D, et al. Two hundredgastrointestinal stromal tumors: recurrence patterns and prognosticfactors for survival[J]. Ann Surg, 2000, 231(1): 51-8. |
| [16] | Patil DT, Rubin BP. Gastrointestinal stromal tumor: advancesin diagnosis and management[J]. Arch Pathol Lab Med, 2011,135(10): 1298-310. |
 2014, Vol. 42
2014, Vol. 42


