文章信息
- 陈超,廖珍媛,李颖,李永菊,罗军敏,徐林. 2015.
- CHEN Chao, LIAO Zhenyuan, LI Ying, LI Yongju, LUO Junmin, XU Lin. 2015.
- 过表达microRNA-7对人肺癌95D细胞凋亡的影响
- Effect of microRNA-7 Overexpression on Apoptosis of Human Lung Cancer Cell Line 95D
- 肿瘤防治研究, 2015, 42(02): 108-112
- Cancer Research on Prevention and Treatment, 2015, 42(02): 108-112
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.02.002
-
文章历史
- 收稿日期:2014-01-26
- 修回日期:2014-07-07
目前,肺癌的发病率及致死率在所有恶性肿瘤中均居首位[1]。肺癌的发生、发展是一个多基因、多步骤参与的过程,包括原癌基因活化、抑癌基因的失活等,涉及到生长、侵袭、转移和凋亡等各个阶段[2,3]。目前,已知与肺癌发生密切相关的基因数目庞大且机制复杂,其中近年发现的一类小分子RNA——微小RNA(microRNA,miRNAs)与肺癌细胞生长、侵袭和凋亡的关系已成为该领域的研究热点之一。
miR-7是近年来报道的miRNAs家族成员之一,在包括肺癌在内的多种临床疾病发生中起重要作用。然而,miR-7在肺癌发生各阶段中的具体作用、机制及其表达的调控机制等仍待研究阐明[4,5]。我们在前期研究中发现miR-7模拟物(mimics)可显著抑制人肺癌细胞的体外生长和侵袭[6,7]。此外,我们还成功构建了miR-7的真核表达载体,并观察到过表达miR-7对人肺癌细胞生长和侵袭转移的抑制效应[8]。因此,在本研究中,我们拟进一步观察过表达miR-7对人肺癌细胞体内外凋亡的作用,以期为miR-7参与肺癌发生、发展过程机制的阐明,以及后续基于miR-7的临床肺癌基因治疗新靶标开发提供前期实验基础。1 材料和方法1.1 细胞株、实验动物及试剂
人源性肺巨细胞癌95D细胞株,购于中国科学院上海生命科学研究院生物化学与细胞生物学研究所。DH5α大肠杆菌菌株购于Takara公司。24只雌性BALB/C裸鼠4周龄,体质量10~12 g左右,购自第三军医大学实验动物中心。PCR试剂、Premix Ex Taq Version2.0、RNAisoTMPlus均购自Takara公司;质粒抽提试剂盒购自天根生化科技有限公司;LipofectamineTM 2000转染试剂购自美国Invitrogen公司;细胞培养液RPMI 1640购自Gibco BRL公司;L-谷氨酰胺购自上海政翔化学试剂研究所;双抗(氨卞青霉素钠、硫酸链霉素)购自上海市第四制药股份有限公司;胎牛血清购自Hyclone公司;RevertAidTM First Strand cDNA Synthesis Kit购自Fermentas公司;0.5%Triton-x-100购自碧云天公司;磷酸化Caspase 3、磷酸化Caspase 9抗体、抗兔-HRP标记和抗兔-FITC标记的二抗均购自Abcom公司。1.2 体外瞬时转染miR-7真核表达载体
将我们前期实验中构建成功的miR-7真核表达载体(命名为p-miR-7)[9]体外瞬时转染人肺癌95D细胞。具体操作分两部分:(1)细胞培养:用含10%胎牛血清、1 000 u/ml青霉素、100 mg/ml链霉素及2 mmol/L谷氨酰胺的RPMI 1640培养液,于37℃、5%CO2条件下培养95D细胞,并扩大培养,用0.25%胰蛋白酶消化,细胞计数并离心收集细胞,用0.9%氯化钠溶液调整细胞浓度为5×107/ml备用。(2)细胞转染:用胰蛋白酶消化并收集细胞对数生长期的95D细胞,将3×105个细胞重悬于1 ml RPMI 1640培养液中,转移至6孔板,在37℃、5%CO2条件下培养;12 h后对细胞分别用p-miR-7和p-Cont进行转染。1.3 TUNEL原位凋亡法检测以上各实验组的凋亡情况
收集95D细胞,将其转移至专用细胞培养载玻片中,培养条件和转染方法同前。培养48 h后,取出培养细胞载玻片,吸掉培养液。浸入4%多聚甲醛PBS溶液中,室温固定20 min。于PBS溶液中浸洗30 min。将载玻片浸入封闭液中,室温封闭10 min。PBS漂洗。于通透液(破膜液)中,冰上(2℃~8℃)促渗2 min。PBS漂洗。加100 μl TUNEL reaction mixture 反应液,加盖玻片,置于湿盒中,37℃避光反应60 min。PBS漂洗。DAPI染色3 min。PBS漂洗。滴加pH7.4 50%的缓冲甘油,盖上盖玻片,封片。用激光共聚焦显微镜进行观察,拍片并计算阳性。1.4 免疫荧光技术检测以上各实验组中磷酸化Caspase3、磷酸化Caspase9蛋白的表达
收集95D细胞,将其转移至专用细胞培养载玻片中,培养条件和转染方法同前。培养48 h后,取出培养细胞的玻片,洗掉培养液,用4%多聚甲醛固定20 min,用PBS漂洗。加含10%牛白蛋白的PBS封闭1 h,用PBS漂洗。加0.5% Triton-x-100 PBS进行破膜2 min,PBS漂洗。滴加Caspase3或Caspase9抗体(1∶100),置于4℃湿盒中过夜,取出用PBS漂洗。加入1∶200倍稀释的羊抗兔-FITC二抗,置于37℃湿盒中避光作用1 h,PBS漂洗。滴加DAPI染液,染色3 min,PBS漂洗。滴加pH7.4 50%的缓冲甘油,盖上盖玻片,封片。用激光共聚焦显微镜进行观察,拍片并利用ImagePro Plus软件测量平均荧光强度。1.5 建立裸鼠95D肺癌皮下移植瘤模型
裸鼠购回后于SPF环境下观察饲养1周,在裸鼠右侧腋窝中部外侧皮下接种5×107个95D细胞,编号并随机分为实验组和对照组(每组12只),p-miR-7重组载体及p-Cont局部注射参考前期实验[9]。接种95D后于第2、3、4、5、6及7周用游标卡尺测量肿瘤大小。并于第7周末麻醉后处死裸鼠,取出皮下肿瘤组织。1.6 肿瘤组织TUNEL原位凋亡检测
常规制作冰冻切片,-80℃中取出冰冻切片室温平衡15 min,置PBS溶液浸泡10 min。浸入4%多聚甲醛PBS溶液中,室温固定20 min。用PBS溶液漂洗。浸入封闭液中,室温封闭10 min。用PBS漂洗。于通透液(破膜液)中,冰上(2℃~8℃)促渗2 min。用PBS漂洗。加50 μl TUNEL reaction mixture反应液,加盖玻片,置于湿盒中,37℃避光反应60 min。用PBS漂洗。滴加DAPI染色3 min。用PBS漂洗。滴加pH7.4 50%的缓冲甘油,盖上盖玻片,封片。用激光共聚焦显微镜进行观察,拍片。1.7 免疫组织化学检测磷酸化Caspase 3、磷酸化Caspase 9蛋白的表达水平
常规制作石蜡切片,-80℃中取出石蜡切片脱蜡至水。3%H2O2室温10 min,目的是消除内源性过氧化物酶的活性。微波和柠檬酸盐修复。蒸馏水冲洗,PBS浸泡5 min。10%正常牛白蛋白(PBS稀释)封闭,室温孵育20 min。倾去血清,勿洗,滴加1∶200倍比例稀释的一抗,4℃过夜。PBS冲洗。滴加适当比例稀释的HRP 标记二抗(PBS稀释),37℃孵育30 min。PBS冲洗。滴加显色剂显色(DAB)。自来水充分冲洗,苏木精对比染色,二甲苯透明后,中性树胶封片后镜检。1.8 统计学方法
所有数据均以(x±s)表示,数据采用SPSS16.0软件分析,组间比较采用t检验,以P<0.05为差异具有统计学意义。2 结果2.1 瞬时转染p-miR-7对95D细胞凋亡的影响
我们在前期研究中发现,利用构建的真核表达载体(命名为p-miR-7)过表达miR-7可以显著增加人肺癌细胞中miR-7的表达水平,并明显抑制细胞的体外生长[6,7,8]。为了进一步观察p-miR-7载体过表达miR-7对人肺癌细胞凋亡的影响,我们利用TUNEL实验观察了各组中细胞凋亡水平的变化。结果显示,各组中均存在细胞的凋亡;然而与对照组(p-Cont组30.15±0.35)比较,p-miR-7组(52.34±0.25)细胞的凋亡比例明显增加(P=0.000),见图 1,提示过表达miR-7可导致肺癌细胞的凋亡。
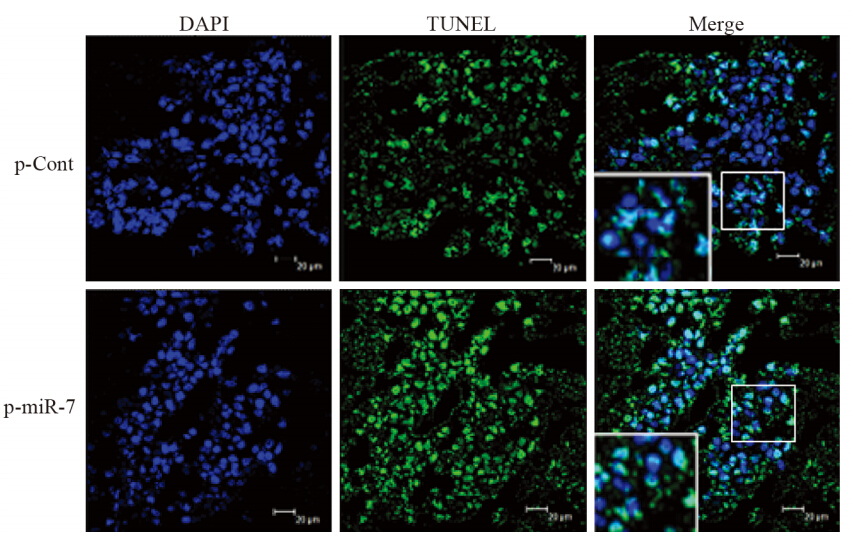 |
| 图 1 转染p-miR-7后人肺癌95D细胞凋亡检测(TUNEL ×400) Figure 1 The apoptosis of human lung cancer cell line 95D transiently transfected with p-miR-7(TUNEL ×400) |
结果显示,与p-Cont组相比,p-miR-7组中这两种蛋白的磷酸化水平均显著增加(P=0.000),见表 1、图 2,这与我们前面的结果是一致的。
 |
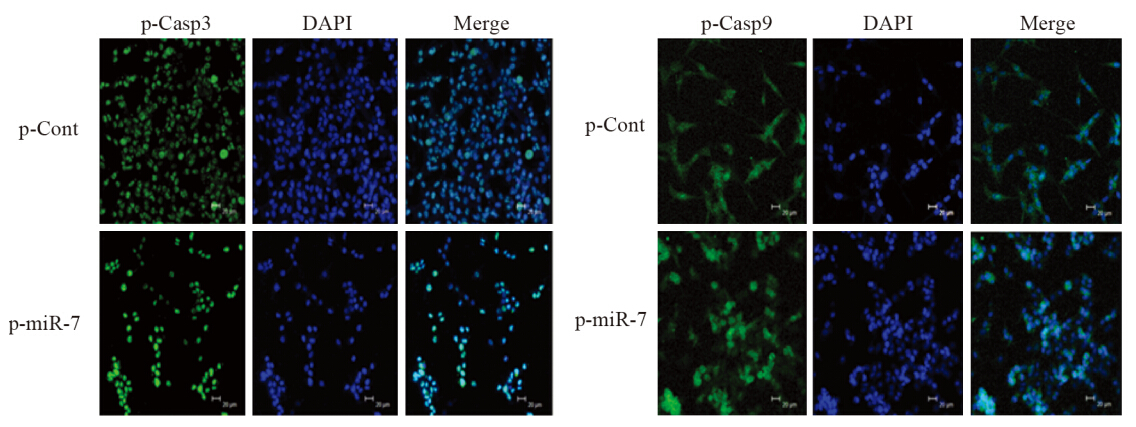 |
| 图 2 免疫荧光法检测肺癌95D细胞中p-Caspase3和p-Caspase9的表达(×400) Figure 2 Immunofluorescence analysis of p-Caspase3 and p-Caspase9 proteins expression in human lung cancer cell line 95D (×400) |
明确利用真核表达载体过表达miR-7对人肺癌细胞凋亡的作用,我们进一步建立了人裸鼠实验动物模型。肿瘤局部注射p-miR-7后,观察了各实验组中肿瘤组织的病理变化。HE染色结果显示:p-Cont对照组细胞形态多样,不规则,可见核质比加大,细胞核呈多形性、染色深,有些可见多个核;而p-miR-7组则可见大片凋亡坏死区域,见图 3。
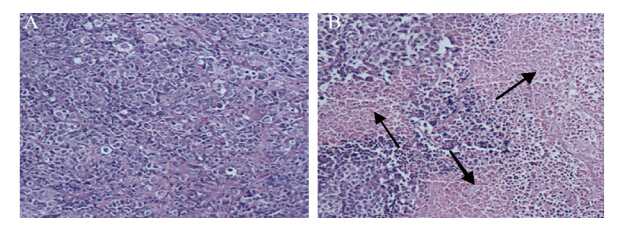 |
| A:p-Cont; B:p-miR-7; Arrows refers to the necrosis area in lung cancer tissues 图 3 肺癌组织苏木精-伊红染色结果 (×100) Figure 3 Hematoxylin and eosin staining of lung cancer tissues (×100) |
我们进而利用Real-time PCR探针法检测了各组肿瘤组织中miR-7成熟体的相对表达水平。p-miR-7组为(37.06±1.28),p-Cont组为(1.01±0.21)。提示,p-miR-7重组载体可在肿瘤组织中有效表达miR-7。我们进一步利用TUNEL法检测了各实验组中肿瘤局部细胞凋亡的变化。激光共聚焦检测结果显示:p-miR-7实验组(45.35±0.23)与p-Cont对照组(18.33±0.34)相比,肿瘤组织细胞的凋亡明显增加,差异具有统计学意义(P=0.000),见图 4,这也与我们前面部分的实验结果一致。
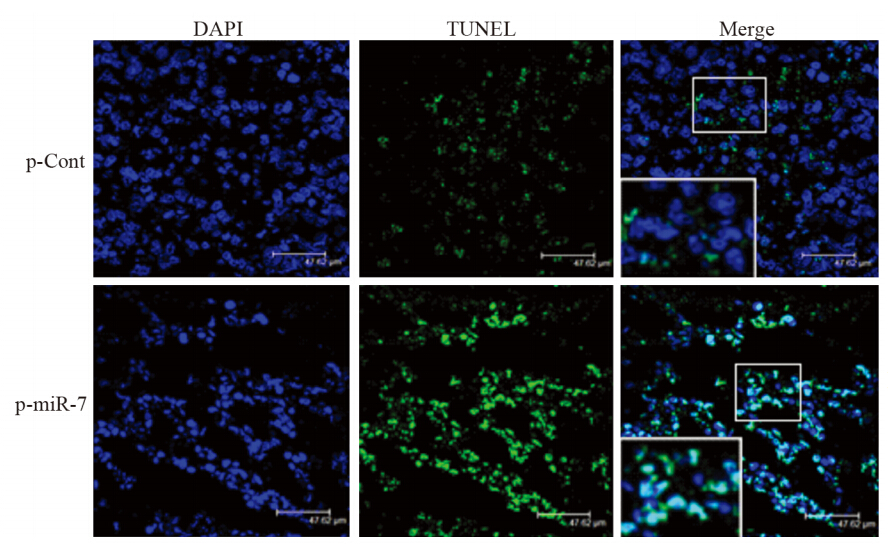 |
| 图 4 TUNEL检测肺癌组织细胞原位凋亡(×400) Figure 4 TUNEL detection of cell apoptosis in lung cancer mass in situ (×400) |
前面的实验结果显示,miR-7过表达可增加凋亡相关分子磷酸化Caspase3和磷酸化Caspase9的水平。为了进一步明确过表达miR-7体内对肿瘤凋亡的作用,我们利用免疫组织化学法检测了各组中相关分子的表达。p-miR-7组与p-Cont组相比,凋亡相关的磷酸化Caspase3和磷酸化Caspase9蛋白水平则显著增加,见图 5。这提示,过表达miR-7可促进肿瘤凋亡相关蛋白的表达。
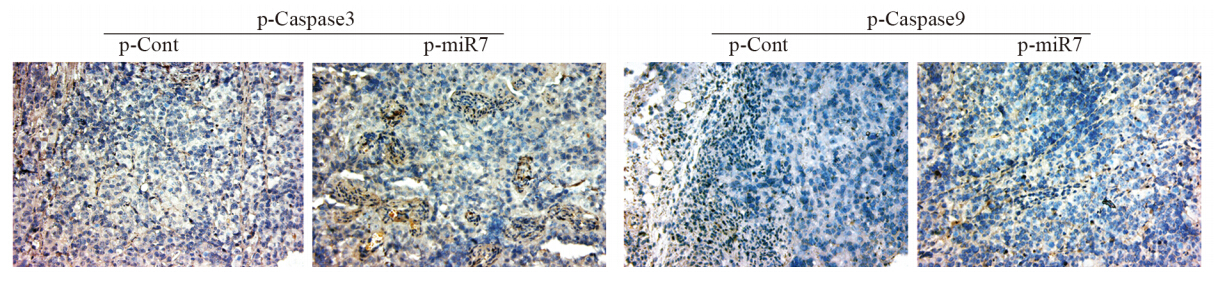 |
| 图 5 肺癌组织中相应蛋白的表达(免疫组织化学 ×200) Figure 5 The expression of corresponding proteins in lung cancer tissues (IHC ×200) |
微小RNA(microRNAs或miRNAs)是一组广泛存在于真核生物中的内源性、非编码、单链小分子RNA,长度在22~24 nt。miRNAs能与目的基因的3′端非翻译区(3′untranslated region,3′UTR)结合,在转录后水平通过促进靶mRNA的降解或抑制蛋白质翻译来负调控目的基因表达,从而参与调控细胞的发育、分化、转移和凋亡[10,11]。近年来大量的研究显示,多种miRNA的异常表达与肺癌的发生、发展及凋亡密切相关。
miR-7是定位于15号染色体中的mRNA家族成员,其表达变化与多种肿瘤发生及侵袭转移密切相关[12]。Kefas等[13]发现,miR-7可以通过抑制胶质瘤细胞血管内皮生长因子(vascular endothelial growth factor,VEGF)受体的表达,从而抑制肿瘤的生长。有研究发现,在相同剂量的表柔比星(epirubicin,EPI)处理下,miR-7模拟物转染组A549和H1299细胞的增殖活力下降,细胞凋亡增加[14]。本课题组在前期研究中发现,与人正常肺组织相比,miR-7在肺癌中的表达明显降低,且利用miRNA芯片技术检测发现,miR-7在高转移潜能人肺癌95D细胞中的表达水平显著低于低转移潜能的95C细胞,并且miR-7模拟物可以抑制95D细胞的生长、转移和凋亡[6,7]。本研究中我们进一步发现利用p-miR-7载体体外转染过表达miR-7可导致肺癌95D细胞的凋亡。所以我们推测miR-7可能是人肺癌细胞凋亡中的重要调控分子。大量研究显示,在细胞的凋亡过程中,Caspase3和Caspase9的磷酸化改变具有关键作用[15]。我们的检测结果也显示,miR-7过表达组人肺癌细胞中磷酸化Caspase3和Caspase9蛋白水平显著增加。这提示miR-7调控人肺癌细胞的凋亡与Caspase信号途径有关。Xiong等[16]研究也发现,miR-7能通过调控BCL-2表达来调节人肺癌细胞A549的凋亡。然而,由于目前已报道的miR-7靶分子较多,且涉及到肿瘤细胞的生长、转移等过程[8,16],因此,miR-7调控人肺癌细胞凋亡的具体分子机制仍待后续研究阐明。
为了进一步明确过表达miR-7对人肺癌细胞凋亡的作用,且为后续的体内肺癌基因治疗提供基础,我们建立了人肺癌裸鼠实验动物模型,并用各实验组与对照组的肿瘤组织做了HE染色。我们的结果显示,局部注射miR-7真核表达载体可有效表达miR-7。与p-Cont组比较,p-miR-7组裸鼠肿瘤凋亡增加,且荷瘤小鼠生存时间明显延长。更重要的是,我们发现过表达miR-7同样可以显著诱导肿瘤细胞的体内凋亡。与体外结果一致的是,我们通过免疫组织化学法也发现肿瘤局部磷酸化Caspase3和Caspase9蛋白的水平明显增加。新近的研究发现过表达miR-7可以通过调节TLR9信号途径对人肺癌细胞的生长和转移产生抑制效应[8]。此外,Xu等[17]还报道过表达miR-133a可以通过调节靶标MMP-14抑制人肺癌细胞的增殖、迁移和侵袭。这些研究结果有力地提示,过表达特定miRNAs分子可能作为今后肺癌相关临床治疗靶标开发的重要手段和策略。
总之,在前期实验基础上,我们本研究中进一步观察到过表达miR-7对人肺癌细胞体内外凋亡的作用,为后续深入阐明miR-7在人肺癌发生发展中的作用及机制,以及肺癌基因治疗靶标开发提供了重要的前期实验依据。
| [1] | Ferlay J, Shin HR, Bray F, et al.Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. Int J Cancer, 2010, 127(12): 2893-917. |
| [2] | Essary LR,Vargaa SO, Fletcher CD. Primary pleuropulmonary synovial sarcoma:reappraisal of a recendy described anatoIIlic subset[J]. Cancer, 2002, 94(2): 459-69. |
| [3] | Pope CA 3rd, Burnett RT, Thun MJ, et al. Lung cancer, cardiopuhnonary mortality, and long-term exposure to fine particulate air pollution[J]. JAMA, 2002, 287(9): 1132-41. |
| [4] | Liu X, Sempere LF, Ouyang H, et al. MicroRNA-31 functions as an oncogenic microRNA in mouse and human lung cancer cells by repressing specific tumor suppressors[J]. J Clin Invest, 2010, 120(4): 1298-309. |
| [5] | Takamizawa J, Konishi H, Yanagisawa K, et al. Reduced expression of the let-7 micrornas in human lung cancers in association with shortened postoperative survical[J]. Cancer Res, 2004, 64(11): 3753-6. |
| [6] | Xu L, Ren T, Zhou Y, et al. The effects of miRNA-7 on the proliferation of human lung cancer cell line 95D cells[J]. Zhong Liu, 2010, 30(9): 763-7. [徐林, 任涛, 周涯, 等. 微小RNA-7对人肺癌95D细胞体外增殖的作用[J]. 肿瘤, 2010, 30(9): 763-7.] |
| [7] | Xu L, Ren T, Qin AD, et al. The effects of microRNA-7 on the invasion of human lung cancer cell line 95D cellsin vitro[J]. Zunyi Yi Xue Yuan Xue Bao, 2011, 34(1): 12-6. [徐林, 任涛, 秦安东, 等. microRNA-7对人肺癌95D细胞体外侵袭的作用[J]. 遵义医学院学报, 2011, 34(1): 12-6.] |
| [8] | Xu L,Wen Z, Zhou Y, et al. MicroRNA-7-regulated TLR9 signaling-enhanced growth and metastatic potential of human lung cancer cells by altering the phosphoinositide-3-kinase, regulatory subunit 3/Akt pathway[J]. Mol Biol Cell, 2013, 24(1): 42-55. |
| [9] | Hu Y, Liao ZY, Chen C, et al. Over-expressed microRNA-7 inhibits the growth of human lung cancer cells via suppressing CGGBP1 expression[J]. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi, 2014, 30(2): 125-30. [胡燕, 廖珍媛, 陈超, 等. 过表达microRNA-7通过下调CGG结合蛋白1的表达抑制人肺癌细胞生长[J]. 细胞与分子免疫学杂志, 2014, 30(2): 125-30.] |
| [10] | Esquela-Kerscher A, Slack FJ. Oncomirs: microRNAs with a role in cancer[J]. Nat Rev Cancer, 2006, 6(4): 259-69. |
| [11] | Kim VN, Nam JW. Genomics of microRNA[J]. Trends Genet, 2006, 22(3): 165-73. |
| [12] | Foekens JA, Sieuwerts AM, Smind M, et al. Four miRNAs associated with aggressiveness of lymph node-negative, estrogen receptor-positive human breast cancer[J]. Proc Nat Acad Sci U S A, 2008, 105(35): 13021-6. |
| [13] | Kefas B, Godlewski J, Comeau L, et al. microRNA-7 inhibits the epidermal growth factor receptor and the Akt gathway and is down-regulated in glioblastoma[J]. Cancer Res, 2008, 68(10): 3566-72. |
| [14] | Qian J, Liu RH, Liu XM, et al. MicroRAN-7 sensitizes the chemosensitivity of non-small cell lung cancer cells to epirubicin treatment[J]. Zhongguo Zhong Liu Sheng Wu Zhi Liao Za Zhi, 2012, 19(2): 158-62. [钱静, 刘荣花, 刘小明, 等. MicroRNA-7对非小细胞肺癌表柔比星化疗的增敏作用[J]. 中国肿瘤生物治疗杂志, 2012, 19(2): 158-62.] |
| [15] | Liu J, Sun Q, Chen YJ, et al. Apoptosis induction of C8 on human liver cancer cell line SMMC-7721[J]. Zhonghua Gan Zang Bing Za Zhi, 2008, 16(8): 608-11. [刘健, 孙强, 陈英杰, 等. 双萘酰亚胺类化合物诱导SMMC-7721细胞凋亡的研究[J].中华肝脏病杂志, 2008, 16(8): 608-11.] |
| [16] | Xiong S, Zheng Y, Jiang P, et al. MicroRNA-7 Inhibits the Growth of Human Non-Small cell lung cancer A549 cells through Targeting BCL-2[J]. Int J Biol Sci, 2011, 7(6): 805-14. |
| [17] | Xu M, Wang YZ. miR-133a suppresses cell proliferation migration and invasion in human lung cancer by targeting MMP-14[J]. Oncol Rep, 2013, 30(3): 1398-404. |
 2014, Vol. 42
2014, Vol. 42


