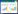文章信息
- 赵晨晖,余腾骅,涂刚.
- ZHAO Chenhui, YU Tenghua, TU Gang.
- 雌激素受体GPER在乳腺癌中的研究现状
- Research Status of Estrogen Receptor GPER in Breast Cancer
- 肿瘤防治研究, 2015, 42(12): 1248-1252
- Cancer Research on Prevention and Treatment, 2015, 42(12): 1248-1252
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.12.017
-
文章历史
- 收稿日期: 2015-01-13
- 修回日期: 2015-05-04
传统雌激素受体(ERα与ERβ)以及雌激素是影响乳腺癌、子宫内膜癌等多种激素敏感性肿瘤生物学行为的重要因素。内分泌治疗是乳腺癌综合治疗中的重要组成部分,选择性雌激素受体调节剂(selective estrogen receptor modulators,SERMs)用于拮抗乳腺癌的雌激素信号已经有数十年的历史,TAM抑制ER(+)乳腺癌的有效性已经得到临床证实,但并没有临床试验观察到TAM对ER(-)乳腺癌患者有任何获益效果[1];抑制雌激素依赖性乳腺肿瘤进展的另一条途径是使用芳香化酶抑制剂(aromatase inhibitors,AIs)干扰雌激素的合成,尽管其对于预防ER(+)乳腺癌的进展效果尤为明显[2],但也没有证据表明AIs能提高ER(-)乳腺癌患者的预后。因此,对于ER(-)尤其是三阴性乳腺癌患者而言,如何寻找一个新的内分泌治疗靶点提高患者的临床预后就显得尤为关键。
G蛋白偶联雌激素受体(G protein-coupledestrogen receptor,GPER或GPR30)参与雌激素的信号转导已经是当前国际上公认的事实,而前期研究提出的GPER表达与部分ER(+)乳腺癌TAM耐药之间存在显著相关性,进一步说明GPER通过介导其特有的信号通路参与了雌激素的信号转导[3]。因此,这种新型雌激素受体的发现,为进一步探究雌激素刺激乳腺癌细胞进展的机制及乳腺癌内分泌靶向治疗提供了新的方向和思路。
1 研究现状及进展 1.1 GPER的分布及亚细胞定位GPER广泛存在于多种不同的组织细胞中,如女性生殖系统、中枢海马组织、心血管系统等正常组织中;同时,GPER也表达于多种激素相关性肿瘤细胞中,如乳腺癌、子宫内膜癌、卵巢癌、前列腺癌等。
Filardo等[4]研究发现GPER具有膜表面受体的特征,如激活膜表面相关的酶、转活EGFR、促进第二信使的活化等。而Otto等[5]则证明GPER主要定位于内质网上。还有研究者[6]应用免疫组织化学的方法检测原发性乳腺癌细胞中GPR30的表达,发现其同时表达于细胞膜与细胞质中,甚至12.7%的组织细胞核上也发现了GPER的表达。除此之外,还有研究团队用细胞免疫荧光的方法检测肿瘤相关性成纤维细胞(cancer-associated fibroblasts,CAFs)中GPR30的定位,发现其在细胞核上点状分布[7]。GPER的亚细胞定位对其作用机制的研究具有一定的指向性,有研究提示GPER在乳腺癌细胞中的亚细胞定位可能与TAM耐药有关[8]。目前对GPER的细胞内定位尚没有得到统一的结论,除了细胞组织环境、发育水平和病理生理状态等因素外,可能还与实验条件和方法不同有关。总体来说,目前大多数观点认为GPER定位于细胞内质网上。
1.2 乳腺癌细胞中GPER参与的信号通路早期对ER拮抗剂的实验为GPER介导的肿瘤细胞增殖、转移、侵袭等生物学效应的分子机制研究作了一定的铺垫。Filardo等[9]早在2000年即阐述了在ER(-)的乳腺癌细胞中,GPER结合雌激素等配体后,与其偶联的G蛋白活化解离出Gβγ蛋白,进一步激活下游的Src酪氨酸激酶系统和金属蛋白酶(metalloproteinases,MMPs),从而促进肝素结合样表皮生长因子(Heparin binding epidermal growthfactor,HB-EGF)表达,然后反式激活EGFR,最终快速活化丝裂原活化蛋白激酶(mitogen-activatedprotein kinases,MAPKs)和细胞外信号调节激酶1/2(extracellular-signal regulated kinase,ERK1/2),引起细胞的生物学变化。其后他们又发现在三阴性乳腺癌细胞对于雌激素信号刺激的快速反应当中,不论是腺苷酸环化酶(AC)介导的EGFR/ERK通路的激活还是cAMP介导的对EGFR/ERK通路抑制作用,都有GPER的介导参与其中[10]。PI3K-Atk途径是GPER介导的另一条信号转导途径,GPER与E2结合后快速激活PI3K,进一步激活PI3K/Akt,参与细胞增殖信号转导,或者令Akt发生核内聚集,最终引起NOS丝氨酸磷酸化、NO释放增加,见图 1。此外,还有一些GPER靶基因参与乳腺癌的进展过程,比如c-fos基因,在ER阴性的乳腺癌细胞中由雌激素通过EGFR/MAPK信号级联参与诱导。雌激素和抗雌激素通过GPER在基因水平上介导早期生长反应因子(early growth response-1,EGR-1)和结缔组织生长因子(connective tissue growth factor,CTGF)的表达,在乳腺癌CAFs中也可得到类似的结论[11]。

|
| 图 1 G蛋白偶联雌激素受体参与信号转导示意图 Figure 1 Diagrammatic sketch of GPER involved in signal transduction |
此外,包括环境雌激素在内的多种雌激素均能在乳腺癌细胞中通过GPER使蛋白激酶快速激活、促进cAMP产生以及基因转录。他们通常对经典的雌激素受体和GPER同时产生作用,但最终发挥激活或抑制的功能却不尽相同。例如,雌三醇在乳腺癌细胞中使ERα激活,却抑制GPER[12];相反,4-羟基三苯氧胺(4-OHT)抑制ERα却可以激活GPER[13]。因此,为了更加精确地描述GPER信号通路,使用选择性地识别GPER配体十分必要。迄今为止,已发现的选择性GPER激动剂有G-1、GPER-l1和GPER-l2[14, 15]。而在GPER拮抗剂中,最近发现的一种称作乙基3-[5-(2-乙酯基-1-甲基乙烯基)-1-甲基-1H-吲哚-3-烃基]-2-烯酸酯(MIBE)的复合物,能够同时抑制GPER信号通路和ER信号通路,极有可能成为一种新的靶向药物,使相对于单纯使用ER受体拮抗剂的乳腺癌患者获得更大的疗效[16]。
1.3 GPER在乳腺癌细胞中的生物学功能GPER信号使其配体活化以及GPER靶基因的上调均参与了乳腺癌细胞增殖的过程,这一事实支持GPER可能促进乳腺癌形成的观点。有研究报道GPER活化后通过上调CTGF[17]、cyclin E[18]、Not ch信号通路[19]以及细胞表面趋化因子受体(CXCR-1)[20]刺激乳腺癌细胞的迁移。GPER还被证明可以促进炎性乳腺癌细胞浸润[21]以及通过激活钙依赖的半胱氨酸蛋白酶(钙蛋白酶)使乳腺癌细胞产生黏附作用[22],这意味着GPER具有促进乳癌腺细胞转移的潜在能力。Marchese等[23]发现GPER的活化导致乳腺腺管结构产生一定程度恶性转化的畸变,同样支持了GPER在乳腺癌进展过程中的潜在作用。此外,最近有研究评估了非致肿瘤性乳腺上皮细胞依赖GPER的增殖,表明GPER在雌激素诱导的乳腺生理学过程中扮演着和病理学过程当中同样重要的角色[24]。
对乳腺癌细胞和CAFs的研究证明胰岛素样生长因子(insulin-like growth factors,IGF)和低氧诱导因子(hypoxia-inducible factor,HIF)可诱导GPER表达的上调[25, 26]。有研究发现无论在ER(-)还是ER(+)的乳腺癌细胞中,EGFR转导通路中的配体活化都可诱导GPER的表达,而另一方面EGFR也参与了HIF在细胞中上调GPER表达的过程[27, 28]。以上研究结果提示GPER也可能在低氧诱导的血管生成中发挥作用[26]。此外,IGF-I被证明能够在乳腺癌细胞中通过IGF-IR/PKC/MAPK等信号转导通路刺激GPER的表达[25]。综上,在参与乳腺癌进展的细胞增殖、迁移及肿瘤血管生成的主要分子机制中,既包括EGFR和IGF-IR配体的作用,也包括低氧诱导因子调控GPER表达的过程。
1.4 GPER在乳腺癌他莫昔芬耐药性方面的作用GPER在乳腺癌细胞系和乳腺癌原发灶中均有广泛表达。一项采用多因素分析的临床试验结果表明,在使用他莫昔芬内分泌治疗的GPER(+)乳腺癌患者中,GPER表达率升高而无复发生存率降低,而在没有使用他莫昔芬的患者中则观察到相反的结果,该研究进一步证明了GPER是影响乳腺癌预后的独立因素,也提示了GFER和他莫昔芬耐药的相关性[6]。Sjöström等[29]研究报道GPER过度表达和亚细胞定位与接受他莫昔芬治疗的原发性乳腺癌患者长期预后的相关性也成为乳腺癌研究进展的关键事件。由以上研究结果可推测,对GPER高表达的ER(+)乳腺癌患者使用他莫昔芬治疗前,需对患者进行仔细谨慎的全面评估。
大量的体外实验表明,阻断GPER信号通路或干预GPER表达的上调过程都可以考虑为针对TAM耐药乳腺癌的应对策略。早已有研究发现4-羟基他莫昔芬(4-hydroxytamoxifen,OHT)在肿瘤细胞中对GPER发挥激动作用[30],由此可推断传统的抗雌激素药物对部分他莫昔芬耐药的肿瘤可能非抑制作用而是刺激作用。需要指出的是,在子宫内膜癌细胞中,GPER介导的生物学反应不仅针对他莫昔芬,也针对其他雌激素受体调节因子(SERMs),如雷洛昔芬和雌激素受体拮抗剂ICI182、780,由此也提示接受内分泌治疗的乳腺癌患者子宫内膜癌患病风险显著增加的另一条可能机制。研究显示在ER(+)的TAM耐药乳腺癌细胞中,EGFR的配体通过激活EGFR/ERK信号转导通路使GPER的表达上调,提示EGFR信号通路的激活可能有助于他莫昔芬耐药的产生[27]。有趣的是,TAM被进一步证明可活化肿瘤微环境CAFs中GPER促进下游EGFR/ERK信号通路以及雌二醇的产生,而雌激素又可反向激活GPER促进CAFs的细胞增殖,使其形成一个正反馈通路,由GPER介导的雌二醇的合成可能是导致肿瘤TAM耐药的重要机制之一[31]。根据这些发现,雌激素的刺激导致了TAM耐药细胞中GPER表达上调,反过来又增加了细胞对于GPER激动剂的敏感度和反应性。在对以上研究结果的进一步证实中,发现GPER拮抗剂G-15可以提高他莫昔芬耐药的异种移植肿瘤对于内分泌治疗的反应性[3]。
1.5 三阴性乳腺癌细胞中的GPER三阴性乳腺癌(triple-negative breast cancer,TNBC)约占乳腺癌患者总数的15%~20%,其特征为缺乏ERα、PR和EGFR2(Her-2)的表达,对传统内分泌治疗及靶向治疗不敏感。TNBC与其他乳腺癌类型相比更多见于年轻女性,具有更强的侵袭性和较差的临床预后。因缺乏明确有效的药物治疗靶点,标准化疗方案仍然是TNBC患者除手术和放疗外仅有的治疗选择[32]。
前期的回顾性临床研究[33, 34]分析显示,GPER表达于62.5%的ER(-)乳腺癌患者,其中在TNBC中的表达率高达68.8%,其阳性表达与TNBC患者的绝经前状态、肿瘤大小及不良临床分期显著相关,可能是TNBC患者预后不佳的生物指标之一。Steiman等[35]研究也得到类似的结果,实验数据还提示GPER与TNBC患者普遍较年轻的发病年龄以及术后3年的早期复发紧密相关。此外,在体外TNBC细胞系MDA-MB-468与MDA-MB-436中进一步证明,雌激素可活化GPER及其下游的EGFR/ERK信号通路,促进通路下游cyclin D1/A、Bcl-2、c-fos等基因表达,参与TNBC细胞增殖、细胞周期与凋亡调控、细胞迁移与侵袭;使用GPER特异性抑制剂G15、EGFR特异性抑制剂AG1478及ERK特异性抑制剂U0126靶向抑制GPER/EGFR/ERK信号通路后可明显降低TNBC细胞的转移、侵袭等多种恶性生物学行为[34]。综上所述,靶向抑制GPER可能是寻找TNBC新治疗的研究方向,更多的临床研究及体内实验仍需进一步证实。
2 存在的争议目前关于GPER的定位以及功能,特别是其介导促进细胞凋亡的潜在功能仍然存在着争论。
GPER曾经被认为属于细胞表面受体家族,通常介导不可透过细胞膜的配体的跨膜信号转导,但如前文所示,大量研究表明GPER可在乳腺癌细胞的质膜或细胞内水平被检测到,有研究甚至提示GPER在CAFs细胞核上的定位存在一种蛋白依赖调控的“细胞核浆转位机制”[11]。尽管要更好地理解GPCRs在其亚细胞水平定位中所扮演的角色仍需要更多的研究,但至少目前可以推测在亚细胞水平上检测到的GPER可能涉及其下游的信号转导活性。乳腺癌细胞中不同亚细胞水平定位的GPER可以反映出不同的生物学特性,表现最明显的是细胞质的GPER表达与非导管的组织学亚型、高分化的乳腺癌显著相关,然而细胞核的GPER表达则与低分化癌以及三阴性乳腺癌相关[36]。总体来说,目前大多数观点认为GPER定位在细胞内质网上,但其更加确切的亚细胞定位以及相关功能机制仍需进一步研究。
对于GPER的另一个争论点主要在于其介导促细胞凋亡的生物学功能,而该作用可能阻止乳腺癌的进展。例如,Chimento等[37]发现橄榄苦苷(oleuropein,OL)和羟基酪醇(hydroxytyrosol,HT)化合物可作为GPER反向激动剂,在ER(-)的SKBR3乳腺癌细胞中显示出其抑制细胞增殖的能力,他们提出其机制为OL和HT结合GPER介导持续的ERK1/2活化而触发细胞凋亡。同样,之前的研究也证明G-1具有通过GPER激活促凋亡信号阻碍乳腺癌细胞生长的作用[38]。但也有研究发现,GPER拮抗剂G-15预处理的MDA-MB 231乳腺癌细胞(低表达GPER),在使用G-1后其细胞生长得到了抑制;他们还发现G-1抑制卵巢癌细胞增殖没有GPER的参与,从而证明促凋亡特性可能以一种不依赖GPER的独立方式引出[39, 40]。根据以上研究结果,无论GPER是否存在介导促细胞凋亡的潜在功能,G-1都有可能成为抑制乳腺癌以及卵巢癌的候选药物。
3 结论尽管GPER在乳腺癌中的作用仍存在争议,但至少目前已有研究结果明确GPER在不同的病理生理反应中都可以作为一种雌激素受体,并且GPER的调控以及功能在ER(+)乳腺癌TAM耐药及三阴性乳腺癌中扮演着极为重要的角色。此外,基于传统抗雌激素药物在改善乳腺癌预后方面存在的不足,使针对GPER信号转导通路创造新型药物进行分子靶向治疗成为今后研究的一个有效策略。从分子水平靶向识别两种不同类型的雌激素受体可能进一步降低乳腺癌的发病率和复发率。
| [1] | Vogel VG, Costantino JP, Wickerham DL, et al. Update of theNational Surgical Adjuvant Breast and Bowel Project Study ofTamoxifen and Raloxifene (STAR) P-2 Trial: Preventing breastcancer[J]. Cancer Prev Res (Phila), 2010, 3(6): 696-706. |
| [2] | Cuzick J, Powles T, Veronesi U, et al. Overview of the mainoutcomes in breast-cancer prevention trials[J]. Lancet, 2003,361(9354): 296-300. |
| [3] | Mo Z, Liu M, Yang F, et al. GPR30 as an initiator of tamoxifenresistance in hormone-dependent breast cancer[J]. Breast CancerRes, 2013, 15(6): R114. |
| [4] | Filardo E, Quinn J, Pang Y, et al. Activation of the novel estrogenreceptor G protein-coupled receptor 30 (GPR30) at the plasmamembrane[J]. Endocrinology, 2007, 148(7): 3236-45. |
| [5] | Otto C, Rohde-Schulz B, Schwarz G, et al. G protein-coupledreceptor 30 localizes to the endoplasmic reticulum and is notactivated by estradiol[J]. Endocrinology, 2008, 149(10): 4846-56. |
| [6] | Atanas Ignatov, Tanja Ignatov, et al. G-protein-coupled estrogenreceptor GPR30 and tamoxifen resistance in breast cancer[J].Breast Cancer Res Treat, 2011, 128: 457-66. |
| [7] | Madeo A, Maggiolini M. Nuclear alternate estrogen receptorGPR30 mediates 17beta-estradiol-induced gene expression andmigration in breast cancer-associated fibroblasts[J]. Cancer Res,2010, 70(14): 6036-46. |
| [8] | Ignatov A, Ignatov T, Roessner A, et al. Role of GPR30 in themechanisms of tamoxifen resistance in breast cancer MCF-7cells[J]. Breast Cancer Res Treat, 2010, 123(1): 87-96. |
| [9] | Filardo EJ, Quinn JA, Bland KI, et al. Estrogen-induced activation of Erk-1 and Erk-2 requires the G protein-coupled receptorhomolog, GPR30 and occurs via trans-activation of the epidermalgrowth factor receptor through release of HB-EGF[J]. MolEndocrinol, 2000, 14(10): 1649-60. |
| [10] | Filardo EJ, Quinn JA, Frackelton AR Jr, et al. Estrogen action viathe G protein-coupled receptor, GPR30: stimulation of adenylylcyclase and cAMP-mediated attenuation of the epidermal growthfactor receptor-to-MAPK signaling axis[J]. Mol Endocrinol, 2002,16(1): 70-84. |
| [11] | Pupo M, Vivacqua A, Perrotta I, et al. The nuclear localizationsignal is required for nuclear GPER translocation and functionin breast cancer-associated fibroblasts (CAFs)[J]. Mol CellEndocrinol, 2013, 376(1-2): 23-32. |
| [12] | Lappano R, Rosano C, De Marco P, et al. Estriol acts as a GPR30antagonist in estrogen receptor-negative breast cancer cells[J].Mol Cell Endocrinol, 2010, 320(1-2): 162-70. |
| [13] | Maggiolini M, Picard D. The unfolding stories of GPR30, anew membrane-bound estrogen receptor[J]. J Endocrinol, 2010,204(2): 105-14. |
| [14] | Liu H, Yan Y, Wen H, et al. A novel estrogen receptor GPERmediates proliferation induced by 17β-estradiol and selectiveGPER agonist G-1 in estrogen receptor α (ERα)-negative ovariancancer cells [J]. Cell Biol Int, 2014, 38(5): 631-8. |
| [15] | Lappano R, Rosano C, Santolla MF, et al. Two novel GPERagonists induce gene expression changes and growth effects incancer cells[J]. Curr Cancer Drug Targets, 2012, 12(5): 531-42. |
| [16] | Lappano R, Santolla MF, Pupo M, et al. MIBE acts as antagonistligand of both estrogen receptor α and GPER in breast cancercells[J]. Breast Cancer Res, 2012, 14(1): R12. |
| [17] | Ren J, Guo H, Wu H, et al. GPER in CAFs regulates hypoxiadrivenbreast cancer invasion in a CTGF-dependent manner[J].Oncol Rep, 2015, 33(4): 1929-37. |
| [18] | Li Y, Chen Y, Zhu ZX, et al. 4-Hydroxytamoxifen-stimulatedprocessing of cyclin E is mediated via G protein-coupled receptor30 (GPR30) and accompanied by enhanced migration in MCF-7breast cancer cells[J]. Toxicology, 2013, 309: 61-5. |
| [19] | Pupo M, Pisano A, Abonante S, et al. GPER activates Notchsignaling in breast cancer cells and cancer-associated fibroblasts(CAFs) [J]. Int J Biochem Cell Biol, 2014, 46: 56-67. |
| [20] | Jiang QF, Wu TT, Yang JY, et al. 17β-estradiol promotes theinvasion and migration of nuclear estrogen receptor-negativebreast cancer cells through cross-talk between GPER1 andCXCR1[J]. J Steroid Biochem Mol Biol, 2013, 138: 314-24. |
| [21] | Ohshiro K, Schwartz AM, Levine PH, et al. Alternate estrogenreceptors promote invasion of inflammatory breast cancer cellsvia non-genomic signaling[J]. PLoS One, 2012, 7(1): e30725. |
| [22] | Chen Y, Li Z, He Y, et al. Estrogen and pure antiestrogenfulvestrant (ICI 182 780) augment cell-matrigel adhesion ofMCF-7 breast cancer cells through a novel G protein coupledestrogen receptor (GPR30)-to-calpain signaling axis[J]. ToxicolAppl Pharmacol, 2014, 275(2): 176-81. |
| [23] | Marchese S, Silva E. Disruption of 3D MCF-12A breast cell culturesby estrogens-an in vitro model for ER-mediated changes indicativeof hormonal carcinogenesis[J]. PLoS One, 2012, 7(10):e45767. |
| [24] | Scaling AL, Prossnitz ER, Hathaway HJ. GPER mediatesestrogen-induced signaling and proliferation in human breastepithelial cells and normal and malignant breast[J]. Horm Cancer,2014, 5(3): 146-60. |
| [25] | De Marco P, Bartella V, Vivacqua A, et al. Insulin-like growthfactor-I regulates GPER expression and function in cancer cells[J].Oncogene, 2013, 32(6): 678-88. |
| [26] | De Francesco EM, Lappano R, Santolla MF,et al. HIF-1α/GPERsignaling mediates the expression of VEGF induced by hypoxia inbreast cancer associated fibroblasts (CAFs)[J]. Breast Cancer Res,2013, 15(4): R64. |
| [27] | Raffo D, Pontiggia O, Bal de Kier Joffé E, et al. Epidermalgrowth factor induces G protein-coupled receptor 30 expressionin estrogen receptor-negative breast cancer cells[J]. Oncol Rep,2015, 33(1): 439-47. |
| [28] | Albanito L, Sisci D, Aquila S, et al. Epidermal growth factorinduces G protein-coupled receptor 30 expression in estrogenreceptor-negative breast cancer cells[J]. Endocrinology, 2008,149(8): 3799-808. |
| [29] | Sjöström M, Hartman L, Grabau D, et al. Lack of G proteincoupledestrogen receptor (GPER) in the plasma membrane isassociated with excellent long-term prognosis in breast cancer[J].Breast Cancer Res Treat, 2014, 145(1): 61-71. |
| [30] | Vivacqua A, Romeo E, De Marco P, et al. GPER mediates theEgr-1 expression induced by 17β-estradiol and 4-hydroxitamoxifenin breast and endometrial cancer cells[J]. Breast Cancer Res Treat,2012, 133(3): 1025-35. |
| [31] | Luo H, Yang G, Yu T, et al. GPER-mediated proliferation andestradiol production in breast cancer-associated fibroblasts[J].Endocr Relat Cancer, 2014, 21(2): 355-69. |
| [32] | den Hollander P, Savage MI, Brown PH. Targeted therapy forbreast cancer prevention[J]. Front Oncol, 2013, 3: 250. |
| [33] | Tu G, Hu D, Yang G, et al. The correlation between GPR30 andclinicopathologic variables in breast carcinomas[J]. TechnolCancer Res Treat, 2009, 8(3): 231-4. |
| [34] | Yu T, Liu M, Luo H, et al. GPER mediates enhanced cell viabilityand motility via non-genomic signaling induced by 17β-estradiolin triple-negative breast cancer cells[J]. J Steroid Biochem MolBiol, 2014, 143: 392-403. |
| [35] | Steiman J, Peralta EA, Louis S, et al. Biology of the estrogenreceptor, GPR30, in triple negative breast cancer[J]. Am J Surg2013, 206(5): 698-703. |
| [36] | Samartzis EP, Noske A, Meisel A, et al. The G protein-coupledestrogen receptor (GPER) is expressed in two different subcellularlocalizations reflecting distinct tumor properties in breastcancer[J]. PLoS One, 2014, 9(1): e83296. |
| [37] | Chimento A, Casaburi I, Rosano C, et al. Oleuropein andhydroxytyrosol activate GPER/GPR30-dependent pathwaysleading to apoptosis of ER-negative SKBR3 breast cancer cells[J].Mol Nutr Food Res, 2013, 58(3): 478-89. |
| [38] | Ariazi EA, Brailoiu E, Yerrum S, et al. The G protein-coupledreceptor GPR30 inhibits proliferation of estrogen receptor-positivebreast cancer cells[J]. Cancer Res, 2010, 70(3): 1184-94. |
| [39] | Wang C, Lv X, Jiang C, et al. The putative G-protein coupledestrogen receptor agonist G-1 suppresses proliferation of ovarianand breast cancer cells in a GPER-independent manner[J]. Am JTransl Res, 2012, 4(4): 390-402. |
| [40] | Wang C, Lv X, He C, et al. The G-protein-coupled estrogenreceptor agonist G-1 suppresses proliferation of ovarian cancercells by blocking tubulin polymerization[J]. Cell Death Dis, 2013,4: e869. |
 2015, Vol. 42
2015, Vol. 42