文章信息
- 赵瑞华, 姜文静, 张伟杰, 曹新广.
- ZHAO Ruihua, JIANG Wenjing, ZHANG Weijie, CAO Xinguang.
- 食管中段鳞癌组织中MALAT1的表达及其与预后的关系
- Metastasis‑associated Lung Adenocarcinoma Transcript1(MALAT1) Expression in Middle Thoracic Esophageal Squamous Cell Cancer Tissues and Its Relationship with Prognosis
- 肿瘤防治研究, 2015, 42(12): 1227-1230
- Cancer Research on Prevention and Treatment, 2015, 42(12): 1227-1230
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.12.012
-
文章历史
- 收稿日期: 2015-05-27
- 修回日期: 2015-08-05
2. 450052 郑州,河南省肿瘤医院普外科
2. Department of General Surgery, He’nan Cancer Hospital, Zhengzhou 450052, China
目前食管癌患者术后5年生存率仍低于50%[1]。尽管已发现许多遗传学及表观遗传学异常与食管鳞癌的发生发展相关,但迄今为止,食管鳞癌发生发展的分子机制仍未被完全阐明,缺少有效的分子靶点及分子标志物来预测疗效。
MALAT1是一个长度超过8 000 nt的非编码RNA,定位于染色体11q13.1,在人肺、胰腺及其他正常组织中均显著表达,种族之间高度保守,提示它可能具有重要的生物学功能。近来研究证实MALAT1参与了肿瘤的转移和复发进程[2, 3]。但MALAT1在食管鳞癌中的表达及功能尚无报道。本研究中应用qRT-PCR检测77例接受食管癌根治术治疗的食管中段鳞癌患者肿瘤组织及对应癌旁组织中MALAT1的表达水平,分析MALAT1的表达与食管鳞癌患者临床病理特征及预后的关系,现报道如下。
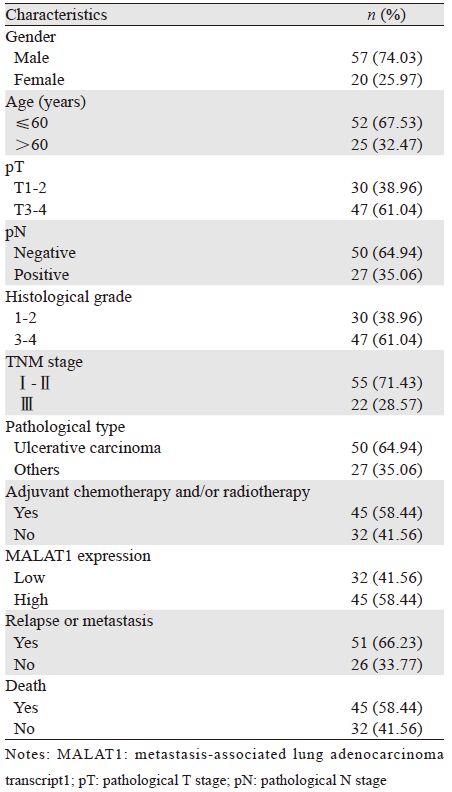
1 资料与方法 1.1 一般资料及组织标本77例新鲜肿瘤组织及相应的癌旁组织标本取自于2003年5月至2007年8月在河南省肿瘤医院接受食管癌根治术治疗的食管中段鳞癌患者。标本采集后立即存放在无RNA酶的冻存管中,-80°C保存备用。采用2010年WHO病理分级标准对肿瘤进行组织学分级;根据AJCC第七版食管癌分期系统对患者进行术后分期;数据资料主要通过病历回顾及电话随访获得。患者的临床病理特征详见表 1。本研究通过河南省肿瘤医院医学研究伦理委员会的批准和许可,所有的研究对象签署了知情同意书。
 |
应用TRIzol 法提取癌组织及癌旁组织总RNA,用PrimeScriptTM反转录试剂盒(TakaraBio Inc公司,日本)根据说明书进行反转录合成cDNA。采用荧光定量PCR试剂盒(Takara BioInc,日本)和罗氏LightCycler 480检测系统进行荧光定量PCR检测。根据试剂盒说明书,采用20 μl体系,GAPDH为内参。其中MALAT1的引物序列为:上游:5′-CAGTGGGGAACTCTGACTCG-3′,下游:5′-GTGCCTGGTGCTCTCTTACC-3′。GAPDH的引物序列为:上游:5′-GTCAACGGATTTGGTCTGTATT-3′,下游:5′-AGTCTTCTGGGTGGCAGTGAT-3′。扩增45个循环,每个循环包括95°C 30 s和60°C 1 min。设定统一的CT值分析实验结果,取3次实验的平均值。采用癌旁组织的中位CT值作为标准对照,应用2-ΔΔCT方法计算样本中MALAT1的相对表达水平。并根据文献报道采用肿瘤组织中MALAT1/GAPDH比值6.15作为临界值,将患者分为MALAT1高表达组和低表达组[2]。
1.3 统计学方法采用t 检验比较肿瘤组织和癌旁组织中MALAT1的表达水平,卡方检验分析肿瘤组织中MALAT1的表达水平与临床病理特征的关系。单因素分析和多因素分析检测包括MALAT1表达在内的多种临床病理特征对OS和DFS的影响。Kaplan-Meier生存曲线及Cox比例风险回归模型计算患者的生存率。其中总生存(overall survival,OS)为从手术开始至死亡或最后一次随访的时间。无疾病进展生存(disease free survival,DFS)为自手术开始至局部复发或远处转移或最后一次随访的时间。P值为双向性检验,检验水准为α=0.05,所有数据采用SPSS19.0和GraphPad Prism5.01分析。
2 结果 2.1 食管鳞癌患者肿瘤组织中MALAT1的表达肿瘤组织中MALAT1的表达水平明显高于癌旁组织[(3.886±0.343)vs.(1.483±0.124),P<0.001]。
2.2 MALAT1的表达水平与患者临床病理特征之间的关系肿瘤组织中MALAT1的表达仅与患者T分期即浸润深度显著相关(P=0.01),而与其他临床病理特征如患者年龄、性别、淋巴结状态、TNM分期、组织学分级、病理类型等无关(P>0.05)。高MALAT1表达组的患者倾向于更高的浸润程度,见表 2。
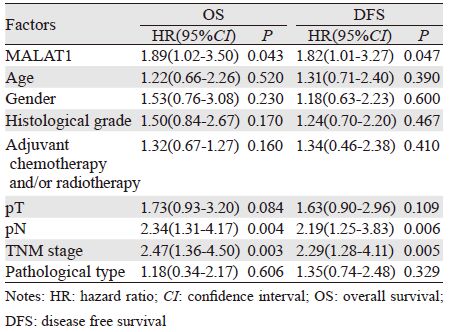 |
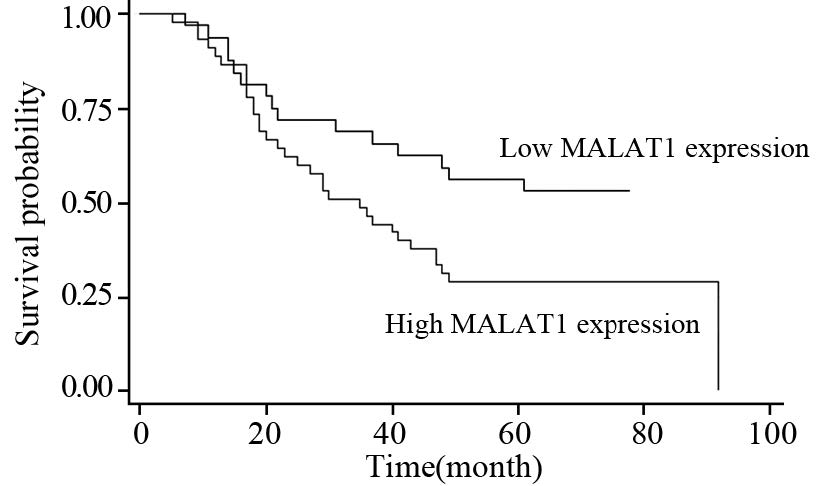
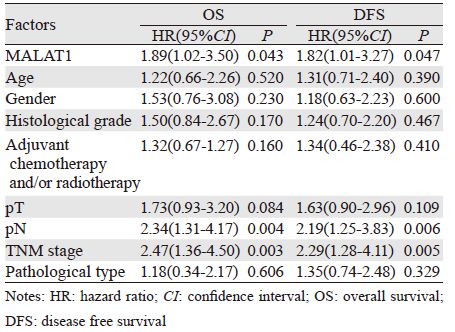
患者的中位随访时间为37月(5~92月)。其中45例MALAT1高表达患者中,34例(75.56%)出现局部复发或远处转移,33例 (73.33%)死亡。而3 2 例MALAT1 低表达患者中有1 7 例( 5 3 . 1 3%) 出现局部复发或远处转移,1 5 例(46.88%)死亡。与低表达组相比,MALAT1高表达组的DFS和OS显著缩短(P=0.04和0.038),见图 1、2。采用单因素方差分析临床病理因素、组织MALAT1表达水平与DFS和OS的相关性,从结果中可以看出与DFS和OS相关的因素包括淋巴结状态、TNM分期和组织MALAT1的表达高低,见表 3。进一步采用多因素回归分析各因素与DFS和OS的相关性,结果显示TNM分期为独立的预测DFS和OS的因素,见表 4。

|
| 图 1 Kaplan-Meier显示MALAT1表达与食管鳞癌患者DFS的关系 Figure 1 Kaplan-Meier curves of correlation of MALAT1 expression with ESCC patients’ DFS |
|
| 图 2 Kaplan-Meier显示MALAT1表达与食管鳞癌患者OS的关系 Figure 2 Kaplan-Meier curves of correlation of MALAT1 expression with ESCC patients’ OS |
 |
 |
食管癌居全球恶性肿瘤相关死亡原因的第六位,其分布地区变异性很大。在中国、印度等食管癌高发区,90%以上患者为鳞癌,约50%食管鳞癌发生部位为食管中段。目前,食管癌根治术仍是治疗食管中段鳞癌的主要手段,但根治术后患者的预后不尽如人意,ⅡA~Ⅲ期患者单纯手术治疗的5年生存率仅为20%~34%[1]。到目前为止,仍然没有有效的指标可以确切地预测早期食管鳞癌患者的预后,因此早期食管鳞癌患者根治术后的个体化辅助治疗仍然是一个挑战。本研究中选取在河南省肿瘤医院行根治性切除术的食管中段鳞癌患者进行研究。
近年研究发现,LncRNA既可作为癌基因又可以作为抑癌基因在人类多种肿瘤中发挥重要作用。目前已有研究证实,分布于哺乳动物细胞核内的LncRNA MALAT1基因的表达异常与包括宫颈癌、肝癌、非小细胞肺癌、结直肠癌等在内的多种癌症的发生发展相关[2, 4, 5, 6]。如2003年的一项研究发现MALAT-1在非小细胞肺癌转移过程中的表达逐渐增加,并且其表达水平增高可以作为非小细胞肺癌预后不良的一个早期预测指标[6]。近期有研究揭示了MALAT1在肿瘤转移过程中的功能,MALAT1可通过在转录水平或转录后水平调控运动相关基因促进肺癌细胞的运动能力[7]。另外还有研究发现MALAT1可以抑制宫颈癌细胞的增殖及浸润功能,抑制CaSki细胞中MALAT1的表达可以上调Caspase-8、Caspase-3和Bax的表达,下调Bcl-2和Bcl-xL的表达[8]。本试验结果表明:与癌旁组织相比,食管癌组织MALAT1的表达水平明显增高(P<0.001),另外通过进一步分析食管鳞癌患者肿瘤组织中MALAT1表达与临床病理特征之间的关系,发现MALAT1高表达的患者中具有更高的T分期(P=0.01),而与其他临床病理特征如患者年龄、性别、淋巴结状态、TNM分期、组织学分级、病理类型等无关。Kaplan-Meier生存分析结果显示MALAT1高表达与患者的不良预后相关,MALAT1高表达组患者的DFS和OS显著缩短(P值分别为0.04和0.038)。多因素回归分析结果显示TNM分期和淋巴结状态为独立的预测DFS和OS的因素。本研究未能证实MALAT1表达水平及其他因素如T分期、辅助化疗和或辅助放疗对DFS和OS的影响,可能是因为:(1)本研究中纳入患者的样本量较小。在多因素回归分析中MALAT1表达水平对DFS和OS的风险比(HR)为1.73(95%CI=0.92~3.23,P=0.09)和1.71(95%CI=0.93~3.12,P=0.08),表明MALAT1或许可以作为DFS和OS的独立预测因子,但需扩大样本量对本实验的结果进行进一步验证;(2)病例选择:本研究仅是一项单中心的回顾性研究,只纳入了接受根治性手术的食管中段鳞癌患者。大部分患者是T3期以上(61.04%),淋巴结阴性(64.94%),Ⅰ~Ⅱ期的患者占71.43%,并且患者是否接受术后辅助治疗主要根据经济水平及患者的意愿来决定;(3)MALAT1的表达水平可能受到T分期的影响,因为本研究结果显示MALAT1的表达与T分期显著相关;(4)本研究未能建立一个确切的界值来定义MALAT1的表达水平,只能将癌旁组织的中位CT值作为标准对照计算肿瘤组织和癌旁组织MALAT1的相对表达水平,并且只能根据文献报道采用肿瘤组织中MALAT1/GAPDH比值6.15作为临界值,将患者分为MALAT1高表达组和低表达组[2]。因此,在进一步的研究中需要确定一个敏感度和特异性较高的MALAT1值,才有可能真正进入到临床应用。
总之,与癌旁组织相比,食管癌组织MALAT1的表达水平明显增高,并且MALAT1高表达的患者中具有更高T分期,MALAT1高表达组患者DFS和OS显著缩短,瘤组织中MALAT1表达水平可能作为一个预测接受根治手术治疗的食管中段鳞癌患者预后的指标。后续仍需要更多的研究来进一步证实MALAT1在食管鳞癌患者中的应用价值。
| [1] | Sjoquist KM, Burmeister BH, Smithers BM, et al. Survival afterneoadjuvant or chemotherapy or chemoradiotherapy for resectableoesophageal carcinoma: an updated meta-analysis[J]. LancetOncol, 2011, 12(7): 681-92. |
| [2] | Zheng HT, Shi DB, Wang YW, et al. High expression of lncRNAMALAT1 suggests a biomarker of poor prognosis in colorectalcancer[J]. Int J Clin Exp Pathol, 2014, 7(6): 3174-81. |
| [3] | Lai MC, Yang Z, Zhou L, et al. Long non-coding RNA MALAT-1overexpression predicts tumor recurrence of hepatocellularcarcinoma after liver transplantation[J]. Med Oncol, 2012, 29(3):1810-6. |
| [4] | Jiang Y, Li Y, Fang S, et al. The role of MALAT1 correlates withHPV in cervical cancer[J]. Oncol Lett, 2014, 7(6): 2135-41. |
| [5] | Mohamadkhani A. Long noncoding RNAs in interaction withRNA binding proteins in hepatocellular carcinoma[J]. Hepat Mon,2014, 14(5): e18794. |
| [6] | Ji P, Diederichs S, Wang W, et al. MALAT-1, a novel noncodingRNA, and thymosin beta4 predict metastasis and survival in earlystagenon-small cell lung cancer[J]. Oncogene, 2003, 22(39):8031-41. |
| [7] | Schmidt LH, Spieker T, Koschmieder S, et al. The long noncodingMALAT-1 RNA indicates a poor prognosis in non-small celllung cancer and induces migration and tumor growth[J]. J ThoracOncol, 2011, 6(12): 1984-92. |
| [8] | Gutschner T, Diederichs S. The hallmarks of cancer: a long noncodingRNA point of view[J]. RNA Biol, 2012, 9(6): 703-19. |
 2015, Vol. 42
2015, Vol. 42