文章信息
- 李伟, 彭俊琴, 李建生, 汤日杰.
- LI Wei, PENG Junqin, LI Jiansheng, TANG Rijie.
- MR表观扩散系数预测鼻咽癌放疗敏感度及相关因素分析
- MR Apparent Diffusion Coefficient Predicts Sensitivity of Nasopharyngeal Carcinoma to Radiotherapy and Related Factors
- 肿瘤防治研究, 2015, 42(12): 1221-1226
- Cancer Research on Prevention and Treatment, 2015, 42(12): 1221-1226
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.12.011
-
文章历史
- 收稿日期: 2015-01-28
- 修回日期: 2015-03-18
2. 510095 广州,广州医科大学附属肿瘤医院 放射科
2. Department of Radiology, Cancer Hospital of Guangzhou Medical University, Guangzhou 510095, China
放射治疗是鼻咽癌根治性治疗的首选方法,但仍有一部分患者难以取得理想效果,甚至发生复发或转移。在治疗前预测鼻咽癌对于放射治疗的敏感度,对于放疗不敏感的患者提前进行相应干预处理,是提高鼻咽癌放射治疗效果和生存率、改善预后的重要措施。MR扩散加权成像作为一种无创性功能成像技术,能够通过表观扩散系数(apparent diffusion coefficient,ADC)观测组织水分子弥散运动状态的改变[1],在临床上应用越来越广泛。本研究通过回顾性分析97例鼻咽癌患者的放疗敏感度与ADC值的相关性,探讨水分子弥散运动状态改变与鼻咽癌放疗敏感度之间是否存在相关性,以及它们与病理类型、T分期的相关性。
1 资料与方法 1.1 病例选择从我院2010年4月—2013年10月的鼻咽癌初诊患者中,选择其中没有转移且接受单纯性根治性放疗的鼻咽癌初诊患者。其中部分为T3、T4期患者,由于存在一定程度肝肾功能异常,因此也进行单纯性根治性放疗。所有患者在治疗前均行MR扩散加权成像检查。最终入选患者共97例,其中包括男68例、女29例;年龄范围24~73岁,中位年龄48岁。对所有入选病例的MR资料、住院病例资料进行回顾性分析。
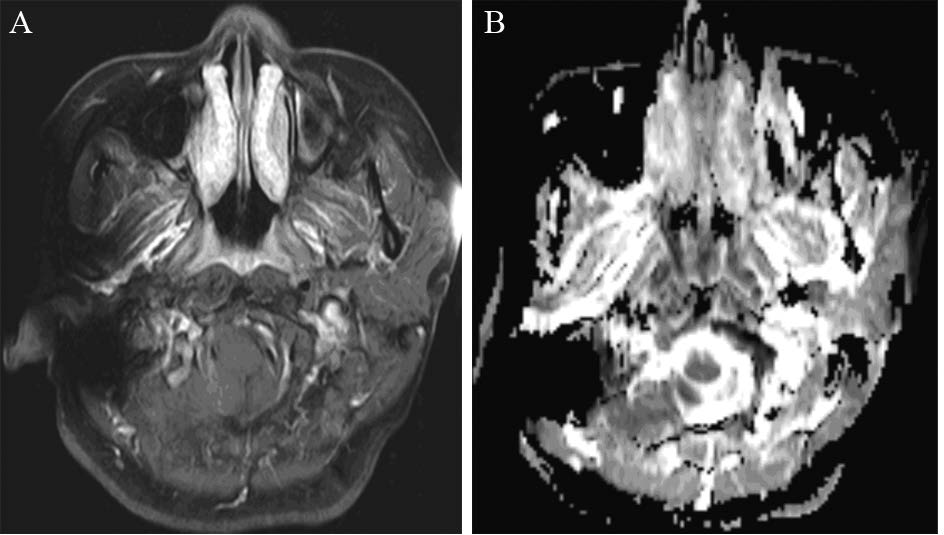
1.2 MR检查及ADC值所有的MR检查均是在飞利浦Achiver 1.5T MR扫描仪上完成。扫描时应用颈部相控阵线圈,扫描范围均包括颅底至下颌。平扫时应用自旋回波序列,包括横轴位T1WI、横轴位T2WI、矢状位压脂T2WI。增强扫描时的对比剂为钆布醇注射液,0.1 mmol/kg。扩散加权成像序列采用回波平面技术(EPI)、单次激发(SE-EPI)序列和压脂扫描技术,并且选择b值(0,800)s / mm2 进行横轴面扫描,见图 1。
|
| A: T1WI fat-suppression enhancement image showed nasopharyngeal carcinoma through the thickened nasopharyngeal mucosa; B: the ADC value of the right nasopharyngeal mucosa was relatively lower,0.853× 10-3mm2/s; ADC: apparent diffusion coefficient 图 1 患者治疗前MR(A)和ADC(B)图像 Figure 1 MR(A) and ADC(B) images of the patient before treatment |
先利用MR常规平扫序列图像及增强扫描图像,在横轴位上肿瘤最大体积层面确定肿瘤灶实性区范围,然后在ADC图上相应层面的肿瘤灶实性区内信号最低的区域划定直径约3~5 mm的感兴趣区(region of interest,ROI),由计算机自动获取ROI的ADC值,以其中的平均ADC值作为研究对象。ROI应尽量避开肿瘤边缘区、血管走行区、坏死区。
1.3 住院病例资料分析所有入选患者均为住院患者,均有住院病历记录资料。根据住院病历记录资料获取各病例的放疗敏感度、病理分型、T分期等数据。
1.3.1 放疗敏感度与分组所有患者首次治疗均为单纯性根治性放射治疗,设置鼻咽大体肿瘤体积(gross tumor volume,GTV)的总放疗剂量为66~78 Gy,约分31~39次完成全部放疗计划。在完成放射治疗的1~2周内通过影像学检查(CT和MR)对治疗效果进行评价记录。按照实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST),分为CR(完全缓解,即肿瘤灶完全消失)、PR(部分缓解,即肿瘤灶相互垂直最大径总和减少≥30%)、SD(病变稳定,即介于PR与PD之间)、PD(病变进展,即肿瘤灶相互垂直最大径总和增加≥20%或出现新病灶)。以此作为放疗敏感度数据,其中CR、PR定义为放疗敏感组,而SD、PD则定义为放疗抗拒组。本研究97例患者最终确定为CR 64例、PR 10例、SD 14例、PD 9例。
1.3.2 病理分型所有患者在治疗前均有明确病理分型结果。按照鼻咽癌WHO分型标准分为角化型鳞状细胞癌、非角化型分化型癌、非角化型未分化癌三种。所有病理分型结果均来源于住院病历中记载,由我院病理科专业人员分析所得。本研究的所有样本病例中,均不存在角化型鳞状细胞癌。
1.3.3 T分期住院病例记录中,临床医生综合各种检查方法参照鼻咽癌2008分期方案对鼻咽癌病灶作出TNM分期。所有入选患者均没有发生转移,即均为N0M0期。选择其中的T分期数据作为本次研究对象。
1.4 数据分析及统计学方法分析鼻咽癌放疗敏感度分别与年龄、性别、肿瘤实性灶ADC值、病理分型、T分期之间的相关性,以及性别、年龄、病理分型、T分期对于ADC值的影响。所有数据均应用SPSS 13.0统计软件包进行统计学分析。对于多组间连续性资料的比较采用方差分析,两组之间的比较采用t检验。P<0.05为差异具有统计学意义。对于离散型资料之间的比较采用χ2检验。通过ROC曲线(受试者工作特征曲线)的Az值(曲线下面积)来判断ADC值预测鼻咽癌放疗敏感度的价值,并寻找最佳诊断阈值。
2 结果 2.1 分组结果根据放疗结果,归于放疗敏感组74例,男51例、女23例,年龄范围(24~68)岁,中位年龄47.5岁。归于放疗抗拒组23例,男17例、女6例,年龄范围(31~73)岁,中位年龄47岁。两组在性别、年龄方面差异均无统计学意义(t=1.652,P=0.102; χ2=0.209,P=0.648)。
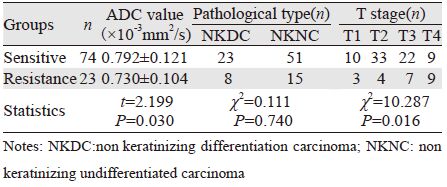
2.2 两组放疗敏感度与ADC值、病理分型及T分期结果放疗敏感组的ADC值低于放疗抗拒组,差异有统计学意义。放疗敏感组与放疗抗拒组在T分期方面差异有统计学意义,在病理分型方面差异无统计学意义,见表 1。
 |
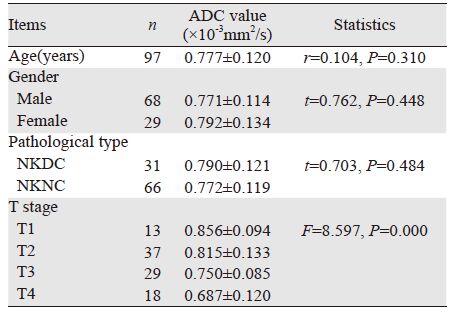
ADC值与年龄不存在线性关系。男性的ADC值略低于女性,但是差异无统计学意义。
非角化型分化型癌的ADC值略低于非角化型未分化癌,两者之间差异无统计学意义。
各T 分期的A D C 值由大到小依次为T1>T2>T3>T4。T分期间总体上差异有统计学意义。随着T分期的增高,ADC值呈现下降趋势。其中T1与T3、T1与T4、T2与T3、T2与T4、T3与T4之间差异均有统计学意义(P=0.000、0.000、0.000、0.000、0.002),但是T1与T2之间差异无统计学意义(P=0.060),见表 2。
 |
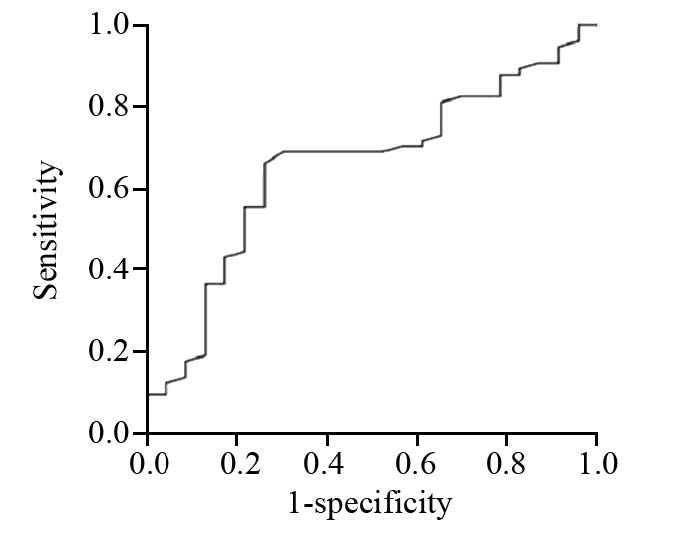
ADC值预测鼻咽癌放疗敏感度的Az 值为(0.657±0.063)。当ADC值取0.737×10-3 mm2/s为诊断阈值时,其诊断价值最大,敏感度为68.9%,特异性为69.6%,见图 2。
|
| 图 2 ADC值预测鼻咽癌放疗敏感度的ROC曲线图 Figure 2 ROC curve to predict sensitivity of NPC patients to radiotherapy through ADC value |
T 分期预测鼻咽癌放疗敏感度的A z 值为(0.661±0.071)。以T2作为诊断阈值时,其诊断价值最大,敏感度为69.6%,特异性为58.1%,见图 3。
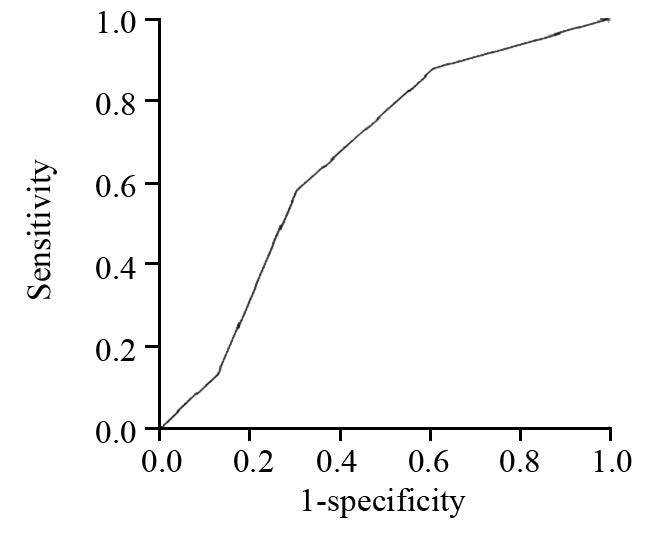
|
| 图 3 T分期预测鼻咽癌放疗敏感度的ROC曲线图 Figure 3 ROC curve to predict sensitivity of NPC patients to radiotherapy through T stage |
鼻咽癌在我国华南地区发生率很高,特别是广东地区的发病率处于世界首位,所以又被称为“广东癌”[2, 3],是目前世界上唯一以地区命名的恶性肿瘤。目前放射治疗是公认的治疗鼻咽癌的首选方法。虽然大部分鼻咽癌对于放射治疗比较敏感,但是仍有一些患者很难取得满意治疗效果,有报道鼻咽癌常规放疗后仍有18%左右残留,产生放疗抵抗[4]。对于这些患者,临床上一般会在放射治疗的基础上辅之以相应的化疗或靶向治疗等抗肿瘤手段,以提高治疗效果。但是化疗等抗肿瘤治疗方法本身对于身体就有极大的损害,不能盲目增加这些治疗手段,特别是对于放疗敏感的患者,以免造成过度治疗及身体的额外损害。所以在治疗前能够预测鼻咽癌病灶的放疗敏感度,将有助于临床判断是否应进行相应化疗等抗肿瘤干预,对于改进鼻咽癌预后有重要意义。所以本研究针对鼻咽癌放疗敏感度进行研究,探讨通过相关功能影像检查指标预测放疗敏感度的可行性。
传统影像学检查手段在肿瘤临床方面主要应用于发现肿瘤灶、诊断与鉴别诊断,其次用于比较治疗前后肿瘤大小及形态变化、随访观察肿瘤治疗后是否复发,但是尚较少直接应用于评估和预测治疗效果。目前影像学检查技术已经由传统的形态影像向功能影像技术发展,如PET、CT灌注成像、MR弥散加权成像、MR波谱成像等。其中MR扩散加权成像由于图像模糊不清、分辨力差,较少直接用于肿瘤灶的诊断,而是作为辅助诊断手段,主要反应组织的水分子弥散运动状态,并可以通过ADC值进行量化分析。当组织间隙变小时,水分子弥散运动受到限制,则在MR弥散加权成像上表现为组织的ADC值降低[4, 5, 6]。而按照放射治疗的B-T定律[7],鼻咽癌的放疗敏感度与肿瘤细胞的分裂活性呈正比,与分化程度呈反比。肿瘤细胞增殖活跃会导致肿瘤组织细胞密度增高而细胞间隙相应缩小,从而影响水分子弥散运动。水分子弥散运动与组织间隙有关,组织间隙又与细胞密度有关,而肿瘤细胞密度又与细胞增殖活性有关,而增殖活性决定了肿瘤细胞对于放射治疗的敏感度。因此ADC值作为能代表水分子弥散运动的一个量化指标,理论上ADC值就有可能在一定程度上通过评价组织间隙变化而预测鼻咽癌的放疗敏感度。
根据B-T定律,放疗敏感度与肿瘤细胞的增殖活性有关。一般来说病理上恶性程度越高的肿瘤,其增殖活性越高。本组病例都为非角化型癌,理论上来说其中未分化型应该比分化型癌具有更高的放疗敏感度。但是本研究结果却发现鼻咽癌的放疗敏感度在这2型病理类型之间并没有明显差异,而发现放疗敏感度与肿瘤T分期存在相关性,表现为T分期越高放疗敏感度越差。这可能是因为这2型鼻咽癌都对放疗敏感,虽然在理论上可能存在一定差异,但是其差异本身就不大,而且样本数据在其它如T分期等因素的影响下,就表现为差异不明显了。而T分期的本质是反应肿瘤的生长时间,T分期越高意味着肿瘤生长时间越长,肿瘤体积越大,肿瘤内部乏氧状态越严重,而肿瘤内的处于乏氧生存状态的肿瘤细胞正是导致放射治疗敏感度降低的原因。这与临床实践是符合的,已经有许多相关文献报道[8, 9, 10]可以证实。
本研究结果发现放疗敏感组的ADC值高于放疗抗拒组,说明放疗抗拒组的肿瘤灶细胞密度更高。本研究结果亦发现ADC值与T分期存在相关性,随着T分期的升高,ADC表现出下降趋势。而T分期越高,放疗效果越差,越容易产生放疗抗拒。这整体上说明,ADC值用于预测鼻咽癌放疗敏感性是可行的。随诊肿瘤细胞的不断增殖,肿瘤灶逐渐长大,T分期不断增加,肿瘤灶内部细胞密度增大,细胞间隙减小,水分子弥散受显著,而表现为ADC值减小。而肿瘤的供血血管的生长速度慢于肿瘤灶的生长,因此肿瘤内部将处于缺血缺氧状态,部分肿瘤细胞可发生坏死,同时亦有部分肿瘤细胞因此失去增殖活性而进入乏氧休眠状态。而正是这些处于乏氧休眠状态的肿瘤细胞对于放射性治疗不敏感,从而产生放疗抗拒。也可以说,随着ADC值的降低,鼻咽癌肿瘤灶内处于乏氧生存的肿瘤细胞增多,而越容易产生放疗抗拒。本研究结果亦可以总结为,鼻咽癌病灶的放疗敏感度随着ADC值的降低而呈现出逐渐下降的趋势。目前相似研究的文献报道尚多见,但是根据已有的一些报道,发现它们的研究结果各不相同,存在矛盾和不一致。例如,Hong等[11]认为只有放疗前后的ADC变化程度才能预测鼻咽癌放疗敏感度,而放疗前、放疗后的ADC值均没有预测价值;但是林蒙等[12]却认为鼻咽癌治疗前的ADC值能够预测鼻咽癌同步放化疗的敏感度。于小平等[13]认为ADC值难以区分不同T分期NPC之间在水分子扩散方面的差别;但是朱培杨等[14]却发现鼻咽癌T分期与ADC值呈线性相关,DWI对NPC的T分期评估有较高的应用价值。虽然它们的研究方法也存在一定的差别,主要是ROI设置、病例选择、DWI参数的不同,这些不同的研究方法有可能导致不同的研究结论。但是总的来说,对于ADC值与鼻咽癌疗效之间相关性的研究,还有待学术界进一步深入研究与明确结果。
MR弥散加权成像检查前无需特殊准备,扫描时间短,无明显禁忌证,适用于绝大部分MR检查的患者。而且在检查过程中,弥散加权成像无需注射对比剂,因此机体组织的ADC值都相对来说是固定不变的,不会随着检查时间的变化而变化。而其他需要注射药物才能实现的影像检查,如CT增强扫描的CT值[15, 16]、核医学PET检查的SUV[17, 18]、核医学的乏氧显像[19, 20]等,其数值并不是固定的而是动态变化的,与组织的血流灌注及药物血浆清除率有关,其数值会随着药物注射时间的变化而变化。因此ADC值相对来说较少受到其它信息(如血流灌注)的影响,能更加准确地反应组织内的生物功能信息。所以利用ADC值预测鼻咽癌放疗效果,不仅是可行的,而且是无创的、便捷的、可靠的。
综上所述,ADC值有望成为预测鼻咽癌放疗敏感度的有效手段,促进鼻咽癌的个体化治疗,提高鼻咽癌整体治疗效果,具有积极的临床指导意义。
| [1] | Koh DM, Collins DJ. Diffusion-weighted MRI in the body:applications and challenges in oncology[J]. AJR Am JRocentgenol, 2007, 188(6): 1622-35. |
| [2] | Li W, Lu BG, Fu WH, et al. The value of multi-slice spiral CT inthe follow-up of the patients with nasopharyngeal carcinoma[J].Guangdong Yi Xue, 2012, 33(2): 231-3. [李伟, 卢斌贵, 傅文海, 等. 多层螺旋CT在鼻咽癌预后随访中的价值[J]. 广东医学,2012, 33(2): 231-3.] |
| [3] | Pan JJ, Zong JF. consideration of multi-disciplinary treatmentstrategy in the mode of IMRT for NPC[J]. Zhongguo Zhong LiuLin Chuang, 2012, 39(24): 1989-92. [潘建基, 宗井凤. 调强放射治疗模式下鼻咽癌的多学科治疗策略的思考[J]. 中国肿瘤临床, 2012, 39(24): 1989-92.] |
| [4] | Bammer R. Basic principles of diffusion-weighted imaging [J].Eur J Radiol, 2003, 45(3): 169-84. |
| [5] | Li W, Lu BG, Fu WH, et al. The value of DWI in differentialdiagnosing benign and malignant nasopharyngeal lesions[J].Zhongguo Lin Chuang Yi Xue Ying Xiang Za Zhi, 2014, 25(11):13-6. [李伟, 卢斌贵, 傅文海, 等. 鼻咽黏膜DWI影像特点对于鼻咽良恶性病变判断的价值[J]. 中国临床医学影像杂志, 2014,25(11): 13-6.] |
| [6] | Chen YB, Mao Y, Pan JJ, et al. Clinical study of diffusion weightedimaging in nasopharyngeal carcinoma[J]. Zhonghua Fang SheZhong Liu Xue Za Zhi, 2009, 18(2): 88-91. [陈韵彬, 毛瑜, 潘建基, 等. 鼻咽癌弥散加权成像临床研究[J]. 中华放射肿瘤学杂志, 2009, 18(2): 88-91.] |
| [7] | Wan DS. Clinical Oncology[M]. 2nd ed. Beijing: ScientificPublication, 2007: 134-46. [万德森. 临床肿瘤学[M]. 2版.北京:科学出版社, 2007: 134-46.] |
| [8] | Wen G, Huang XB, Zhang WD, et al. Primary exploration ofindividual biological boosting target volume for locally advancednasopharyngeal carcinoma[J]. Zhonghua Yi Xue Za Zhi, 2012,92(45): 3207-10. [温戈, 黄晓波, 张卫东, 等. 局部晚期鼻咽癌个体化生物加量靶区探讨[J]. 中华医学杂志, 2012, 92(45):3207-10.] |
| [9] | Zhao WY, Sun XC. Progression of tumor radiosensitization[J].Lin Chuang Zhong Liu Xue Za Zhi, 2012, 17(7): 655-9. [赵维勇,孙新臣. 放射治疗增敏的研究现状[J]. 临床肿瘤学杂志, 2012,17(7): 655-9.] |
| [10] | Xie P, Hu M, Yu JM. Research progress of hypoxia imaging intumor radiotherapy[J]. Zhonghua Zhong Liu Xue Za Zhi, 2009,31(3): 161-3. [谢鹏, 胡漫, 于金明. 肿瘤放射治疗中乏氧显像的研究进展[J]. 中华肿瘤学杂志, 2009, 31(3): 161-3.] |
| [11] | Hong J, Yao Y, Zhang Y, et al. Value of magnetic resonancediffusion–weighted imaging for the prediction of radiosensitivityin nasopharyngeal carcinoma [J]. Otolarngol Head Neck Surg,2013, 149(5): 707-13. |
| [12] | Lin M, Yu XD, Luo DH, et al. Pretreatment MR diffusion weightedimaging predicts the sensitivity of concurrent chemoradiation innasopharyngeal carcinoma[J]. Zhonghua Fang She Xue Za Zhi,2014, 48(6): 467-71. [林蒙, 余小多, 罗德红, 等. MR扩散加权成像预测鼻咽癌患者同步放化疗疗效的可行性[J]. 中华放射学杂志, 2014, 48(6): 467-71.] |
| [13] | Yu XP, Li FP, Lu Q, et al. Correlation of MRI perfusionquantitative parameters and ADC value with the T stage ofnasopharyngeal carcinoma[J]. Fang She Xue Shi Jian, 2014,29(11): 1282-5. [于小平, 李飞平, 卢强, 等. 鼻咽癌磁共振灌注定量参数及ADC值与T分期的关系[J]. 放射学实践, 2014,29(11): 1282-5.] |
| [14] | Zhu PY, Zhou W, Huang XY. The diagnostic value of MRdiffusion weighted imaging in benign and malignant lesions of thenasopharynx and nasopharyngeal T staging[J]. Zhongguo XianDai Yi Sheng, 2014, 52 (36): 55-8. [朱培杨, 周玮, 黄小燕. MR扩散加权成像在鼻咽良恶性病变及鼻咽癌T分期中的诊断价[J].中国现代医生, 2014, 52(36): 55-8.] |
| [15] | Li W, Duan GF, Tang RJ. The relationship between CTenhancement degree and T stage in nasopharyngeal carcinoma[J].Guangdong Yi Xue, 2012, 33(6): 773-5. [李伟, 段光峰, 汤日杰.鼻咽癌CT强化程度与T分期的关系[J]. 广东医学, 2012, 33(6):773-5.] |
| [16] | Hou QL. Value of MSCT Perfusion Scanning for Predictingthe Radiosensitivity of Neck Lymph Node Metastasis inNasopharyngeal Carcinoma[J]. Yi Xue Lin Chuang Yan Jiu, 2010,27(8): 1439-43. [侯启龙. MSCT灌注扫描在鼻咽癌颈部转移淋巴结放疗敏感性预测中的价值[J]. 医学临床研究, 2010, 27(8):1439-43.] |
| [17] | Li J. Pan YD, Yin JL, et al. Analysis of standard uptake values of18F-FDG PET/CT in relation to pathological classification andclinical staging of nasopharyngeal carcinoma[J]. Nan Fang Yi KeDa Xue Xue Bao, 2008, 28(10): 1923-4. [黎静, 潘艳东, 尹吉林,等. 18F-FDG PET/CT标准化摄取值与鼻咽临床分期和病理类型的关系[J]. 南方医科大学学报, 2008, 28(10): 1923-4.] |
| [18] | Li H, Xie CM. Liu XW, et al. Comparative study of diffusionweighted imaging and PET-CT in the diagnosis of nasopharyngealcarcinoma[J]. Zhonghua Zhong Liu Xue Za Zhi, 33(10): 791-2. [李卉, 谢传淼, 刘学文, 等. 弥散加权成像与PET-CT对鼻咽癌诊断效力的比较研究[J]. 中华肿瘤学杂志, 2011, 33(10): 791-2.] |
| [19] | Zheng YJ, Zhao C, Fan W, et al. The atudy of hypoxia status ofthe primary lesion of nasoparyngeal carcinoma with 99Tcm-HL91imaging[J].Zhonghua He Yi Xue Za Zhi, 2008, 28(2): 100-2. [郑颖洁, 赵充, 樊卫, 等. 99Tcm-HL91显像评价鼻咽癌放疗前原发灶乏氧状况[J]. 中华核医学杂志, 2008, 28(2): 100-2.] |
| [20] | Eschmann SM, Paulsen F, Reimold M, et al. Prognostic impact ofhypoxia imaging with 18F-misonidazole PET in non-small celllung cancer and head neck cancer before radiotherapy[J]. J NuclMed, 2005, 46(2): 253-60. |
 2015, Vol. 42
2015, Vol. 42
