文章信息
- 何火聪,林少俊,林可焴,宗井凤,陈超,邹长棪,潘剑茹,苏颖
- HE Huocong, LIN Shaojun, LIN Keyu, ZONG Jingfeng, CHEN Chao, ZOU Changyan, PAN Jianru, SU Ying
- Annexin A2在鼻咽癌组织中的表达及其临床
- Expression of Annexin A2 in Nasopharyngeal Carcinoma Tissues and Its Clinical
- 肿瘤防治研究, 2015, 42(12): 1216-1220
- Cancer Research on Prevention and Treatment, 2015, 42(12): 1216-1220
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.12.010
-
文章历史
- 收稿日期: 2015-08-25
- 修回日期: 2015-10-21
2. 350014 福州,福建省肿瘤医院放疗科;
3. 350108 福州,福州大学生物科学与工程学院
2. Department of Radiotherapy, Fujian Provincial Tumor Hospital, Fuzhou 350014, China;
3. College of Biological Science and Engineering, Fuzhou University, Fuzhou 350108, China
鼻咽癌是我国南方常见的恶性肿瘤之一。放射治疗是鼻咽癌首选的治疗方法。虽然现在鼻咽癌5年的局部控制率可以达到80%~90%,但仍有一些患者治疗失败,局部复发和远处转移仍是死亡的主要原因,可能与肿瘤中存在或放疗过程中出现对射线抗拒的细胞成分有关[1, 2]。Annexin A2是钙离子依赖的磷脂结合蛋白,与肿瘤浸润、转移相关,现有研究表明Annexin A2与肿瘤细胞的氧化反应、DNA损伤修复等有关[3, 4],推测可能与放射敏感度相关[5]。为了探讨Annexin A2的表达是否与鼻咽癌的临床特征和放疗疗效具有相关性,本研究采用免疫组织化学的方法,检测鼻咽癌组织中Annexin A2蛋白的表达,研究其与鼻咽癌临床分期、局部复发和远处转移等临床病理特征的相关性,为进一步明确Annexin A2蛋白在鼻咽癌放疗抗拒中的作用提供研究基础。
1 资料与方法 1.1 病例资料随机选取2012年2月至2012年7月福建省肿瘤医院初诊鼻咽癌患者治疗前鼻咽肿瘤活检组织标本131例,所有病例鼻咽部组织均经病理学确诊且无远处转移,并经临床体检、心电图、鼻咽纤维镜、胸部X线、腹部B超、全身骨ECT及鼻咽和颈部的MRI检查,3例患者另外给予全身PET检查。其中男104例,女27例,年龄25~61岁,中位年龄48.6岁。WHO病理分型:非角化性未分化型118例,非角化性分化型13例。按照1997美国抗癌协会(AJCC)分期系统进行分期:Ⅰ期5例,Ⅱ期19例,Ⅲ期74例,Ⅳ期33例。
1.2 治疗方法所有入组患者均接受根治性放疗,其中,34例(26.0%)采用常规放射治疗技术(1.8~2.0 Gy/次),放射源为6 MV X线,采用相适应的泡沫枕和面膜固定,低熔点挡铅技术等中心治疗,对鼻咽原发病灶及上颈部主要采用面颈联合野和面颈联合小野+颈后电子线野,下颈部采用单前野(切线野)照射。鼻咽原发病灶累积剂量66~80 Gy,转移淋巴结累积剂量60~72 Gy,颈部预防照射剂量50~54Gy;97例(74.0%)采用调强放射治疗(IMRT),GTV-P为原发灶大体肿瘤体积,GTV-N为淋巴结转移病灶大体肿瘤体积,处方剂量GTV-P 66.00~76.50Gy,GTV-N 63.00~74.20 Gy。
1.3 随访所有患者放疗结束时鼻咽部检查和MRI检查均无肿瘤残留。随访时间从治疗结束开始计算,截至2014年12月,全组中位随访29月(2~34月),放疗后2年内每3月随访1次,2~5年每6月随访1次。失访6例,随访率为95.4%(125/131)。生存时间自患者治疗结束开始计算,无局部复发生存时间定义为自治疗结束之日起到首次鼻咽部复发的时间,无远处转移生存时间的定义为自治疗结束之日起发生远处转移的时间。
1.4 免疫组织化学将鼻咽癌组织标本经石蜡包埋、切片,免疫组织化学染色程序按试剂盒说明书进行,光学显微镜下分析。评分标准:(1)按切片中细胞显色有无及深浅计分:无显色0分,浅黄色1分,棕黄色2分,棕褐色3分;(2)按切片中显色细胞的比例评分:染色阳性细胞数<5%为0分,5%~25%为1分,>25%~50%为2分,>50%~75%为3分,>75%为4分。每例阳性积分 =(1)×(2),按表达强度根据积分高低分为:0分阴性(-),1、2分弱阳性(+),3、4、6分中度阳性(++),9、12分为强阳性(+++)。
1.5 统计学方法用SPSS18.0软件对基础数据分布进行χ 2检验或Fisher检验,分析组间差异;用Kaplan-Meier法分别计算不同组的无局部复发生存率、无远处转移生存率和总生存率,并用Log rank法检验其差异;Cox比例风险模型进行单因素分析和多因素分析,P<0.05为差异有统计学意义。
2 结果2.1 131例鼻咽癌患者治疗疗效
全组局部区域复发6例,均为鼻咽部复发,无颈部淋巴结复发。远处转移共17例,其中多发骨转移6例,肺转移5例、肝转移3例、淋巴结转移3例,死亡1例。2年无局部复发生存率、无远处转移生存率、总生存率分别为98.4%、88.5%、99.2%。
2.2 Annexin A2在鼻咽癌组织中的表达及其与临床特征的关系Annexin A2免疫组织化学染色主要定位于鼻咽癌细胞的细胞质,呈棕黄色,见图 1。

|
| A: negative Annexin A2 expression of nasopharyngeal carcinoma(NPC) tissues; B: positive Annexin A2 expression of NPC tissues 图 1 鼻咽癌组织中Annexin A2的表达 (Elivision ×200) Figure 1 Annexin A2 expression in NPC tissues (Elivision ×200) |
表达阳性率为92.4%(121/131),但表达水平与患者的性别、年龄、病理类型、临床分期等无明显相关性(P>0.05),见表 1。
 |
Annexin A2 在鼻咽癌组织中的表达阳性率为92.4%(121/131),但表达水平与患者的性别、年龄、病理类型、临床分期等无明显相关性(P>0.05),见表 1。
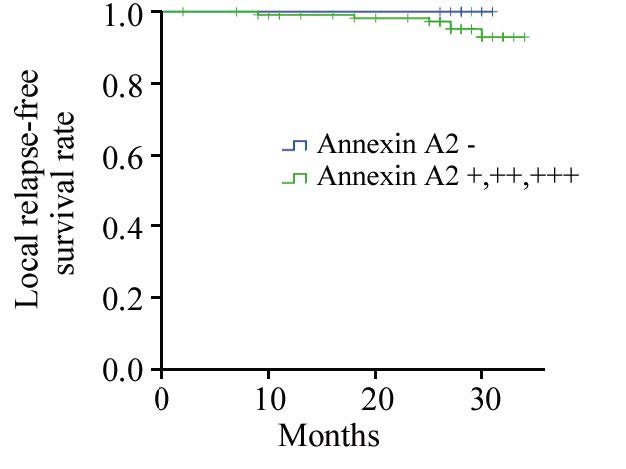
2.3 Annexin A2表达与鼻咽癌放射治疗后局部复发的关系Annexin A2阴性表达(-)患者无局部复发(0/15),Annexin A2阳性表达(+,++,+++)的患者的局部复发率为5.2%(6/116),但两者之间的差异无统计学意义(P=0.373)。Annexin A2阴性表达和阳性表达的2年无局部复发生存率分别为100%和98.4%(P=0.783),虽然差别无统计学意义,但两组生存曲线能够较好的拉开,见图 2。
|
| 图 2 Annexin A2表达与鼻咽癌放射治疗后无局部复发生存率的关系 Figure 2 Relationship between Annexin A2 expression andlocal recurrence-free survival rate after radiotherapy on nasopharyngeal carcinoma patients |
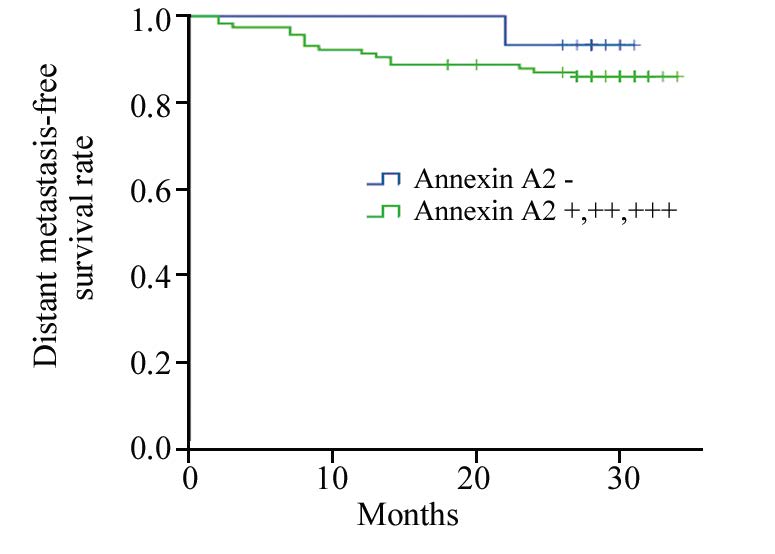
Annexin A2阴性表达(-)患者的远处转移率较低6.7%(1/15),阳性表达(+,++,+++)的患者的远处转移率为13.8%(16/116),两组比率差异无统计学意义(P=0.430)。Annexin A2阴性表达和阳性表达的2年无远处转移生存率分别为93.3%和87.9%(P=0.462),虽然差别无统计学意义,但两组生存曲线能够较好的拉开,见图 3。
|
| 图 3Annexin A2表达与鼻咽癌放射治疗后无远处转移生存率的关系 Figure 3 Relationship between Annexin A2 expression and distant metastasis-free survival rate after radiotherapy on NPC patients |
Cox模型单因素分析结果显示:性别、年龄、病理类型、临床分期和Annexin A2与患者局部复发无关。将这些变量纳入多因素分析模型,结果显示,病理类型是鼻咽癌患者无局部复发生存时间的独立预后因素,见表 2。
 |
Cox模型单因素分析结果显示:性别、年龄、病理类型、临床分期和Annexin A2与患者远处转移无关。将这些变量纳入多因素分析模型,结果显示都不是患者无远处转移生存时间的独立预后因素,见表 3。
 |
放射治疗是鼻咽癌首选的治疗方法,随着影像学与放疗技术的进步,鼻咽癌患者放疗后局部复发率和远处转移率明显降低。尤其是采用调强放疗技术后,3年无局部复发生存率和无远处转移率分别可达90%以上和80%以上,83%的肿瘤复发于X线高照射剂量范围内,且肿瘤局部侵犯的范围(T分期)已经不是复发的独立预后因素[6],说明鼻咽癌的复发和转移可能与肿瘤细胞本身的放射敏感度密切相关。Annexin A2基因被认为是与放射敏感度相关的基因之一,实验证明,Annexin A2蛋白过表达的鼻咽癌细胞对X线比较抗拒,低表达的鼻咽癌细胞对X射线比较敏感[5]。
Annexin A2是钙离子依赖的磷脂结合蛋白,其蛋白异常表达和肿瘤的发生发展有密切关系[3, 7]。敲除Annexin A2能明显抑制肝癌细胞的生长并能增加对化疗药物5-氟尿嘧啶的敏感度,其主要机制是通过调控WNT信号通路中的关键分子β-catenin和cyclin D1的表达来实现[8]。Madureira等[4]研究表明,虽然Annexin A2主要定位于细胞质和细胞膜,但细胞核内也有少量的表达,能发挥核蛋白的功能,抗氧化剂N-乙酰半胱氨酸能阻止Annexin A2在核内的积累,而过氧化氢能刺激其在核内的积累,位于细胞核内的Annexin A2可减轻遗传毒性剂(如UV)对DNA的损伤,提示Annexin A2可能与肿瘤细胞的放射敏感度有关。本课题组的前期研究证实了这种推测,即在放射抗拒的鼻咽癌细胞株CNE-2(R743)存在过表达的Annexin A2[5],下调Annexin A2的表达可增强CNE-2(R743)细胞放射敏感度[9],提示Annexin A2在鼻咽癌的放射抗拒可能起着重要的作用。
为了进一步探讨Annexin A2与鼻咽癌放疗疗效的关系,我们通过临床共收集了131例根治性治疗的鼻咽癌标本,其中Annexin A2在鼻咽癌组织中的阳性表达率高达92.4%,而且(++)以上的强阳性表达为66.4%,说明Annexin A2蛋白在鼻咽癌组织中有明显的高表达,这与我们的细胞学实验结果相一致[5, 9],但通过分析发现Annexin A2的表达与临床分期无相关性。
在Annexin A2与肿瘤复发关系的研究中,Alonso-Alconada等[10]通过蛋白质组学研究和临床回顾性分析发现,Annexin A2是预测手术或放化疗后子宫内膜癌复发的准确的生物标志物。Huang等[11]研究发现Annexin A2与胰腺癌的复发和预后密切相关。我们在Annexin A2蛋白表达与鼻咽癌患者的局部复发研究中,发现Annexin A2蛋白阴性表达的患者2年无局部复发生存率较阳性表达者高,尽管差异无统计学意义(P>0.05),但随着时间的延长,两条生存曲线能很好的分开,可见Annexin A2表达与鼻咽癌放射治疗后是否局部复发的关系具有一定的正相关趋势,提示高表达Annexin A2的鼻咽癌可能对射线比较抗拒从而导致复发率较高,两者之间差异无统计学意义的原因可能是病例数相对较少以及随访时间较短,因此扩大病例数及增加随访时间将有助于进一步探讨Annexin A2与鼻咽癌放疗疗效的相关性。
在Annexin A2表达与肿瘤转移的关系上,目前研究结果尚无定论。Leal等[12]研究发现上调Annexin A2表达能提高胃癌的转移和侵袭能力;Andey和Zhang等[13, 14, 15]通过小鼠实验发现下调Annexin A2表达会减弱肺癌细胞的侵袭和转移能力,沉默其表达明显抑制肝癌细胞的侵袭、转移和致瘤能力;而Yang等[16]研究则发现沉默AnnexinA2表达能提高肾癌细胞的侵袭和转移能力。本研究Annexin A2表达与鼻咽癌放射治疗后远处转移研究中发现,Annexin A2蛋白的阴性表达要比阳性表达者有较高的2年生存率,由此推测Annexin A2表达阴性的患者较表达阳性者可能具有较高的放射敏感度,从而增加放射治疗的效果,降低远处转移发生率;尽管二者的差异无统计学意义,但从无远处转移生存率的曲线图中可以看出两组之间曲线能较好的分开,分开的幅度较无局部复发生存率曲线大,进一步扩大病例数以及增加随访时间将有助于验证两者的相关性。
本研究单因素分析结果表明性别、年龄、病理类型、临床分期和Annexin A2与鼻咽癌患者的局部复发和远处转移无关,可能与随访时间较短有关;所以除病理类型是鼻咽癌患者无局部复发生存时间的独立预后因素外,多因素分析也未证明其他几个因素是鼻咽癌患者的局部复发和远处转移的危险因素。今后的研究通过延长随访时间将有助于明确这些因素与局部复发和远处转移的相关性。
| [1] | Kong F, Ying H, Du C, et al. Patterns of local-regional failureafter primary intensity modulated radiotherapy for nasopharyngealcarcinoma[J]. Radiat Oncol, 2014, 9: 60. |
| [2] | Luftig M. Heavy LIFting: tumor promotion and radioresistance inNPC[J]. J Clin Invest, 2013, 123(12): 4999-5001. |
| [3] | Madureira PA, Hill R, Miller VA, et al. Annexin A2 is a novelcellular redox regulatory protein involved in tumorigenesis[J].Oncotarget, 2011, 2(12): 1075-93. |
| [4] | Madureira PA, Hill R, Lee PW, et al. Genotoxic agents promotethe nuclear accumulation of annexin A2: role of annexin A2 inmitigating DNA damage[J]. PLoS One, 2012, 7(11): e50591. |
| [5] | Su Y, He HC, Wu JX, et al. Comparative proteomic studyof nasopharyngeal carcinoma cell lines with differentradiosensitivity[J]. Zhonghua Fang She Yi Xue Yu Fang Hu ZaZhi, 2011, 31(5): 536-41. [苏颖, 何火聪, 吴君心, 等. 鼻咽癌细胞放射敏感性的比较蛋白质组学研究[J]. 中华放射医学与防护杂志, 2011, 31(5): 536-41.] |
| [6] | Lin S, Pan J, Han L, et al. Nasopharyngeal carcinoma treated withreduced-volume intensity-modulated radiation therapy: report onthe 3-year outcome of a prospective series[J]. Int J Radiat OncolBiol Phys, 2009, 75(4): 1071-8. |
| [7] | Lokman NA, Ween MP, Oehler MK, et al. The role of annexin A2in tumorigenesis and cancer progression[J]. Cancer Microenviron,2011, 4(2): 199-208. |
| [8] | Wang C, Guo Y, Wang J, et al. Annexin A2 knockdowninhibits hepatoma cell growth and sensitizes hepatoma cells to5-fluorouracil by regulating β-catenin and cyclin D1 expression[J].Mol Med Rep, 2015, 11(3): 2147-52. |
| [9] | Su Y, He HC, Wu JX, et al. Effect of silencing Annexin A2 geneexpression by siRNA on radiosensitivity of nasopharyngealcarcinoma cells[J]. Zhonghua Fang She Zhong Liu Xue, 2015,24(2): 214-8. [苏颖, 何火聪, 吴君心, 等. siRNA沉默Annexin A2基因表达对鼻咽癌细胞放射敏感性的影响[J]. 中华放射肿瘤学, 2015, 24(2): 214-8.] |
| [10] | Alonso-Alconada L, Santacana M, Garcia-Sanz P, et al.Annexin-A2 as predictor biomarker of recurrent disease inendometrial cancer[J]. Int J Cancer, 2015, 136(8): 1863-73. |
| [11] | Huang YK, Liu H, Wang XZ, et al. Annexin A2 and CD105expression in pancreatic ductal adenocarcinoma is associatedwith tumor recurrence and prognosis[J]. Asian Pac J Cancer Prev,2014, 15(22): 9921-6. |
| [12] | Leal MF, Calcagno DQ, Chung J, et al. Deregulated expression ofannexin-A2 and galectin-3 is associated with metastasis in gastriccancer patients[J]. Clin Exp Med, 2015, 15(3): 415-20. |
| [13] | Andey T, Marepally S, Patel A, et al. Cationic lipid guided shorthairpinRNA interference of annexin A2 attenuates tumor growthand metastasis in a mouse lung cancer stem cell model[J]. JControl Release, 2014, 184: 67-78. |
| [14] | Zhang W, Zhao P, Xu XL, et al. Annexin A2 promotes themigration and invasion of human hepatocellular carcinomacells in vitro by regulating the shedding of CD147-harboringmicrovesicles from tumor cells[J]. PLoS One, 2013, 8(8): e67268. |
| [15] | Zhang HJ, Yao DF, Yao M, et al. Annexin A2 silencing inhibitsinvasion, migration, and tumorigenic potential of hepatomacells[J]. World J Gastroenterol, 2013, 19(24): 3792-801. |
| [16] | Yang SF, Hsu HL, Chao TK, et al. Annexin A2 in renal cellcarcinoma: expression, function, and prognostic significance[J].Urol Oncol, 2015, 33(1): 22. e11-21. |
 2015, Vol. 42
2015, Vol. 42


