文章信息
- 赵宇,李玉梅,秦叔逵,吴穷,张凯,郑荣生,杨燕
- ZHAO Yu, LI Yumei, QIN Shukui, WU Qiong, ZHANG Kai, ZHENG Rongsheng, YANG Yan
- Connexin43在肝细胞癌组织中的表达
- Expression of Connexin43 in Human Hepatocellular Carcinoma Tissues
- 肿瘤防治研究, 2015, 42(12): 1210-1215
- Cancer Research on Prevention and Treatment, 2015, 42(12): 1210-1215
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.12.009
-
文章历史
- 收稿日期: 2015-01-19
- 修回日期: 2015-04-15
2. 210002 南京,解放军第八一医院全军肿瘤中心内科;
3. 233004 蚌埠,蚌埠医学院第一附属医院口腔科
2. Department of Medical Oncology, Cancer Center of PLA, The 81th Hospital of PLA, Nanjing 210002, China;
China; 3. Department of Stomatology, The First Affiliated Hospital of Bengbu Medical College, Bengbu 233004, China
由于乙型病毒肝炎患者众多,我国是原发性 肝癌,尤其是肝细胞癌(hepatocellular carcinoma, HCC)全球第一大国,发病率和死亡率均较高。 攻克HCC已成为临床亟待解决的重大课题之一, 然而迄今HCC的发病机制仍未明了[1]。近年来, 缝隙连接(gap junction,GJ)结构和功能的研究为 探索多种肿瘤的发生机制提供了新思路[2, 3]。GJ是 一种直接沟通两个相邻细胞胞质的蛋白质连接通道,由特殊的通道蛋白—缝隙连接蛋白(connexin, Cx)组成。Cx是多基因家族编码的一类结构相似 而分子量不同的蛋白质,目前在人类共发现有20 余种[4],其中Cx43表达最为广泛,在人类几乎所有 组织和细胞中都有表达[5]。在肝脏组织中,GJ功能 的维持主要涉及3种Cx,即Cx26、Cx32和Cx43[6]。 目前研究证实,Cx43可能参与了多种肿瘤的发生 发展[5, 7],但其与HCC的系统性研究较少。因此, 本研究从组织学和细胞学层面综合探讨了Cx43在 HCC中的表达及意义,旨在为HCC的发病机制提 供更多的实验数据和资料。
1 资料与方法 1.1 实验资料人正常肝细胞株LO2购自南京凯基生物科技发 展有限公司;人肝癌细胞株SMMC-7721购自中国 科学院上海细胞库。SP试剂盒购自福州迈新生物 技术开发公司。DMEM培养液及胎牛血清(Gibco 公司,美国);反转录试剂盒及PCR所用酶、缓 冲液、dNTP等(Promega公司,美国);Cx43 鼠抗人单克隆抗体(Sigma公司,美国);HPR 及FITC标记的羊抗鼠二抗(Amersham公司,美 国);TRIzol,DAPI、钙黄绿素(calcein-AM) 及DiI-CM(Invitrogen公司,美国);ECL-plus化 学发光试剂盒(Millipore公司,美国)。
1.2 免疫组织化学SP法染色 1.2.1 标本来源 收集蚌埠医学院第一附属医院2008年1月至2012年12月间经手术切除的存档HCC 蜡块标本76例,术前均未进行任何治疗。另取外 伤性肝切除及意外死亡的正常肝脏组织蜡块20例 作为对照组。
1.2.2 免疫组织化学SP法染色 石蜡切片常规脱蜡至水化,在柠檬酸缓冲液中微波修复抗原,煮 到沸腾后自然冷却,反复2次,室温下加入1:200稀 释的Cx43一抗,4℃孵育过夜,同时以等量PBS代 替一抗,作阴性对照,滴加1:200稀释的生物素标 记的羊抗鼠二抗,37℃下孵育1 h,滴加链霉素抗 生物素酶免疫复合物(SABC),DAB显色,苏木 精对比染色。光学显微镜下观察阳性染色及细胞 定位并拍照。
1.2.3 免疫组织化学结果判断 Cx43蛋白阳性定位于细胞质或细胞膜。细胞内出现黄色颗粒为阳 性细胞。每张切片在高倍镜视野下计数500个肿 瘤或正常肝细胞。根据细胞染色结果将阳性细胞 分为高表达(棕黄色或棕褐色强染色)和低表达(淡黄色弱染色)[8]。
1.3 RT-PCR检测Cx43 mRNA表达按RNA抽提试剂盒说明提取总RNA,利用随 机引物进行反转录合成cDNA。反转录产物中加入 特异性Cx43上下游引物继续进行PCR反应。Cx43 引物按照人Cx43序列设计:5'-AGGAGTTCAATCACTTGGCG- 3'(上游),5'-GCAGGATTCGGAAAATGAAA- 3'(下游),产物长度为168 bp; 人β-actin为内参照,引物序列为5'-TCCTCCTGAGCGCAAGTACTC- 3'(上游),5'-GCATTTGCGGTGGACGAT- 3'(下游),产物长度为130 bp。PCR反应总体积为20 μl,反应条件为:94℃ 预变性3 min;循环参数:94℃变性45 s,58℃退 火45 s,72℃延伸45 s,共36个循环;最后72℃延 伸10 min。取5 μl PCR扩增产物,进行1.5%琼脂糖 凝胶(含0.5 μg/ml溴化乙锭)电泳,凝胶成像系统 照相并分析。
1.4 Western blot法检测Cx43蛋白表达收集对数生长期的LO2和SMMC-7721细胞, 提取细胞蛋白。BCA法测定蛋白含量,根据样品蛋 白浓度,按照蛋白总量40 μg计算体积。蛋白变性 后上样,十二烷基硫酸钠-聚丙烯酰胺凝胶100 V、 200 mA电泳分离样品蛋白,转印至PVDF膜,封 闭,加入1:1 000稀释的Cx43一抗4℃孵育过夜,滴 加1:5 000稀释的羊抗鼠抗体(二抗)37℃孵育2 h。 ECL显影,曝光。β-actin的表达水平作为内参。
1.5 免疫荧光法检测Cx43蛋白分布收集对数生长期的细胞爬片,用4%多聚甲 醛+0.1%Triton X-100室温下固定30 min。滴加一 抗(Cx43鼠抗人单克隆抗体,工作浓度l:200,以 2% BSA稀释),室温下孵育3 h,PBS轻柔冲洗 3次。加入二抗(FITC标记的羊抗鼠二抗,工作 浓度1:200,以2% BSA稀释),室温下避光孵育 2 h,PBS轻柔冲洗3次。加DAPI进行细胞核染色5 min,PBS轻柔冲洗3次,95%甘油封片剂封闭。倒 置荧光显微镜下观察,光源分别激发绿色和蓝色 荧光,采集图像。
1.6 细胞接种荧光示踪法测定培养细胞间细胞缝隙连接(gap junction,GJ)功能 按照既往研究报道[9, 10],采用细胞接种荧光 示踪法测定GJ功能。细胞接种至6孔板,生长至 80%~85%融合。取10 μl 25 μmol/L calcein-AM加入 1 ml的无血清培养液混匀。在6孔板其中1孔加入 上述荧光负载液体1 ml,置于5%CO2、37℃培养箱 中培养30 min,使荧光指示剂进入细胞。吸去负载液,PBS冲洗5 min 3次。用胰蛋白酶消化,加入无 血清培养液中止消化。进行细胞计数,稀释至500 个/毫升,负载荧光的单个悬浮细胞即为“供体细 胞”。在显微镜下观察6孔板其他培养细胞,挑选 生长良好、有GJ形成(已融合)的细胞作为“受体 细胞”。向对应的“受体细胞”加入“供体细胞”液, 1 毫升/孔,置于5%CO2、37℃培养箱中培养4 h。 待形成稳定的GJ后,小分子的calcein(发绿色荧 光)可以通过GJ进入相邻的“受体细胞”。在倒置 荧光显微镜下,计数一个“供体细胞”周围有无内含 calcein的“受体细胞”及数目,作为GJ功能指标。
1.7 统计学方法使用SPSS17.0软件进行分析。各组间样本率 差异的比较视数据类型采用χ2检验、Fisher精确检 验、Wilcoxon秩和检验。P<0.05为差异有统计学 意义。 2 结果 2.1 Cx43在HCC及正常肝脏组织中的表达
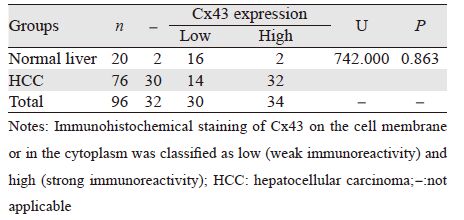
正常肝脏组织中Cx43的阳性表达率为90.00% (18/20),HCC组织的阳性表达率为60.53% (46/76),两者比较差异有统计学意义(χ2=6.189, P=0.015),见表 1。针对阳性表达的Cx43颗粒, 其在正常肝脏组织中多呈淡黄色弱染色,而在 HCC中多呈棕黄色或棕褐色强染色,但表达程度 的分布在两组之间差异无统计学意义(U=742.00, P=0.863),见表 1。
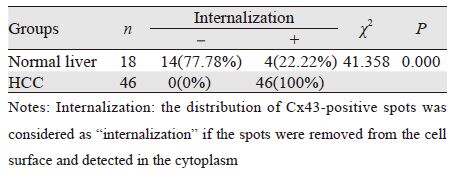
正常肝脏组织中阳性表达的Cx43呈线状分 布于细胞膜上,偶见细胞质表达,见图 1A~1B; 而在HCC组织中,阳性染色颗粒主要分布于细 胞质内,偶见同时有部分细胞膜着色,即发生了 “内化”( internalization)现象,见图 1C~1D。内化率在正常肝脏组织及HCC组分别为22.22%和 100%,两组比较差异有统计学意义(χ2=41.358, P=0.000),见表 2。

|
| A, B: normal liver tissues (IHC ×400); C, D: HCC tissues (IHC ×400) 图 1 正常肝及HCC组织中Cx43的表达 Figure 1 Immunohistochemical staining of Cx43 protein in sections of normal liver and HCC tissues |
 |
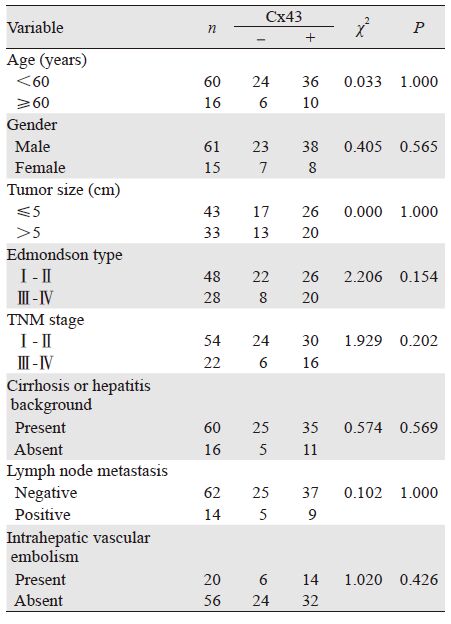
经统计学分析表明,Cx43蛋白的表达与HCC 患者年龄、性别、组织学分级、TNM分期、肝 病背景、淋巴结转移、脉管癌栓均无关(均P> 0.05),见表 3。
 |
GJ功能状态 RT-PCR和Western blot法联合检测结果显 示,与正常肝细胞株LO2相比,人肝癌细胞系 SMMC-7721中Cx43 mRNA和蛋白表达明显下降, 见图 2A~2B。免疫荧光实验进一步表明LO2细胞上 Cx43的膜定位明显,而在SMMC-7721细胞上,该 蛋白弥散分布于细胞质中,仅有少量呈细颗粒状 定位于细胞膜,见图 2C。LO2细胞GJ功能丰富, 而SMMC-7721细胞GJ功能微弱,如图 2D细胞接种 荧光示踪实验结果所示。

|
| A, B: decreased expression of Cx43 at both mRNA and protein levels in SMMC-7721 cells compared with those in LO2 cells, as shown by agarose gel electrophoresis of RT-PCR products and Western blot, respectively; C: immunofluorescent staining of Cx43 protein in LO2 and SMMC-7721 cells. Normal liver cells showed mainly membranous staining for Cx43, while diffuse cytoplasmic staining for Cx43 in HCC cells was observed (×400); D: GJ activity of SMMC-7721 cells was markedly reduced compared with that of LO2 cells, which was evidenced by parachute dye coupling assay (×200); GJ: gap junction 图 2 LO2及SMMC-7721细胞中Cx43表达、定位及GJ状态 Figure 2 Cx43 expression, localization and functional GJ formation in LO2 and SMMC-7721 cells |
GJ是广泛存在于细胞间介导物质及信息交换 的重要通道,其结构基础为Cx蛋白。当该通道开放 时,一些离子(如Na+、K+、Ca2+等)及其他小分子 调节物质(如第二信使cAMP、cGMP、IP3 等)可 以在相邻细胞间通过,进而在控制细胞增殖、促进 分化成熟、诱导凋亡及机体的生长发育等过程中起 重要调控作用。研究表明,Cx及其组成的GJ异常 与肿瘤的发生相关[11, 12]。Cx在大多数肿瘤组织中呈 现表达缺失或低表达状态,而上调Cx表达或改善 GJ功能能够抑制肿瘤的发生或逆转其表型[13, 14]。原 因可能是GJ介导的细胞间通讯功能异常,使机体对 肿瘤细胞的监视和调控能力减弱,肿瘤细胞过度克 隆生长最终形成恶性肿瘤。从GJ结构学上来看,定 位于细胞膜上的Cx才有可能形成功能性的GJ,进 而发挥后续的生物学功能。
Cx43作为Cx蛋白家族的成员之一,在人体中 表达最多,相关研究也最为广泛[5]。但目前关于 Cx43在不同肿瘤细胞及组织中的表达及确切的功 能仍未明了。例如,在乳腺癌肿瘤细胞系中过表 达Cx43可以抑制肿瘤细胞的增殖和进展[15]。胃肿瘤组织中Cx43显著低表达,而邻近正常组织表达 正常或轻度降低[16, 17]。然而研究也发现有一些肿 瘤中存在正常甚至高表达的Cx43,如食管癌中的 Cx43蛋白表达较正常组织未减少,肿瘤细胞间的 GJ功能也并未降低[18]。由此可见,不同种类的恶 性肿瘤,Cx43表达不尽相同,其与肿瘤发生发展 的关系仍需要进一步研究。
本研究结果显示,HCC组织中Cx43蛋白表达 较正常肝脏组织明显下调,表明HCC发生后Cx及其组成的GJ功能是下调的。此外,还观察到Cx43 蛋白在HCC中的定位存在异常:在正常的细胞均 定位于细胞间相互接触的细胞膜,而在HCC中仅 有极少量Cx43定位于胞膜上,Cx43多定位于胞质 内,这种定位上的变化被称为“内化”,在既往关 于另一亚型蛋白Cx32在HCC发生发展过程中的研 究时被发现[19]。结合本实验结果,推测Cx蛋白的 “内化”现象可能是HCC发生过程中的重要“标志”。 无论哪种亚型Cx蛋白定位上的改变,最终都将导 致GJ功能的降低或缺失。本实验中,虽然阳性表 达的Cx43染色在HCC组较正常肝脏组织更为强 烈,但这些高表达的Cx43不能完全正确定位到细 胞膜上,大部分滞留在胞质内,不能发挥介导GJ 的功能。即可以认为,虽然某些阳性表达的HCC 组织样本中存在高水平的Cx43表达,但这并不表 明这些细胞间的GJ通讯正常。随后的体外实验也 进一步证实了组织学上的研究结果,并且通过细 胞接种荧光实验证实与正常肝细胞株LO2丰富的 GJ通讯功能相比,人肝癌细胞系SMMC-7721只有 部分残存的GJ功能。针对该部分GJ形成的组份, Western blot联合免疫荧光结果提示Cx43有部分表 达且可定位于细胞膜,表明Cx43在该细胞系有参 与形成GJ的条件,但本实验尚不能排除其他Cx亚 型蛋白参与的可能性[10]。从Cx43表达与HCC临床 病理特征的关系上来看,该蛋白与各因素之间无 明显相关性,表明Cx43在HCC发生过程中所起的 作用可能是早期事件,与后续肝癌细胞的生物学 行为关系不大,同时该结果也在一定程度上提示 HCC细胞中GJ功能组份的复杂性。
目前关于Cx在细胞质中的滞留机制不明,推 测其可能的分子机制有:(1)Cx基因发生突变。 突变的Cx基因将不能介导正常蛋白的生成及生 物学效应的发挥。如在化学诱导致癌的大鼠HCC 组织[20]及人类散在性结肠癌中分别发现了Cx32和 Cx43基因的特异性突变[21],但目前尚未有关于 Cx43基因在HCC中突变的报道。(2)Cx蛋白的 翻译后过程异常,如Cx蛋白磷酸化。研究表明, Cx43羧基末端为主要的磷酸化区,各种病理状态 下蛋白激酶C(PKC)、Src家族中酪氨酸激酶及 促分裂原活化蛋白激酶(MAPK)可以通过调节 Cx43羧基末端的磷酸化水平,导致Cx43介导的 信号转导异常[22]。紧密连接蛋白ZO-1也能作用于 Cx43羧基末端而调节Cx的聚集,最终影响Cx43通 道的形成和功能[23]。(3)Cx蛋白组装后向细胞膜 的转运受阻。Cx蛋白组装后向细胞膜转运路径不尽相同,如在HeLa细胞和心肌细胞中,Cx43蛋白 沿微管转运到细胞膜[24];在上皮细胞中,Cx43蛋 白沿肌动蛋白束转运到细胞膜[25]。在转运的任一 环节发生错误,都会导致Cx蛋白不能正确转运到 细胞膜上。有研究发现,肿瘤细胞中常伴随Cx与 另一类连接蛋白如钙黏蛋白(E-cadherin)表达的 共同下调或异常定位[16, 26]。而E-cadherin作为参与 上皮细胞间识别过程中的主要蛋白,它的异常可 导致细胞间的识别损伤,使组装后的Cx不能准确 定位到细胞膜上[25]。但在本研究中,Cx43在HCC 组织或细胞胞质中的滞留机制仍需进一步研究。
综上所述,本研究通过组织学和细胞学证据 一致证实HCC中存在Cx43蛋白表达和定位的异 常,表达数量的下调及蛋白的内化两者最终导致 细胞膜上有功能性的GJ形成下降,可能是HCC 发生的重要环节之一。针对肝细胞癌变后残存的 GJ,未来寻找或设计上调Cx43蛋白表达或逆转其 内化的方法或途径,以期改善HCC中GJ功能,可 能为肝癌临床治疗提供新思路及策略。
| [1] | Chen JG, Zhang SW. Liver cancer epidemic in China:past,present and future[J]. Semin Cancer Biol, 2011, 21(1): 59-69. |
| [2] | Vinken M, De Kock J, Oliveira AG, et al.Modifications inconnexin expression in liver development and cancer[J]. CellCommun Adhes, 2012, 19(3-4): 55-62. |
| [3] | El-Saghir JA, El-Habre ET, El-Sabban ME, et al. Connexins:a junctional crossroad to breast cancer[J]. Int J Dev Biol, 2011,55(7-9): 773-80. |
| [4] | Rackauskas M, Neverauskas V, Skeberdis VA. Diversityand properties of connexin gap junction channels[J].Medicina(Kaunas), 2010, 46(1) :1-12. |
| [5] | Lin SL, Wen H, Deng H. Research progress of connexin43 functionand mechanism in cancer[J]. Zhonghua Bing Li Xue Za Zhi,2014, 43(1): 62-4. [林山力, 文欢, 邓红. 连接子蛋白43在肿瘤中的作用及其机制的研究进展[J]. 中华病理学杂志, 2014, 43(1):62-4.] |
| [6] | Balasubramaniyan V, Dhar DK, Warner AE, et al. Importance of Connexin-43 based gap junction in cirrhosis and acute-on-chronicliver failure[J]. J Hepatol, 2013, 58(6): 1194-200. |
| [7] | Kandouz M, Batist G. Gap junctions and connexins as therapeutictargets in cancer[J]. Expert Opin Ther Targets, 2010, 14(7): 681-92. |
| [8] | Song YH, Zhang HJ, Song ST, et al. Association between thesimultaneous nuclear and cytoplasmic localization of Fra-1 andbreast malignancy[J]. Zhongguo Zhong Liu Lin Chuang, 2011,38(20): 1244-50. [宋玉华, 张红军, 宋三泰, 等. Fra-1在乳腺肿瘤细胞质和细胞核同时定位相关性的研究[J]. 中国肿瘤临床,2011, 38(20): 1244-50.] |
| [9] | Yang Y, Wu Q, Zheng RS, et al. Establishment and identificationof a Tet-on HeLa cell model of CX26/CX32 gap junction[J]. JiChu Yi Xue Yu Lin Chuang, 2013, 33(9): 1079-84. [杨燕, 吴穷,郑荣生, 等. CX26/CX32 缝隙连接蛋白的Tet-on HeLa细胞模型的建立及鉴定[J]. 基础医学与临床, 2013, 33(9): 1079-84.] |
| [10] | Yang Y, Qin SK, Wu Q, et al. Connexin-dependent gap junctionenhancement is involved in the synergistic effect of sorafenib andall-trans retinoic acid on HCC growth inhibition[J]. Oncol Rep,2014, 31(2): 540-50. |
| [11] | Defamie N, Chepied A, Mesnil M. Connexins, gap junctions andtissue invasion[J]. FEBS Lett, 2014, 588(8): 1331-8. |
| [12] | Leithe E, Sirnes S, Omori Y, et al. Downregulation of gapjunctions in cancer cells[J]. Crit Rev Oncog, 2006, 12(3-4):225-56. |
| [13] | Mesnil M. Connexins and cancer[J]. Biol Cell, 2002, 94(7-8):493-500. |
| [14] | King TJ, Lampe PD. The gap junction protein connexin32 isa mouse lung tumor suppressor[J]. Cancer Res, 2004, 64(20):7191-6. |
| [15] | McLachlan E, Shao Q, Wang HL, et al. Connexins act as tumorsuppressors in three-dimensional mammary cell organoids byregulating differentiation and angiogenesis[J]. Caneer Res, 2006,66(20): 9886-94. |
| [16] | Tang B, Peng ZH, Yu PW, et al. Expression and significance ofCx43 and E-cadherin in gastric cancer and metastatic lymphnodes[J]. Med Oncol, 2011, 28(2): 502-8. |
| [17] | Li CH, Pan LH, Xun BB, et al. Clinical significance of gapjunction ultrastructure change and Connexin-43 expression ingastric cancer tissues[J]. Zhong Liu Fang Zhi Yan Jiu, 2015,42(7): 697-701. [李春辉, 潘理会, 徐贝贝, 等. 胃癌组织中间隙连接超微结构改变及间隙连接蛋白-43的表达及其意义[J]. 肿瘤防治研究, 2015, 42(7): 697-701.] |
| [18] | Garber SA, Fernstrom MJ, Stoner GD, et al. Altered gap junctionalintercellular communication in neoplastic rat esophageal epithelialcells[J]. Carcinogenesis, 1997, 18(6): 1149-53. |
| [19] | Nakashima Y, Ono T, Yamanoi A, et al. Expression of gap junctionprotein connexin32 in chronic hepatitis, liver cirrhosis, andhepatocellular carcinoma [J]. J Gastroenterol, 2004, 39(8):763-8. |
| [20] | Omori Y, Krutovskikh V, Mironov N, et al. Cx32 gene mutation ina chemically induced rat liver tumour[J]. Carcinogenesis, 1996,17(9): 2077-80. |
| [21] | Dubina MV, Iatckii NA, Popov DE, et al. Connexin 43, but notconnexin 32, is mutated at advanced stages of human sporadiccolon cancer[J]. Oncogene, 2002, 21(32): 4992-6. |
| [22] | Solan JL, Lampe PD. Connexin43 phosphorylation: structuralchanges and biological effects[J]. Biochem J, 2009, 419(2):261-72. |
| [23] | Dunn CA, Lampe PD. Injury-triggered Akt phosphorylation ofCx43: a ZO-1-driven molecular switch that regulates gap junctionsize[J]. J Cell Sci, 2014, 127(Pt2): 455-64. |
| [24] | Shaw RM, Fay AJ, Puthenveedu MA, et al. Microtubule plusend-tracking proteins target gap junctions directly from the cellinterior to adherens junctions[J]. Cell, 2007, 128(3): 547-60. |
| [25] | Hernandez-Blazquez FJ, Joazeiro PP, Omori Y, et al. Control ofintracellular movement of connexins by E-cadherin in murine skinpapilloma cells[J]. Exp Cell Res, 2001, 270(2): 235-47. |
| [26] | Tsujiuchi T, Shimizu K, Itsuzaki Y, et al. CpG sitehypermethylation of E-cadherin and Connexin26 genes inhepatocellular carcinomas induced by a choline-deficient L-AminoAcid-defined diet in rats[J]. Mol Carcinog, 2007, 46(4): 269-74. |
 2015, Vol. 42
2015, Vol. 42