文章信息
- 王储,张默函,金东洙,周宪春
- WANG Chu, ZHANG Mohan, JIN Dongzhu, ZHOU Xianchun
- 乳腺浸润性导管癌中线粒体DNA ATPase6和 ATPase8的转录水平及意义
- Transcriptional Levels of Mitochondrial DNA ATPase6 and ATPase8 in Breast Invasive Ductal Carcinoma and Related Significance
- 肿瘤防治研究, 2015, 42(12): 1202-1205
- Cancer Research on Prevention and Treatment, 2015, 42(10): 1202-1205
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.10.004
-
文章历史
- 收稿日期: 2015-03-13
- 修回日期: 2015-05-04
2. 133000 延吉,延边大学附属医院教育培训处
2. Office of Education and Training, Yanbian University Hospital, Yanji 133000, China
乳腺癌是危害女性健康的常见恶性肿瘤之 一,而浸润性导管癌则是乳腺癌最常见的病理类 型。线粒体DNA(mitochondrial,mtDNA)作为 唯一存在于细胞核外的遗传物质,已被发现与多 种肿瘤的发生、发展有关[1]。mtDNA ATPase6与 ATPase8是编码呼吸链复合体Ⅴ亚基的基因,即共 同编码ATP合酶(ATP syntherase)的F0部分[2]。由 于F0对ATP的产生有导向作用,因此研究ATPase6 与ATPase8在乳腺浸润性导管癌组织中的转录水 平,对于了解乳腺癌的发生、发展以及肿瘤细胞 的能量供应方式具有重要的理论意义。本研究采 用RT-PCR法检测25例乳腺浸润性导管癌组织及相 应癌旁组织的mtDNA ATPase6与ATPase8 mRNA, 并结合相关临床病理参数进行分析,旨在探讨 mtDNA ATPase6与ATPase8的变化在浸润性乳腺导 管癌发生、发展中的作用。
1 资料与方法 1.1 一般资料收集2005年5月—2010年5月在延边大学附属 医院治疗的25例患者,均经病理诊断为乳腺浸润 性导管癌。患者年龄36~73岁,平均年龄(51.73± 7.54)岁。手术后立即切取部分新鲜癌组织及癌旁 组织(距癌组织边缘>5 cm,病理排除不典型增 生及原位癌),立即投置于液氮,后转置于-70℃ 冰箱保存备用[3]。按照WHO国际标准进行TNM临 床分期:Ⅰ期5例,Ⅱ期13例,Ⅲ期7例,其中有 淋巴结转移15例,无淋巴结转移10例。
1.2 实验方法总RNA提取及RT-PCR检测:取相互对应的 癌组织及癌旁组织各60~80 mg,组织匀浆后溶于 TRIzol液。氯仿分离蛋白,异丙醇沉淀RNA,并 溶于75%乙醇(无核酸酶)后真空干燥,最后溶 于DEPC处理过的去离子水,-70℃保存。选用 德国Eppendorf公司Mastercycler nexus型PCR仪, 按照美国Promega公司的一步法RT-PCR试剂盒 操作要求进行PCR扩增,引物序列为ATPase6: 5′-ATCTGTTCGCTTCATTCATTGC-3′(正义), 5′-ATCAGGTTCGTCCTTTAGTGTTG-3′(反 义),654 bp,退火温度60℃;ATPase8:5′-GCGACTTACGTGACCAATCTGTACG- 3′(正义), 5′-TCAATCCACAGCAGTGGTATAAGCC-3′(反 义),186 bp,退火温度62℃;β-actin:5′-ATCATGTTTGAGACCTTCAACA- 3′(正义), 5′-CATCTCTTGCTCGAAGTCCA-3′(反义), 313 bp,退火温度60℃。反应条件为48℃反转录反 应45 min,94℃灭活AWV反转录酶活性及引物变 性2 min,然后94℃ 30 s,退火温度1 min,68℃ 2 min,循环40次,68℃ 7 min,4℃冷却。2%琼脂糖 凝胶电泳检测,以β-actin为参考,Gel Doc XR凝胶 成像分析系统成像分析,计算ATPase6与ATPase8 mRNA的相对含量。
1.3 统计学方法实验数据采用(x±s)表示,应用SPSS17.0 统计学软件处理数据,采用t检验及单因素方差分 析,P<0.05为差异有统计学意义。 2 结果 癌组织及癌旁组织mtDNA ATPase6与ATPase8 的转录水平。RT-PCR扩增后,mtDNA ATPase6与 ATPase8 mRNA在癌组织与癌旁组织的相对表达量 的比较结果具有相似性,他们在癌组织均明显高 于癌旁组织(P<0.01)。结合相关临床病理参数 分析比较癌组织mtDNA ATPase6与ATPase8 mRNA 的相对表达量也具有相似性,表现在淋巴结转移阳 性高于淋巴结转移阴性,两者比较差异有统计学意 义(P<0.05);TNM分期Ⅱ期较Ⅰ期高,两者比 较差异有统计学意义(P<0.05);Ⅲ期也较Ⅰ期 高,两者比较差异有统计学意义(P<0.01);而 TNM分期Ⅱ期与Ⅲ期及年龄分组比较差异无统计 学意义(P>0.05),见表 1、图 1~2。
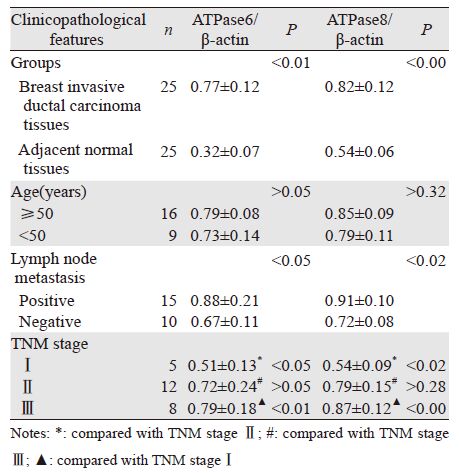 |
|
| P: adjacent normal tissues; n=25; C: breast invasive ductal carcinoma tissue; *: P<0.01, compared with P 图 1 乳腺浸润性导管癌组织与癌旁组织mtDNA ATPase6 mRNA的表达 (n=25) Figure 1 Comparison of mitochondrial DNA (mtDNA) ATPase6 mRNA expression between breast invasive ductal carcinoma and adjacent normal tissues (n=25) |

|
| *: P<0.01, compared with P 图 2 乳腺浸润性导管癌组织与癌旁组织mtDNA ATPase8 mRNA的表达 (n=25) Figure 2 Comparison of mtDNA ATPase8 mRNA expression between breast invasive ductal carcinoma and adjacent normal tissues (n=25) |
细胞代谢依赖ATP提供能量,肿瘤细胞也不 例外。细胞产生ATP的方式主要有两种:氧化磷 酸化和糖酵解。其中,氧化磷酸化在正常细胞中 发生;而糖酵解则在肿瘤细胞中发生[4]。造成这 一结果的原因有很多,包括HIF等相关细胞因子 激活、糖酵解关键酶或载体数量或活性改变、氧 化磷酸化功能损坏等。呼吸链复合体Ⅴ又称ATP 合酶,是氧化磷酸化过程中发挥核心作用的酶, 主要有F0和F1两部分组成。其中,F1具有催化 ATP合成或水解活性的作用,而F0的主要功能则 是构成离子通道,便于质子流通过,对于ATP产 生具有导向作用[5]。F0的两个主要亚基由mtDNA ATPase6与ATPase8编码。乳腺癌发生过程中, 癌细胞对能量的需求增高,细胞内糖酵解途径增 强。由于肿瘤细胞氧化磷酸化功能损坏,其组成 译均应下调。但本研究发现乳腺癌癌组织mtDNA ATPase6与ATPase8的转录水平较癌旁组织明显增 强。而我们前期研究发现乳腺癌组织mtDNA拷贝 量下降[6]。mtDNA ATPase6与ATPase8作为mtDNA 的重要组成部分,其转录水平不降反升的现象更 具研究价值。考虑原因可能为:(1)由于F0的 ATP产生的导向作用,在糖酵解产生ATP过程中,F0也发挥着一定的作用,这要求其组成部分的表 达上调;(2)乳腺癌发生、发展需要多种信号通 路及蛋白复合物参与。mtDNA ATPase6与ATPase8 编码蛋白参与了其他蛋白复合物构成,且此种复 合物对乳腺癌发生、发展起到一定作用。这两点 我们将在今后的研究中逐一进行探讨与验证。本 研究还结合相关临床病理参数。患者年龄、淋巴 结转移、TNM分期是常用的乳腺癌临床病理参 数,也是判断乳腺癌转移及预后的重要指标[7, 8]。 通过研究,我们发现有淋巴结转移者较无淋巴 结转移者转录水平增高,表明mtDNA ATPase6与 ATPase8可能参与了乳腺癌的转移,但ATPase6与 ATPase8在转移过程中的具体作用不详。同时我们 还发现TNM分期中mtDNA ATPase6与ATPase8的转 录水平表现为Ⅱ、Ⅲ期较Ⅰ期增高,其中Ⅲ期最 为显著。TNM分期主要反映的是肿瘤大小、淋巴 结转移、远处转移。此项研究结果也验证了我们 的假设。至于mtDNA ATPase6与ATPase8的转录与 肿瘤大小的关联,我们将进行后续研究。综上所 述,我们认为mtDNA ATPase6与ATPase8参与了乳 腺浸润性导管癌的发生,其作用机制可能与能量 供应有关;同时mtDNA ATPase6与ATPase8也参与 了乳腺浸润性导管癌的转移,但其具体作用机制 有待进一步研究。
| [1] | Ghatak S, Lallawmzuali D, Mukherjee S, et al. Polymorphism in mtDNA control region of Mizo-Mongloid Breast Cancer samples as revealed by PCR-RFLP analysis[J]. MitochondrialDNA, 2014: 1-4. |
| [2] | Ghaffarpour M, Mahdian R, Fereidooni F, et al. The mitochondrial ATPase6 gene is more susceptible to mutation than the ATPase8 gene in breast cancer patients[J]. Cancer Cell Int, 2014, 14(1): 21. |
| [3] | Zhang MH, Zhou XC, Li LC, et al. Manganese superoxide dismutase expression and clinical significance in breast invasive ductal carcinoma[J]. Lin Chuang Yu Shi Yan Bing Li Xue Za Zhi,2012, 28(9): 956-8, 962. [张默函, 周宪春, 李良昌, 等. 锰超氧化物歧化酶在乳腺浸润性导管癌中的表达及临床意义[J]. 临床与实验病理学杂志, 2012, 28(9): 956-8, 962.] |
| [4] | Kim H, Yokoyama W, Davis PA. TRAMP prostate tumor growth is slowed by walnut diets through altered igf-1levels, energypathways, and cholesterol metabolism[J]. J MedFood, 2014, 17(12): 1281-6. |
| [5] | Koch-Koerfges A, Kabus A, Ochrombel I, et al. Physiology and global gene expression of a Corynebacterium glutamicum ΔF(1)F(O)-ATP synthase mutant devoid of oxidative phosphorylation[J]. Biochim Biophys Acta, 2012, 1817(2):370-80. |
| [6] | Zhang MH, Jin DZ, Jin YS. Significance of alterations of mitochondrial DNA copy number in breast carcinoma[J]. Jie Pou Xue Bao, 2009, 40(1): 44-6. [张默函, 金东洙, 金映杉. 乳腺癌中线粒体DNA拷贝量变化意义[J]. 解剖学报, 2009, 40(1): 44-6.] |
| [7] | Zhang YL, Fang NZ, You JC, et al. Advances in the Relationship Between Tumor Cell Metabolism and Tumor Metastasis[J].Zhongguo Fei Ai Za Zhi, 2014, 17(11): 812-8. [张亚龙, 房念珍,尤嘉琮, 等.肿瘤细胞代谢与肿瘤转移相互关系的研究进展[J]. 中国肺癌杂志, 2014, 17(11): 812-8.] |
| [8] | Li QX, Xing YJ, Zhao J, et al. Correlation between Molecular Subtypes and Clinical Features in Invasive Ductal Carcinoma of Breast[J]. Zhong Liu Fang Zhi Yan Jiu, 2013, 40 (4): 341-4. [李庆霞, 邢雅军, 赵静, 等. 乳腺浸润性导管癌分子分型与临床特征的关系[J]. 肿瘤防治研究, 2013, 40 (4): 341-4.] |
 2015, Vol. 42
2015, Vol. 42


