文章信息
- 王雅琴,陈智.
- WANG Yaqin, CHEN Zhi.
- 载脂蛋白E对结直肠癌细胞侵袭迁移能力的影响
- Effect of Apolipoprotein E on Invasion and Migration of Colorectal Cancer Cells
- 肿瘤防治研究, 2015, 42(12): 1198-1201
- Cancer Research on Prevention and Treatment, 2015, 42(12): 1198-1201
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.12.006
-
文章历史
- 收稿日期: 2014-11-10
- 修回日期: 2015-03-19
自Warburg效应提出以来,人们对于肿瘤细胞代谢异常有了更多新的认识。近年来,研究表明肿瘤细胞在氧充足条件下,仍以糖酵解为主要供能方式,而且多伴有脂肪代谢的异常,表现为高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)和甘油三酯(triglyceride,TG)及不同亚型的载脂蛋白表达紊乱[1, 2, 3]。既往研究提示结直肠癌与肥胖及代谢异常有一定的相关性,但载脂蛋白E(apolipoproteinE,ApoE)在结直肠癌中的作用尚不清楚,本研究拟利用结直肠癌细胞系SW48作为细胞模型,观察ApoE对于结直肠癌细胞侵袭转移能力的影响。
1 材料与方法1.1 细胞及试剂人结直肠癌细胞系S W 4 8 购自中科院上海细胞库;ApoE过表达质粒购自山东维真生物有限公司,ApoE特异性siRNA由广州锐博生物公司设计并合成。转染脂质体购自上海汉恒生物有限公司。Transwell(8 μm孔径)及培养板耗材等均购自武汉启动子生物有限公司。抗ApoE抗体(CST,No.13366),抗MMP-2抗体(CST,No.3195),抗MMP-9抗体(CST,No.5741),抗TIMP-2抗体(CST,No.3879)及抗GAPDH抗体(CST,No.5174)购自上海优宁维生物有限公司。PCR引物(由北京天一辉远生物有限公司设计并合成):ApoE(F:GTTGCTGGTCACATTCCTGG,R:GCAGGTAATCCCAAAAGCGAC),GAPDH (F:CTGGGCTACACTGAGCACC,R:AAGTGGTCGTTGAGGGCAATG)。
1.2 细胞培养及转染SW48细胞培养于含10%胎牛血清的RPMI1640培养液中,置于37℃、5%CO2温箱内培养,用0.25%胰蛋白酶消化常规传代。将SW48传代接种于无菌6孔板中,细胞贴壁后,换为无血清培养液置于培养箱中,同时各取250 μl无血清培养液分别稀释10 μl脂质体及4 μg ApoE过表达质粒或20nmol ApoE特异性siRNA,静置10 min后轻柔混匀再静置10 min后均匀加入细胞上清液中,6 h后换为完全培养液继续培养48 h行后续实验。
1.3 实验分组实验分为四组,空白对照组(Blank)、阴性对照组(Control)、ApoE沉默组(si-ApoE)、过表达ApoE组(ApoE)。
1.4 实时荧光定量PCR(Real time-qPCR)检测ApoE表达检测转染48 h后SW48中ApoE的表达:收集1×106个/细胞,通过TRIzol一步法提取细胞总RNA,反转录合成cDNA,应用上述引物行PCR扩增,ABI7300检测并分析各细胞中ApoE的mRNA水平,每组实验设3个复孔,实验重复3次。
1.5 Transwell侵袭实验收集转染后的各组细胞,重悬于无血清RPMI1640培养液,以5×104/孔密度加入到预铺好Matrigel胶的Transwell小室上室内,下室加入500 ml完全培养液,置于37℃、5%CO2的细胞培养箱中培养24 h后多聚甲醛固定,0.01%结晶紫染色,200倍光学显微镜下计数穿膜细胞数,随即取5个视野,取平均值,每组实验设3个复孔,实验重复3次。
1.6 Transwell迁移实验收集转染后的各组细胞,重悬于无血清RPMI1640培养液,以5×104个/孔密度加入到Transwell小室上室内,下室加入500 ml完全培养液,置于37℃、5%CO2的细胞培养箱中培养24 h后多聚甲醛固定,0.01%结晶紫染色,200倍光学显微镜下计数穿膜细胞数,随即取5个视野,取平均值,每组实验设3个复孔,实验重复3次。
1.7 免疫印迹(Western blot)实验收集上述转染后的各组细胞,裂解获取细胞总蛋白,蛋白样品行聚丙烯酰胺凝胶电泳,PVDF膜转膜并用脱脂奶粉封闭非特异性结合,然后依次孵育一抗及二抗,最后用ECL显色液显影检测细胞中ApoE、MMP-2、MMP-9及TIMP-2的表达,以GAPDH作为内参,实验重复3次。
1.8 统计学方法用SPSSl2.0统计学软件进行统计分析。实验数据以均数±标准差表示,组间比较采用t检验。 P<0.05为差异有统计学意义。
2 结果2.1 Real time-qPCR检测结直肠癌细胞中ApoE的表达情况通过Real time-qPCR检测转染48 h后的SW48中ApoE的表达,利用GAPDH作为内参,结果提示转染ApoE过表达质粒可以明显升高细胞中ApoE的mRNA水平:空白对照组(Blank)中ApoE mRNA水平为(1.00±0.01)、阴性对照组(Control)中ApoE mRNA水平为(1.02±0.06),过表达ApoE组(ApoE)中ApoE mRNA水平为(14.85±0.18),与阴性对照组相比,差异有统计学意义( P=0.008),而转染ApoE特异性siRNA可以显著降低细胞中ApoE的mRNA水平,ApoE沉默组(si-ApoE)中ApoE mRNA水平为(0.12±0.03),与阴性对照组相比,差异有统计学意义( P=0.013),见图 1。
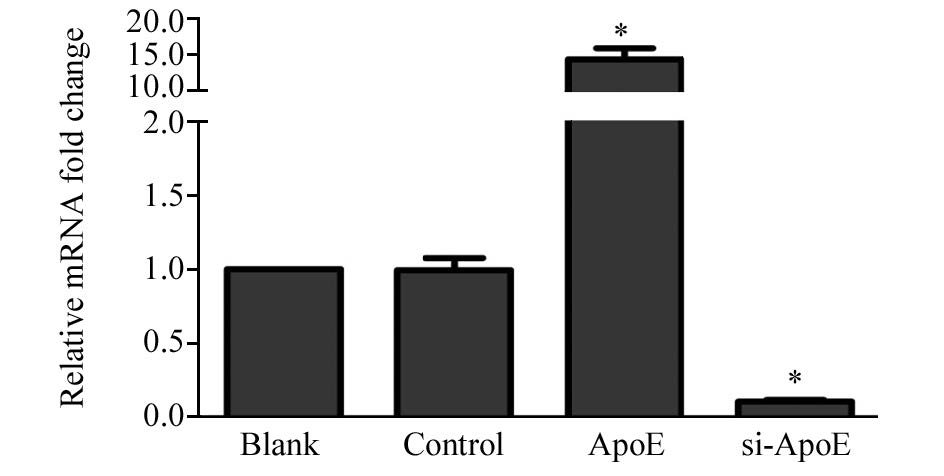
|
| *: P<0.05, compared with control group 图 1 Real-time-qPCR法检测结直肠癌细胞中ApoE的表达 Figure 1 ApoE expression in colorectal cancer(CRC) cells detected by Real-time-qPCR |
Transwell小室检测结果提示,过表达ApoE组穿膜细胞数为(67±9)个/视野,相比阴性对照组(228±11)个/视野及空白对照组(209±17)个/视野显著减少,差异有统计学意义( P=0.022);而ApoE沉默组穿膜细胞数为(428±15)个/视野,相比阴性对照组及空白对照组显著增多,差异有统计学意义( P=0.017),见图 2。
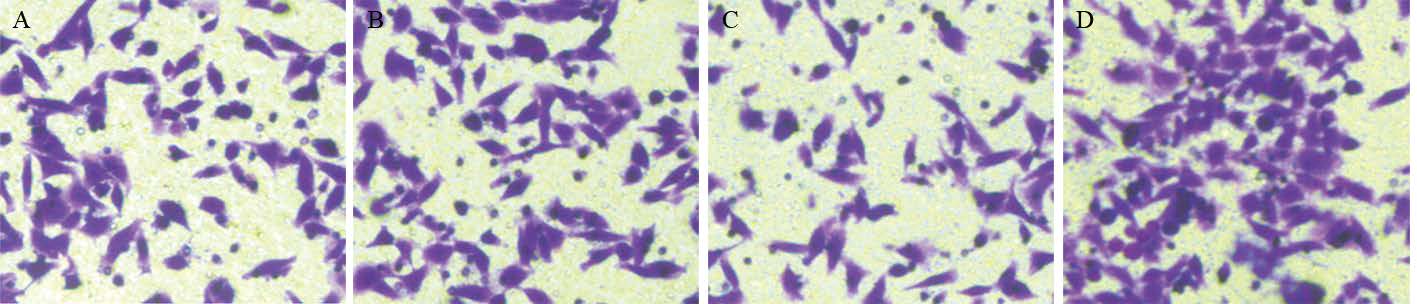
|
| A: blank; B: control; C: ApoE; D: si-ApoE 图 2 ApoE对结直肠癌细胞侵袭能 力的影响 Figure 2 Ef f e c t o f ApoE o n invasion ability of CRC cells |
Transwell小室检测结果提示:过表达ApoE组穿膜细胞数为(133±11)个/视野,相比阴性对照组(338±21)个/视野及空白对照组(326±18)个/视野显著减少,差异有统计学意义( P=0.032);而ApoE沉默组穿膜细胞数为(518±13)个/视野,相比阴性对照组及空白对照组显著增多,差异有统计学意义( P=0.034),见图 3。
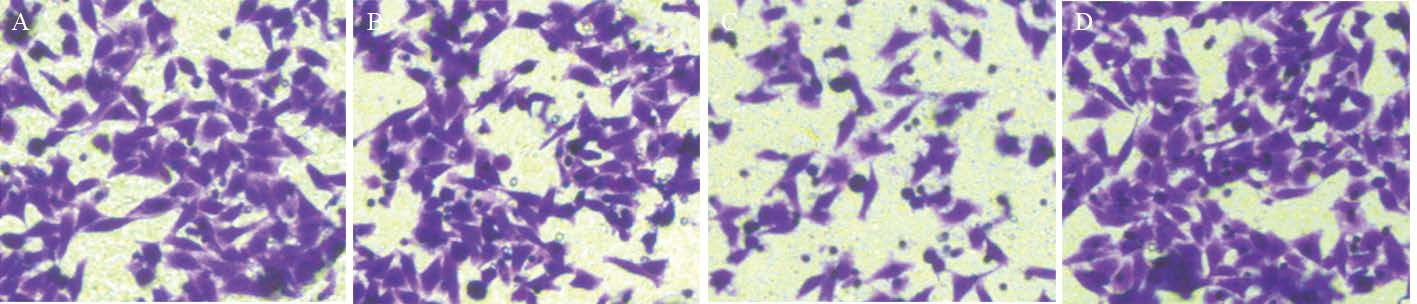
|
| A: blank; B: control; C: ApoE; D: si-ApoE 图 3 ApoE对结直肠癌细胞迁移能 力的影响 Figure 3 Ef f e c t o f Ap oE o n migration ability of CRC cells |
Western blot法检测结果发现:过表达ApoE组MMP-2、MMP-9的表达明显降低( P=0.015及0.018),TIMP-2的表达增高( P=0.039),而ApoE沉默组MMP-2、MMP-9的表达明显升高( P=0.037及0.041),TIMP-2的表达降低( P=0.014),见图 4。
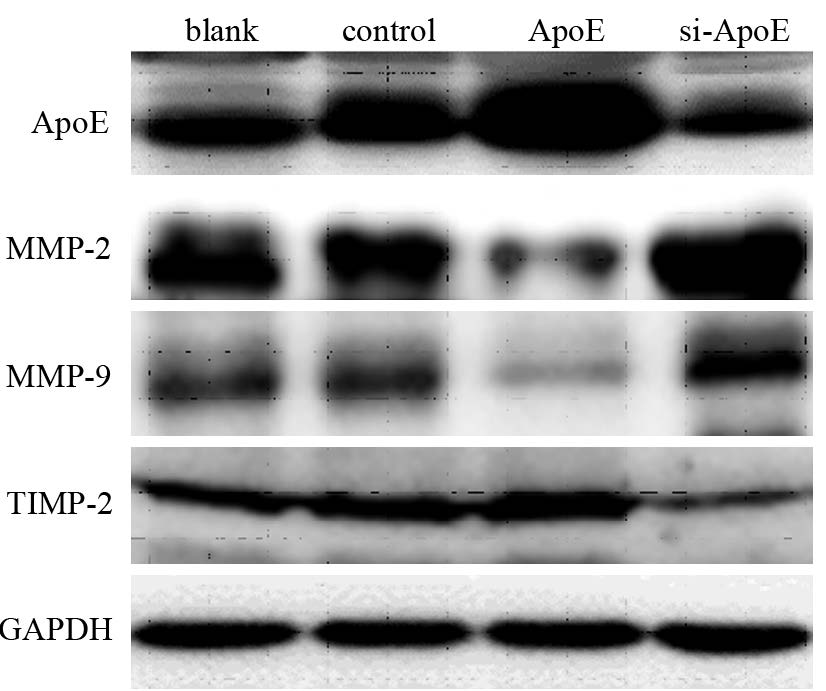
|
| 图 4 ApoE对基质金属蛋白酶家族相关蛋白表达的影响 Figure 4 Effect of ApoE on expression of MMP family proteins |
一般认为肿瘤细胞处于高代谢状态,比其他正常组织细胞具有更强的摄取养分的能力,但研究表明肿瘤细胞摄取养分后主要以有氧糖酵解作为主要的能量来源,而且伴有脂类代谢异常,既往研究表明,某些调控脂代谢的关键分子的表达或功能异常,可能参与肿瘤的发生发展,如HDL及TG增高是肿瘤发生发展的独一危险因素,维生素D受体及过氧化物酶体增殖物激活受体(peroxisomeproliferator-activated receptor,PPAR)可通过调节脂质合成促进前列腺癌的增殖,又如脂肪酸、花生四烯酸、磷脂酸、溶血磷脂酸及鞘氨醇等既是脂代谢中的代谢产物,又可作为信号通路的激活物或抑制物参与肿瘤的增殖及生长[4, 5]。ApoE作为载脂蛋白家族的重要成员之一,在脂肪酸及胆固醇代谢中发挥重要作用,ApoE敲除小鼠往往会出现高脂血症,并伴有动脉粥样硬化等心脑血管疾病,新近研究表明ApoE在认知及记忆能力方面也有一定的作用,ApoE的不同表型可能与乳腺癌、神经系统肿瘤的预后和发病风险相关[6, 7, 8]。近年来随着人们生活水平的提高及饮食结构的改变,如高糖高脂的摄入,结直肠癌发病率逐年攀升,而肿瘤晚期多发性转移是目前治疗中的难点,尚缺乏特异性的高效化疗药物,因此我们通过体外侵袭迁移实验,希望明确ApoE对结直肠癌细胞侵袭转移能力的影响。
本实验通过转染ApoE过表达质粒及其特异性的siRNA,成功干预结直肠癌细胞SW48中ApoE的表达,通过Transwell小室模拟肿瘤转移必须穿过血管内皮基底膜,预铺Matrigel胶可以模拟血管内皮细胞基底膜,从而更加贴近于肿瘤体内转移的病理学特征。本实验发现,不管是在预铺Matrigel的侵袭实验,还是在没有Matrigel胶的迁移实验中,过表达ApoE均可减少结直肠癌细胞系SW48穿过Transwell的细胞数,即抑制结直肠癌细胞的侵袭迁移,而沉默ApoE则恰恰相反,可以促进结直肠癌细胞的侵袭迁移。这些结果提示ApoE可能在结直肠癌细胞的侵袭迁移等转移的过程中发挥一定的作用,因此本实验进一步通过免疫印迹实验探索其中可能的分子机制。基质金属蛋白酶家族是目前公认的调控肿瘤侵袭转移的关键分子,不同类型的基质金属蛋白酶表达增高或者活性升高,抑或TIMP-2等基质金属蛋白酶抑制物的下调都能促进肿瘤的侵袭转移[9, 10]。我们发现过表达ApoE可以显著抑制MMP-2及MMP-9的表达,上调TIMP-2的表达,抑制肿瘤细胞的迁移及侵袭能力,从而抑制肿瘤的远处转移;而沉默ApoE则相反可以促进肿瘤细胞对周围组织的侵袭,增加肿瘤从原发灶脱落,进入血管发生转移,因此推断ApoE可能通过基质金属蛋白酶家族调控结直肠癌细胞的侵袭迁移,而既往研究表明ApoE有望作为肺腺癌转移的分子治疗标志,ApoE的临床表达差异与胰腺癌的发生相关,而且可以通过调控胆固醇的代谢平衡参与前列腺癌的侵袭及转移[11, 12, 13],本研究可能为ApoE等脂代谢分子参与恶性肿瘤的增殖及转移提出了新的可能机制。
综上所述,本研究发现,在结直肠癌细胞中过表达ApoE可抑制细胞的侵袭及迁移能力,而沉默ApoE可促进细胞的侵袭迁移。干预ApoE后基质金属蛋白酶家族蛋白明显变化,提示ApoE可能通过基质金属蛋白酶家族蛋白调控结直肠癌的侵袭转移,在结直肠癌的发生发展发挥重要作用,为晚期转移性结直肠癌的临床治疗提供了新的药物靶点及监测指标。
| [1] | Algamas-Dimantov A, Yehuda-Shnaidman E, Hertz R, et al.Prevention of diabetes-promoted colorectal cancer by (n-3)polyunsaturated fatty acids and (n-3) PUFA mimetic[J].Oncotarget, 2014, 5(20): 9851-63. |
| [2] | Wu X, Daniels G, Lee P, et al. Lipid metabolism in prostatecancer[J]. Am J Clin Exp Urol, 2014, 2(2): 111-20. |
| [3] | Deus CM, Coelho AR, Serafim TL, et al. Targeting mitochondrialfunction for the treatment of breast cancer[J]. Future Med Chem,2014, 6(13): 1499-513. |
| [4] | Chan AW, Gill RS, Schiller D, et al. Potential role of metabolomicsin diagnosis and surveillance of gastric cancer[J]. World JGastroenterol, 2014, 20(36): 12874-82. |
| [5] | Sotgia F, Martinez-Outschoorn UE, Lisanti MP. The reversewarburg effect in osteosarcoma[J]. Oncotarget, 2014, 5(18):7982-3. |
| [6] | Koleck TA, Bender CM, Sereika SM, et al. Apolipoprotein egenotype and cognitive function in postmenopausal women withearly-stage breast cancer[J]. Oncol Nurs Forum, 2014, 41(6):E313-25. |
| [7] | Chouinard-Watkins R, Plourde M. Fatty Acid Metabolism inCarriers of Apolipoprotein E Epsilon 4 Allele: Is It Contributing toHigher Risk of Cognitive Decline and Coronary Heart Disease[J].Nutrients, 2014, 6(10): 4452-71. |
| [8] | Calabuig-Navarro MV, Jackson KG, Walden CM, et al.Apolipoprotein E genotype has a modest impact on thepostprandial plasma response to meals of varying fat compositionin healthy men in a randomized controlled trial[J]. J Nutr, 2014,144(11): 1775-80. |
| [9] | Verma S, Kesh K, Ganguly N, et al. Matrix metalloproteinases andgastrointestinal cancers: Impacts of dietary antioxidants[J]. WorldJ Biol Chem, 2014, 5(3): 355-76. |
| [10] | Li NG, Tang YP, Duan JA, et al. Matrix metalloproteinaseinhibitors: a patent review[J]. Expert Opin Ther Pat, 2014, 24(9):1039-52. |
| [11] | Liu Z, Gao Y, Hao F, et al. Secretomes are a potential source ofmolecular targets for cancer therapies and indicate that APOE is acandidate biomarker for lung adenocarcinoma metastasis[J]. MolBiol Rep, 2014, 41(11): 7507-23. |
| [12] | Chen J, Wu W, Zhen C, et al. Expression and clinical significanceof complement C3, complement C4b1 and apolipoprotein E inpancreatic cancer[J]. Oncol Lett, 2013, 6(1): 43-8. |
| [13] | Ifere GO, Desmond R, Demark-Wahnefried W, et al.Apolipoprotein E gene polymorphism influences aggressivebehavior in prostate cancer cells by deregulating cholesterolhomeostasis[J]. Int J Oncol, 2013, 43(4): 1002-10. |
 2015, Vol. 42
2015, Vol. 42
