文章信息
- 袁鹏,岳天华,肖艳华,朱梁军,李晟,陈宝安,王传伟.
- YUAN Peng, YUE Tianhua, XIAO Yanhua, ZHU Liangjun, LI Sheng, CHEN Baoan, WANG Chuanwei.
- 阿霉素对不同转移能力肝癌细胞及肝癌干细胞相关基因表达的影响
- Influence of Adriamycin on Human Hepatocellular Carcinoma Cells with Different Metastatic Abilities and Expression of Cancer Stem Cell Related Genes
- 肿瘤防治研究, 2015, 42(12): 1192-1197
- Cancer Research on Prevention and Treatment, 2015, 42(12): 1192-1197
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.12.005
-
文章历史
- 收稿日期: 2014-11-27
- 修回日期: 2015-05-05
2. 210009 南京,江苏省肿瘤医院肿瘤内科;
3. 210009 南京,东南大学附属中大医院血液科;
4. 610041 成 都,四川大学华西药学院临床药学研究中心
2. Department of Oncology, Jiangsu Cancer Hospital, Nanjing 210009, China;
3. Department of Hematology, Zhongda Hospital Affiliated Southeast University, Nanjing 210009, China;
4. Research Center of Clinical Pharmacy, Huaxi School of Pharmacy, Sichuan University, Chengdu 610041, China
原发性肝癌(hepatocellular carcinoma,HCC)高复发转移率已成为肝癌患者死亡率居高不下的主要原因[1, 2, 3, 4]。肝癌干细胞在肝癌的发生、发展、转移复发及多药耐药中扮演着重要角色。然而至今尚未有公认的肝癌干细胞标志物,对肝癌干细胞的研究仍主要侧重于干细胞标志物的研究上。
目前,作为胚胎干细胞的特异性基因,在肝癌细胞系中已检测到了Oct4、Sox2和Nanog表达[5],或系干细胞致癌的一种证据。同时,研究表明[6]在肝癌干细胞中Wnt信号通路靶因子表达的降低导致肝癌转移及耐药性降低。最近,多家实验室发现亚基ARID1A(AT-rich interactive domain-containingpro-tein 1A)在卵巢癌、膀胱癌和胃癌等肿瘤中频繁发生基因突变[7, 8, 9, 10],因此推测在肝癌细胞中该基因也可能表达异常。目前,虽有研究报道[11]抗癌化学药物作用后,干细胞相关基因表达水平的变化,但所观察的基因有限。为了研究基因的共同作用机制,从而更全面地了解肝癌发生的机制,本研究对象涵盖了更多的候选肝癌相关基因。我们选用具有相似遗传背景但转移能力存在差异的人肝癌细胞系MHCC97-L和HCCLM3 ,观察广谱抗癌化疗药物阿霉素对不同转移能力肝癌细胞的凋亡诱导作用并计算各自半数致死浓度(LD50),用LD50的阿霉素对细胞模型进行处理,观察不同作用时间(0、2、4、12、24和72 h)干细胞相关基因Nanog、Oct-4、Sox2、ARID1A、Wnt5b在不同转移能力肝癌细胞系中的表达情况,以了解肝癌复发转移的分子机制,为肝癌干细胞靶向干预治疗寻求准确的标志物和靶点。
1 材料与方法1.1 材料与试剂人肝癌细胞株MHCC97-L、HCCLM3购自中国博慧斯生物医药科技有限公司。DMEM培养液、胎牛血清(FBS)和MTT试剂盒均购自美国Invitrogen公司,Nanog、Sox2、Oct4、ARID1A和Wnt5b抗体购自美国Cell Signaling Technology公司,阿霉素(adriamycin,ADM)购自意大利法玛西亚普强公司,激光共聚焦显微镜(日本Olympus公司),倒置显微镜(CKX41,日本Olympus公司),超净工作台(SW-CJ-2FD,苏州净化设备有限公司),恒温CO2培养箱(Model 310,美国Thermo公司),超低温冰箱(MDF-382E,日本SANYO公司)。
1.2 细胞培养人肝癌细胞系MHCC97-L、HCCLM3均为贴壁生长细胞,按5×105个/孔接种于48孔板,用DMEM培养液+10%胎牛血清(FBS+1%青霉素,置于37℃,5%CO2培养箱中培养。
1.3 MTT法检测ADM对肝癌细胞的作用细胞生长到指数生长期后,胰酶消化成细胞悬液,用枪头吸取少量细胞悬液计数,调节浓度为2×104/ml,按照每孔200 μl接种于96孔板中,培养箱中培养24 h,将培养液换成终浓度分别为0、0.5、1、2、3、4、5、6 μmol/L ADM培养液。继续培养72h,加入2 μl MTT,继续培养4 h,吸掉含有MTT的培养液,每孔加入150 μl二甲基亚砜(DMSO)培养液,37℃下培养10 min后在370 nm波长下测定各组吸光度值。
1.4 Western blot检测细胞中干细胞相关基因的表达将指数生长期的细胞按每孔5×105个接种于6孔板中,24 h后,加入LD50浓度的ADM[通过吸光度值计算药物对细胞的抑制率,根据ADM作用浓度与对应的抑制率,运用线性回归的方法(SPSS) 计算ADM对细胞的LD50],继续培养0、2、4、12、24、72 h后收集细胞。用细胞总蛋白提取试剂盒提取蛋白。
制备聚丙烯酰胺凝胶待用。将抽提出的蛋白100℃加热变性8 min,12 000 r/min离心5 min。上样于制备好的凝胶上,浓缩胶,分离胶电泳电压为80 V,电泳总时间2 h;指示剂溴酚蓝电泳至底部时,终止电泳;将蛋白质从SDS聚丙烯酰胺凝胶转移至硝酸纤维素膜(湿式转膜);用脱脂奶粉封闭后,PBS缓冲液冲洗,加入一抗Nanog(D73G4)XPRRabbit mAb 4℃孵育过夜后,PBS冲洗3遍,加入二抗DyLight 649标记山羊抗兔IgG(H+L)室温孵育2 h,PBS冲洗干净后,拍照。按上述方法,分别加入相应的抗体检测Oct-4、Sox2、ARID1A和Wnt5b基因的表达。
1.5 统计学方法数据分析采用SPSS16.0软件,利用回归概率模型计算ADM对细胞的半数致死浓度,计量资料以均数±标准差表示,资料符合正态分布且方差齐性时,多组比较采用单因素方差分析,两两比较用SNK法,检验水准为α=0.05, P<0.05为差异有统计学意义。
2 结果2.1 阿霉素对肝癌细胞的抑制作用M T T 法检测结果显示,对人肝癌细胞MHCC97-L和HCCLM3产生了不同程度的抑制作用,且阿霉素浓度越高抑制效应越明显,见图1。通过吸光度值计算药物对细胞的抑制率,根据ADM作用浓度与对应的抑制率,运用线性回归的方法(SPSS)计算ADM对MHCC97-L的LD50为0.4212 μmol/L,对 HCCLM3 的LD50为 0.5249μmol/L 。
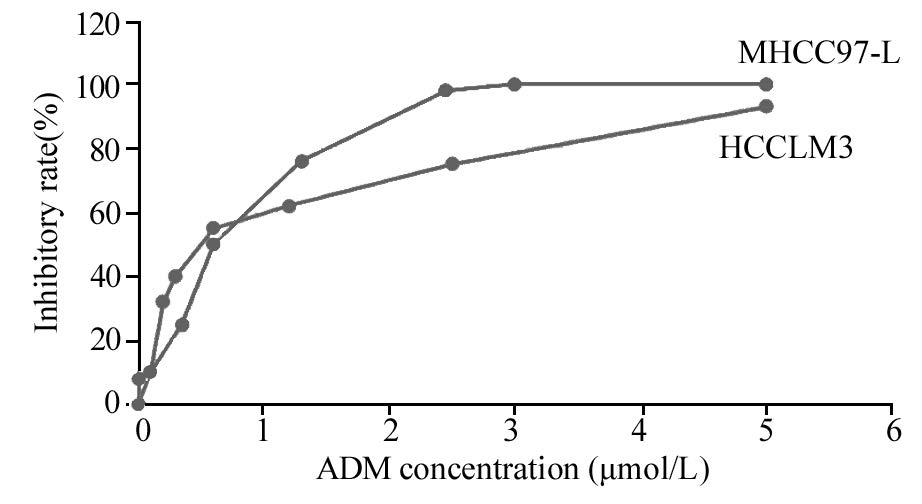
|
| 图 1 阿霉素对细胞系MHCC97-L、HCCLM3的抑制曲线 Figure 1 Growth-inhibitory curves of MHCC97-L and HCCLM3 cell lines treated with adriamycin(ADM) |
MHCC97-L中干细胞基因Nanog、Oct-4、Sox2、ARID1A、Wnt5b的表达在人低转移性肝癌细胞系MHCC97-L中,干细胞基因Wnt5b和Nanog蛋白均有明显表达,随ADM(LD50)作用时间的不同,基因蛋白表达量发生相应变化。在ADM(LD50)短时间(≤4h)作用下,随时间的延长,Wnt5b蛋白表达水平逐渐增高,Nanog蛋白表达水平逐渐降低,长时间(≥12 h)作用下,随时间的延长,Wnt5b蛋白表达水平逐渐降低,Nanog蛋白表达水平逐渐增高,见图 2~3。以Western blot检测目的蛋白条带灰度值(β-actin)表示干细胞相关基因相对表达量,Wnt5b和Nanog在人肝癌细胞系MHCC97-L中蛋白表达程度的差异有统计学意义( P=0.001)。而干细胞基因Sox2、ARID1A、Oct-4在细胞系MHCC97-L中不表达。
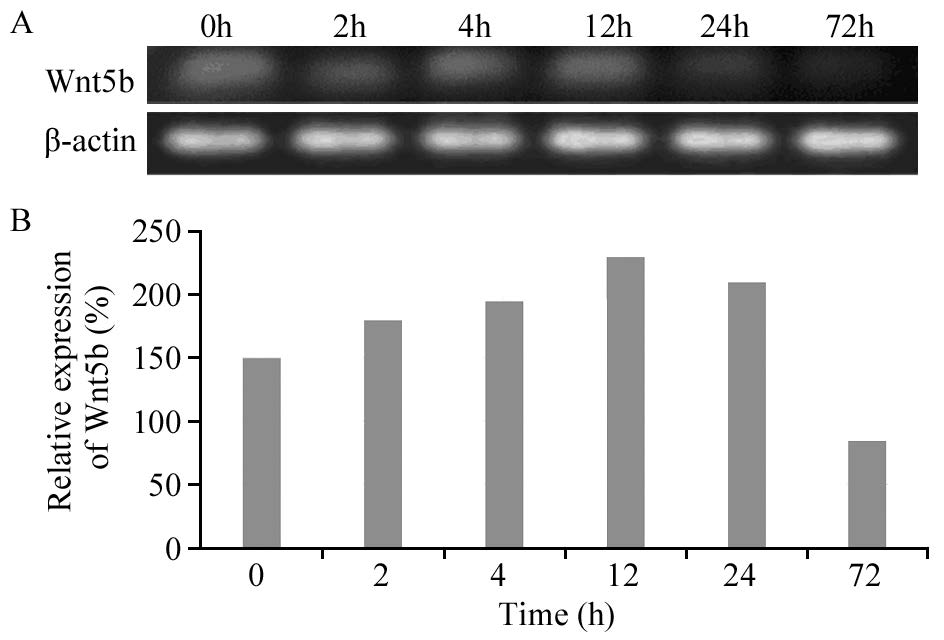
|
| 图 2 阿霉素作用下MHCC97-L中Wnt5b的表达 Figure 2 Expression levels of Wnt5b in MHCC97-L cell line treated with ADM detected by Western blot |
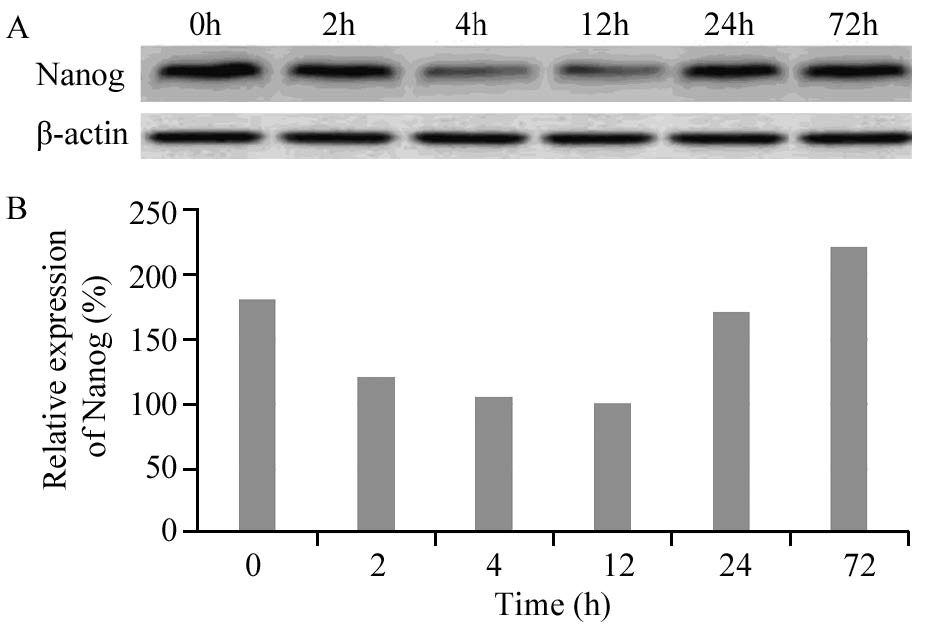
|
| 图 3 阿霉素作用下MHCC97-L中Nanog的表达 Figure 3 Expression levels of Nanog in MHCC97-L cell line treated with ADM detected by Western blot |
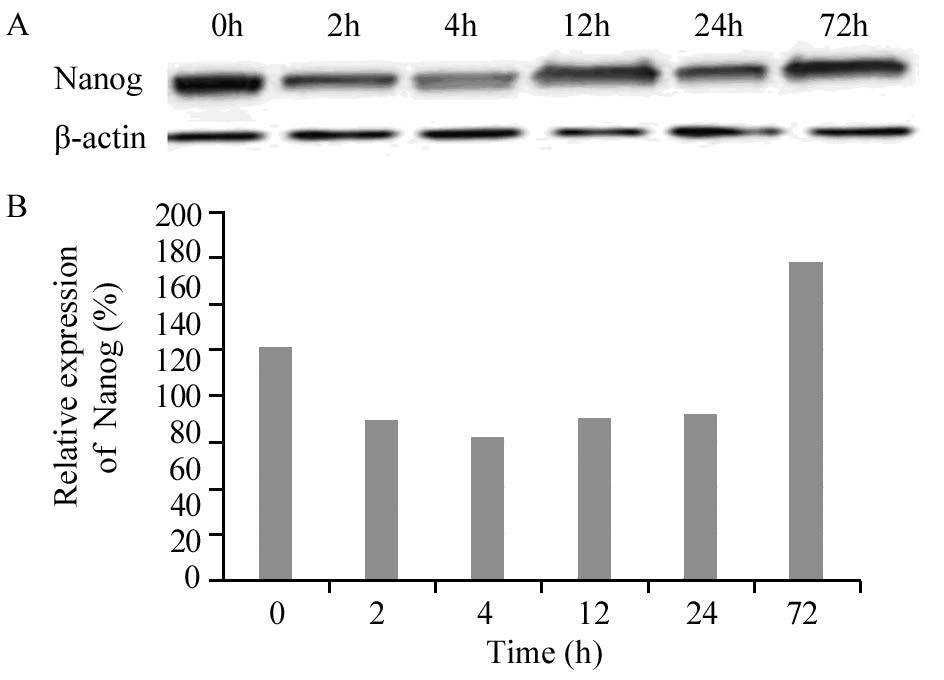
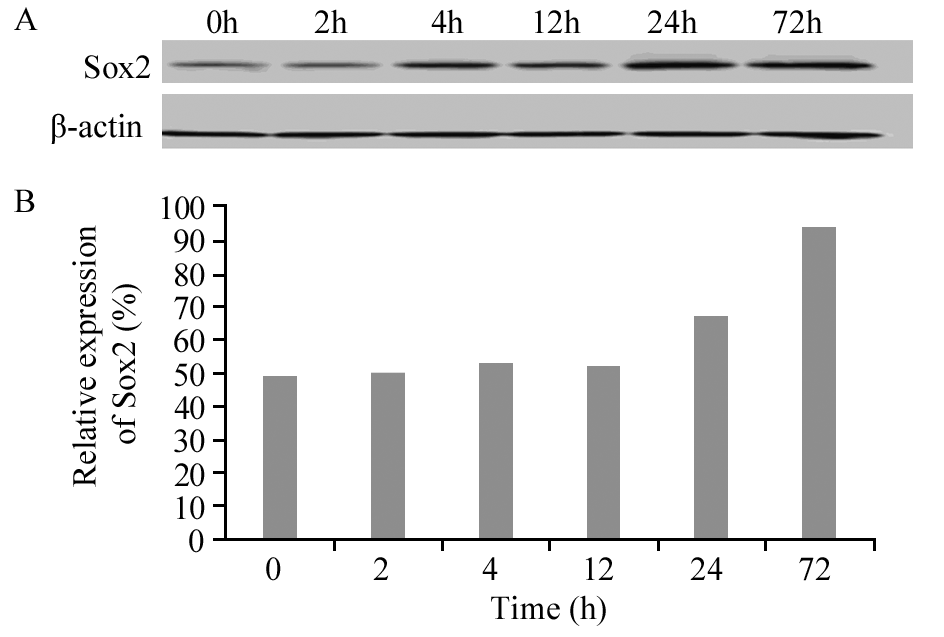
在人高转移性肝癌细胞系HCCLM3中,干细胞基因Sox2、Wnt5b和Nanog蛋白均有明显表达,随ADM(LD50)作用时间的不同,蛋白的表达量发生相应变化。Wnt5b和Nanog蛋白表达趋势在高转移细胞株HCCLM3中的表达与在低转移细胞株MHCC97-L中的表达趋势一致,在ADM(LD50)短时间(≤4 h)作用下,随时间的延长,Wnt5b蛋白表达水平逐渐增高,Nanog蛋白表达水平逐渐降低,长时间(≥12 h)作用下,随时间的延长,Wnt5b蛋白表达水平逐渐降低,Nanog蛋白表达水平逐渐增高,见图 4~5。无论是ADM(LD50)短时间还是长时间作用,随时间的延长,Sox2蛋白表达水平逐渐增高,见图 6。Sox2、Wnt5b和Nanog在人肝癌细胞系HCCLM3中蛋白表达程度的差异均有统计学意义( P=0.032, P=0.001, P=0.021)。而ARID1A、Oct-4在细胞系HCCLM3中同样不表达。
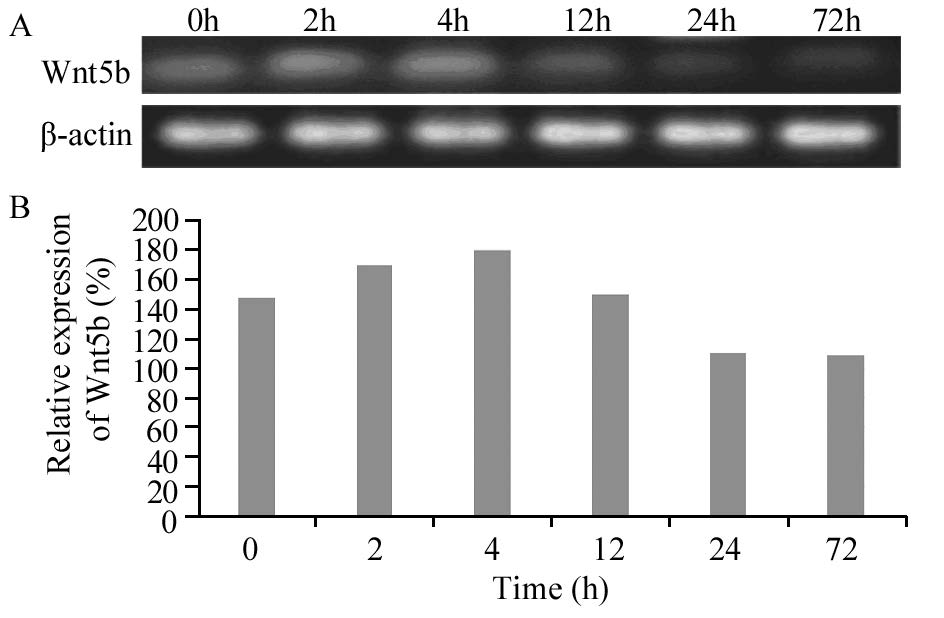
|
| 图 4 阿霉素影响下HCCLM3中Wnt5b的表达 Figure 4 Expression levels of Wnt5b in HCCLM3 cell line treated with ADM detected by Western blot |
|
| 图 5 阿霉素影响下HCCLM3中Nanog的表达 Figure 5 Expression levels of Nanog in HCCLM3 cell line treated with ADM detected by Western blot |
|
| 图 6 阿霉素影响下HCC LM3中Sox2的表达 Figure 6 Expression levels of Sox2 in HCCLM3 cell line treated with ADM detected by Western blot |
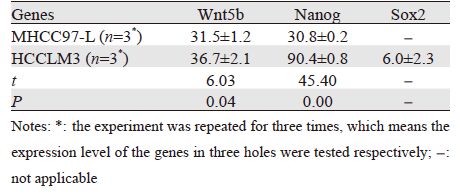
在ADM(LD50)短时间(≤4 h)作用下,干细胞基因在不同转移能力肝癌细胞的表达变化有差异。其中Wnt5b和Nanog(≤4 h)在低转移能力肝癌细胞系MHCC97-L中的表达变化均值均小于其在高转移能力肝癌细胞系HCCLM3中的表达变化均值,差异有统计学意义( P<0.05),见表 1。
 |
阿霉素(ADM)作为一种广谱抗肿瘤药物,通过干扰转录过程诱导肿瘤细胞凋亡[12, 13],然而目前包括ADM在内的传统化疗药物大多是对处于增殖期的细胞产生杀灭作用,虽然可以使肿瘤体积缩小甚至完全缓解,但却不能根除肿瘤干细胞(cancer stem cells,CSCs)。相反当癌细胞受到ADM刺激后,会引起一系列应激性保护反应,从而使细胞产生耐药性[14]。本研究首次较全面地分析了在ADM的作用下,肝癌相关基因Nanog、Oct4、Sox2、ARID1A和Wnt5b在两株转移能力不同的肝癌细胞系中表达水平的不同,有利于系统性地了解肝癌复发转移的分子机制,为肝癌干细胞靶向干预治疗寻求准确的标志物和靶点。
通过分析ADM对不同转移能力肝癌细胞抑制实验的结果,本研究发现ADM对肝癌细胞起到明显抑制作用,且对高转移肝癌细胞系HCCLM3的半数致死量(LD50)要高于低转移肝癌细胞系MHCC97-L,这与临床上早期即发生转移和手术后发生复发转移的肝癌患者具有更高耐药性的现象一致。同时,从图 1抑制曲线可见,当ADM处于低浓度(<0.625 μmol/L)时,相等剂量下ADM对HCCLM3细胞的抑制作用较MHCC97-L更强,但此时药物对肝癌细胞并不能起到明显的杀灭效果,而当ADM浓度逐渐增高(>1.25 μmol/L)时,药物对癌细胞的抑制作用也逐渐增强,但此时高转移能力肝癌细胞系HCCLM3较低转移能力肝癌细胞系MHCC97-L表现出更强的耐药性。
另外该实验通过采用ADM(LD50)作用于两株肝癌细胞模型,检测不同时间段干细胞基因Wnt5b、Nanog、Sox2、ARID1A和Oct4的表达情况。结果显示Wnt5b在肝癌细胞系MHCC97-L和HCCLM3中均有表达,做为Wnt蛋白家族中的一员,其在胚胎发育中起着重要作用,是调控细胞生长、发育与分化的关键通路之一[9]。在大约1/3的肝细胞癌中检测到Wnt信号的异常表达,突显了其在癌形成中的重要性[15]。Wnt信号通路成分的突变可使该通路不恰当激活,这种异常激活则与肿瘤的发生、发展有关[16]。有研究显示,正常肝脏组织中Wnt5b的表达比癌旁组织和肝癌组织高,而癌旁组织又明显高于癌组织[17]。本实验结果发现,随着ADM(LD50)作用时间的延长,Wnt5b的表达量在两株肝癌细胞模型中均呈现先升高后降低的过程,Yan等[8]的研究结果显示阿霉素与肝癌治疗抵抗有关,因此,我们推断随着ADM的作用,开始癌细胞受到明显的抑制,Wnt5b表达降低,但是随着培养时间的延长,ADM在抑制癌细胞生长的同时可能诱发了癌细胞的干细胞化,从而导致耐药性的增加,进一步导致Wnt5b表达水平的升高;且在相同条件下,拥有相似遗传背景而转移能力不同的两株肝癌细胞系中,高转移能力肝癌细胞株HCCLM3中Wnt5b蛋白的相对表达量要明显低于低转移肝癌细胞株MHCC97-L,这与Ding等[18]研究结果一致。由此推测Wnt5b与肝癌细胞的恶性程度呈负性相关。
Nanog是2003年5月末发现的一个新基因,它对维持胚胎干细胞亚全能性起关键性作用,Nanog基因在早期发育胚胎、胚胎瘤细胞和胚胎干细胞中均有表达[19, 20, 21, 22],但在已分化的胚胎干细胞中消失[23],并且目前还没有在已分化细胞中检测到Nanog基因表达的报道。本研究结果显示,两株不同能力的肝癌细胞系中均检测到Nanog基因的表达,可见在肝癌细胞中存在部分处于未分化状态的细胞。Lin等[24]、Piestun等[25]研究也提示Nanog基因的表达与体细胞向癌细胞转化有关。结合本研究结果,ADM(LD50)作用两株肝癌细胞模型较短时间(<4 h)时Nanog表达降低,但随着作用时间延长(≥12 h)表达逐渐增强,且在作用的最长时间点(72 h)表达量均达到最高,有研究猜想,Nanog是在细胞基因表达调节的动荡时期设定细胞状态的重要因子[16],由此推测ADM可能诱导了肝癌细胞由已分化状态向未分化即干细胞化的转变,通过细胞调节机制使细胞处于静止期,从而逃避了化疗药物的杀伤作用。Nanog的表达调控与化疗后肿瘤的复发甚至远处转移有关。
本研究还同时检测了Sox2、ARID1A及Oct4基因在两株不同转移能力肝癌细胞系的表达情况,但仅在高转移能力肝癌细胞系HCCLM3中检测到了Sox2的表达,ARID1A、Oct4在两株细胞模型中均未表达。Sox2是SOX家族成员之一,该基因可能参与了多种实体瘤的发生发展过程[26, 27, 28, 29]。近年来的研究证实在乳腺癌[30]、下咽部鳞癌[30]、肺腺癌[31]及卵巢癌[32]等疾病中均有Sox2的异常表达。本实验结果Sox2在低转移性肝癌细胞系MHCC97-L中无表达,在高转移性肝癌细胞系HCCLM3中表达,且随ADM(LD50)作用时间的延长逐渐增强,这与国内外关于实体瘤中Sox2表达的实验结果相似[32, 33, 34, 35],提示Sox2高表达其恶性程度更高,其过高表达可能参与了肝脏细胞的癌变过程,并可能与肝细胞癌的浸润转移关系非常密切。作为胚胎干细胞特异性基因,Oct4主要表达于胚胎和生殖细胞肿瘤中,虽然有部分研究者在肝癌Mahlava细胞系中也检测到了Oct4的表达,但本实验在MHCC97-L及HCCLM3中均未检测到其表达,Oct4基因与肝癌发生发展的关系有待于进一步研究。
综上所述,ADM促进MHCC97-L及HCCLM3细胞的凋亡,且对MHCC97-L的作用强于HCCLM3;干细胞相关基因Wnt5b与肝癌细胞的恶性程度呈负相关;干细胞相关基因Sox2仅在高转移能力肝癌细胞系中表达,且Sox2与Nanog在ADM长时间作用(≥12 h)下表达逐渐增高,提示其可能与肝癌转移及耐药密切相关。
| [1] | Jemal A, Siegel R, Xu J, et al. Cancer statistics, 2010[J]. CACancer J Clin, 2010, 60(5): 277-300. |
| [2] | Bosch FX, Ribes J, Díaz M, et al. Primary liver cancer: worldwideincidence and trends[J]. Gastroenterology, 2004(5): S5-S16. |
| [3] | Edwards BK, Ward E, Kohler BA, et al. Annual report tothe nationon the status of cancer, 1975–2006, featuring colorectal cancertrends and impact of interventions (risk factors, screening, andtreatment) to reduce future rates[J]. Cancer, 2010, 116(3): 544-73. |
| [4] | Kudo M, Okanoue T. Management of hepatocellular carcinoma inJapan: consensus-based clinical practice manual proposed by theJapan Society of Hepatology[J]. Oncology, 2007, 72(Suppl 1): 2-15. |
| [5] | Nadri S, Soleimani M, Kiani J, et al. Multipotent mesenchymalstem cells from adult human eye conjunctiva stromal cells[J].Differentiation, 2008, 76(3): 223-31. |
| [6] | Yamashita T, Ji J, Budhu A, et al. EpCAM-positive hepatocellularcarcinoma cells are tumor-initiating cells with stem/progenitorcell features[J].Gastroenterology, 2009, 136(3): 1012-24. |
| [7] | Wiegand KC, Shah SP, Al-Agha OM, et al. ARID1A mutations inendometriosis-associated ovarian carcinomas[J]. N Engl J Med,2010, 363(16): 1532-43. |
| [8] | Wu JN, Roberts CW. ARID1A mutations in cancer: anotherepigenetic tumor suppressor?[J]. Cancer Discov, 2013, 3(1):35-43. |
| [9] | Gui Y, Guo G, Huang Y, et al. Frequent mutations of chro-matinremodeling genes in transitional cell carcinoma of the bladder[J].Nat Genet, 2011, 43(9): 875-8. |
| [10] | Wang K, Kan J, Yuen ST, et al. Exome sequencing identifiesfrequent mutation of ARID1A in molecular subtypes of gastriccancer[J]. Nat Genet, 2011, 43(12): 1219-23. |
| [11] | Chiou SH, Wang ML, Chou YT, et al. Coexpression of oct4 andnanog enhances malignancy in lung adenocarcinoma by inducingcancer stem cell-like properties and epithelial-mesenchymaltransdifferentiation[J]. Cancer Res, 2010, 70(24): 10433-44. |
| [12] | Dean M, Fojo T, Bates S. Tumour stem cells and drugresistance[J]. Nat Rev Cancer, 2005, 5(4): 275-84. |
| [13] | Yoshida M, Suzuki T, Komiya T, et al. Induction of MRP5 andSMRP mRNA by adriamycin exposure and its overexpression inhuman lung cancer cells resistant to adriamycin[J]. Int J Cancer,2001, 94(3): 432-7. |
| [14] | Livingston DM, Silver DP. Cancer: crossing over to drugresistance[J]. Nature, 2008, 451(7182): 1066-7. |
| [15] | Boyault S, Rickman DS, deReyniès A, et al. Transcriptomeclassification of HCC is related to gene alterations and to newtherapeutic targets[J]. Hepatology, 2007, 45(1): 42-52. |
| [16] | Kuphal F, Behrens J. E-cadherin modulates Wnt-dependenttranscription in colorectal cancer cells butdoes not alter Wntindependentgene expression in fibroblasts[J]. Exp Cell Res, 2006,312(4): 457-67. |
| [17] | Yuan F, Zhou W, Zou C, et al. Expression of Oct4 in HCC andmodulation to wnt/β-catenin and TGF-β signal pathways[J]. MolCell Biochem, 2010, 343(1-2): 155-62. |
| [18] | Ding Sun, Lei Qin, Yang Xu, et al.Influence of adriamycin onchanges in Nanog, Oct-4, Sox2, ARID1 and Wnt5b expression inliver cancer stem cells[J]. World J Gastroenterol, 2014, 20(22):6974-80. |
| [19] | Hart AH, Harttley K, Parker K, et al. The pluripotencyhomeboxgene NANOG is expressed in human germ cell tumors[J]. Cancer,2005, 104(10): 2092-8. |
| [20] | Chambers I, Colby D, Robertson M, et al. Functional expressioncloning of Nanog, a pluripotency sustaining factor in embryonicstem cells[J]. Cell, 2003, 113(5): 643-55. |
| [21] | Chiou SH, Yu CC, Huang CY, et al. Positive correlations ofOct-4 and Nanog in oral cancer stem-like cells and high-gradeoral squamous cell carcinoma[J]. Clin Cancer Res, 2008, 14(13):4085-95. |
| [22] | Loh YH, Wu Q, Chew JL, et al. The Oct4 and Nanog transcriptionnetwork regulates pluripotency in mouse embryonic stem cells[J].Nat Genet, 2006, 38(4): 431-40. |
| [23] | Wu Da Y, Yao Z. Isolation and characterization of the murineNanog gene promoter[J]. Cell Res, 2005, 15(5): 317-24. |
| [24] | Lin T, Chao C, Saito S, et al. p53 induces differentiation of mouseembryonic stem cells by suppressing Nanog expression[J]. NatCell Biol, 2005, 7(2): 165-71. |
| [25] | Piestun D, Kochupurakkal BS, Jacob-Hirsch J, et al. Nanogtransforms NIH3T3 cells and targets cell-type restricted genes[J].Biochem Biophys Res Commun, 2006, 343(1): 279-85. |
| [26] | Shi Y, Sun G, Zhao C, et al. Neural stem cell self-renewl[J]. CritRev Oncol Hematol, 2008, 65(1): 43-53. |
| [27] | Avilion AA, Nicolis SK, Pevny LH, et al. Multipotent cell lineagesin early mouse development depend on SOX2 function[J]. GenesDev, 2003, 17(1): 126-40. |
| [28] | Saigusa S, Tanaka K, Toiyama Y, et al. Correlation of CD133,OCT4, and SOX2 in rectal cancer and their association withdistant recurrence after chemoradiotherapy[J]. Ann Surg Oncol,2009, 16(12): 3488-98. |
| [29] | Otsubo T, Akiyama Y, Yanagihara K, et al. SOX2 is frequentlydownregulated in gastric cancers and inhibits cell growth throughcell-cycle arrest and apoptosis[J]. Br J Cancer, 2008, 98(4): 824-31. |
| [30] | Lengerke C, Fehm T, Kurth R, et al. Expression of the embryonicstem cell marker SOX2 in early-stage breast carcinoma [J]. BMCCancer, 2011, 11: 42. |
| [31] | Ge N, Lin HX, Xiao XS, et al. Prognostic significance of Oct4 andSox2 expression in hypopharyngeal squamous cell carcinoma[J].J Transl Med, 2010, 8: 94. |
| [32] | Sholl LM, Barletta JA, Yeap BY, et al. Sox2 protein expressionis an independent poor prognostic indicator in stageⅠlungadenocarcinoma[J]. Am J Surg Pathol, 2010, 34(8): 1193-8. |
| [33] | Ye F, Li Y, Hu Y, et al. Expression of Sox2 in human ovarianepithelial carcinoma[J]. J Cancer Res Clin Oncol, 2011, 137(1): 131-7. |
| [34] | Chen Y, Shi L, Zhang L, et al. The molecular mechanismgoverning the oncogenic potential of SOX2 in breast cancer[J]. JBiol Chem, 2008, 283(26): 17969-78. |
| [35] | Park ET, Gum JR, Kakar S, et al. Aberrant expression of SOX2upregulates MUC5AC gastric foveolarmucin in mucinous cancersof the colorectum and related lesions[J]. Int J Cancer, 2008,122(6): 1253-60. |
 2015, Vol. 42
2015, Vol. 42


