文章信息
- 李金桥,梁培龙,吴峰,杨超,张洪玉,魏力军,戴钟铨,李莹辉.
- LI Jinqiao, LIANG Peilong, WU Feng, YANG Chao, ZHANG Hongyu, WEI Lijun, DAI Zhongquan, LI Yinghui.
- 乳腺癌细胞特异性MGA启动子的扩增及功能分析
- Amplification and Function of Specific Mammaglobin A Promoter in Breast Cancer Cells
- 肿瘤防治研究, 2015, 42(12): 1177-1782
- Cancer Research on Prevention and Treatment, 2015, 42(12): 1177-1782
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.12.002
-
文章历史
- 收稿日期: 2015-01-05
- 修回日期: 2015-03-18
2. 150001 哈尔 滨,哈尔滨工业大学生命科学与技术学院
2. School of Life Science and Technology, Harbin Institute of Technology, Harbin 150001, China
乳腺癌是在女性中最常见的恶性肿瘤疾病,患者死亡数居所有女性癌症的第二位[1]。传统的癌症治疗方法可能给患者带来各种损伤和并发症,肿瘤基因靶向治疗是一种新兴的癌症治疗手段,是将具有治疗作用的基因通过一定方式靶向性地导入癌细胞,大大减少治疗中的不良反应[2, 3]。然而,目前在基因靶向治疗中仍然存在着一些障碍,如高效、特异的载体系统等。
研究表明,人乳腺球蛋白(mammaglobin A,MGA)具有极高的乳腺组织特异性:MGA只在乳腺肿瘤组织和正常乳腺组织中表达[4, 5, 6];且在乳腺肿瘤组织中的RNA水平比正常乳腺组织高10倍[7]。调控MGA乳腺特异性及高表达的是其转录起始点5’上游5.5 kb大小的启动子序列,其中紧接转录起始点5’的344 bp最小启动子区域控制着表达的特异性,而在4.4kb到5.5 kb间的增强子控制着表达的高效性[7]。MGA启动子序列中存在多个转录因子结合位点,如YY1(-4846/-4864)、Nkx2.5(-53/-41)、AP1、Pu.1等。作为一类心脏同源异形盒转录因子,Nkx2.5在乳腺肿瘤细胞中也存在表达,并参与某些基因的转录调控[8];而转录因子YY1对乳腺肿瘤的形成也具有重要的调节作用[9, 10]。
本文希望通过对MGA启动子的研究,为针对乳腺癌的基因靶向治疗和在体药物筛选提供实验依据和理论支持。
1 材料与方法1.1 材料和试剂人乳腺癌细胞系T 4 7 D 、人胚肾细胞系HEK293T、肝脏细胞系HepG2、骨肿瘤细胞系MG63均为本实验室保存;含萤火虫萤光素酶(luciferase,LUC)报告基因的载体骨架pGL4.14以及双荧光素酶报告基因检测试剂盒均购自美国Promega公司;各种限制性内切酶以及T4连接酶均购自美国NEB公司;T载体pMD20购自TaKaRa公司(中国大连);2×TaqMix、DNA的Marker、质粒提取、胶回收试剂盒以及DH5α感受态细菌均购中国自康为世纪;定点突变试剂盒购自中国碧云天公司;DNA测序由中国三博远志公司完成;RPMI 1640和DMEM培养液均购自美国Hyclone公司;胎牛血清购自美国Gibico公司;细胞培养添加的胰岛素购自美国Sigma公司;转染试剂Lipofectamine® LTX以及OPTI-MEM培养液均购自美国Invitrogen公司;用PBS配制成15 mg/ml的溶液,分装后保存于-80℃至使用; BALB/c Nude裸鼠购自中国维通利华。超微量紫外分光光度计Q5000(Quawell,美国),核酸凝胶电泳系统(Bio-Rad,美国),细胞培养箱(Thermo,美国),生物化学发光仪(Berthold,德国),精诺真活体成像系统(IVIS LUMINA,美国)。
1.2 方法1.2.1 MGA启动子片段扩增和TA克隆载体构提取人的基因组为模板,设计引物MGA-F和MGA-R扩增大小为5 640 bp的MGA启动子大片段,见表 1。将PCR产物连接到pMD-20-T载体,挑选的阳性克隆,并通过三博远志公司测序鉴定。
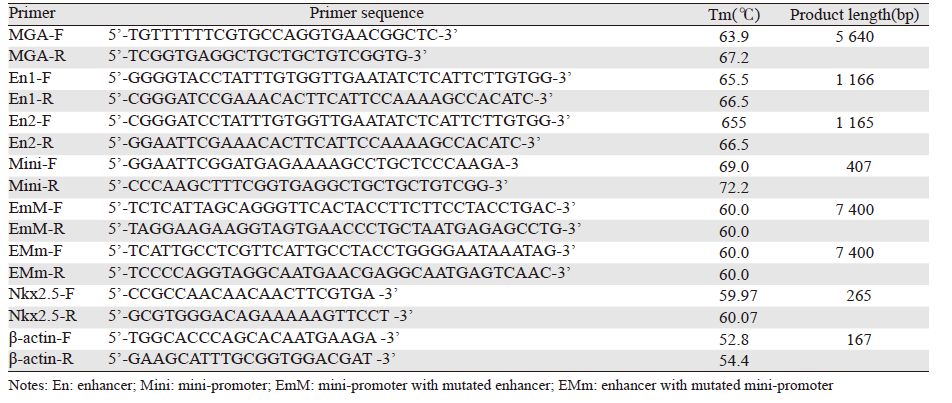 |
设计针对MGA启动子靶片段的引物并扩增MGA增强子和最小启动子,见表 1。将PCR产物和pGL4.14载体分别用限制性内切酶酶切后,连接、转化到DH5α中,对阳性克隆进行测序鉴定。在构建的含一个增强子和最小启动子(EM)重组载体的基础上,设计针对增强子区段YY1结合元件(TCCAGCCATCTTCTTTCTT)和最小启动子区段Nkx2.5结合元件(GGTGGAATTAAGA)的突变引物,见表 1,按照突变试剂盒说明进行突变载体构建。
1.2.3 细胞培养与转染在含5%CO2、37℃湿度饱和的恒温培养箱中,用含10%胎牛血清的高糖DMEM培养HEK293T细胞,低糖DMEM培养的HepG2和MG63细胞;用含10%胎牛血清、添加胰岛素(25 u/ml)的RPMI 1640培养T47D细胞。按Lipofectamine® LTX转染试剂说明,将含不同调控元件的MGA启动子驱动萤火虫荧光素酶报告基因载体与含海肾荧光素酶报告基因的内参质粒同时转染到HEK293T或T47D细胞中(重组载体:内参质粒=50:1);转染48 h后,进行双萤光素酶活性检测。按照转染试剂说明将EM重组载体转染到T47D细胞中,36 h后加入含200 μg/ml潮霉素B的选择培养液继续培养;将阳性克隆团再次通过极限稀释和扩增培养,最终得到稳定转染EM质粒的T47D细胞株(T47DEM)。
1.2.4 双荧光素酶报告基因活性检测瞬时转染48 h后,弃培养液,用PBS清洗2次后,加入PassiveLysis Buffer裂解缓冲液裂解细胞;按照Dual-Luciferase® Reporter Assay System说明和生物化学发光仪的操作要求检测各个样品中两种报告基因的活性。
1.2.5 裸鼠皮下造瘤及活体成像将106个T47D细胞和T47DEM细胞注射到裸鼠皮下进行造瘤。2周后将D-Luciferin以10 μl/g体重的比例腹腔注射到裸鼠体内,并按照操作说明利用精诺真活体成像系统进行肿瘤活体成像。
1.3 统计学方法相关数据运用SPSS17.0软件进行统计分析,所有数据采用均数±标准差(x±s)表示,组间比较采用t检验,P<0.05表示差异具有统计学意义。
2 结果2.1 MGA启动子片段扩增和TA克隆鉴定扩增的PCR产物进行1%琼脂糖凝胶电泳,结果见图 1。两个泳道在4 000 bp和7 000 bp之间各有一个条带,与预期大小相符(5 640 bp);TA克隆重组载体经双酶切后电泳得到MGA启动子片段(5 640 bp)和pMD20-T载体(2 736 bp)两个条带。以上PCR扩增产物和构建的TA克隆重组载体都经过了测序验证。

|
| M: DM10000 Marker; PCR amplification of MGA promoter used human genome (Lane 1) and TA clone recombinant vector (Lane2) as template; Lane 3: Double digestion of TA clone recombinant vector use BamHⅠand HindⅢ; Lane 4: TA clone recombinant vector 图 1 MGA启动子片段的PCR扩增及TA克隆重组载体的 PCR和双酶切鉴定 Figure 1 PCR amplification of MGA promoter and PCR and restriction enzyme identification of TA clone recombinant vector |
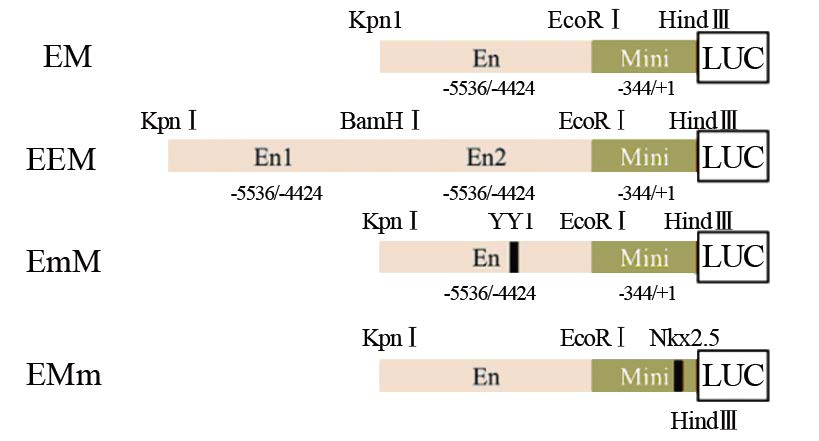
以TA 克隆载体为模板P C R 扩增MG A 启动子的增强子区段(En ) 和最小启动子区段(Mi n i ) ,并在载体骨架pGL4 . 1 4 的基础上构建四个重组载体,见图 2 。每个载体的含义分别是:EM(En+Mini+pGL4.14)、EEM(En+En+Mini+pGL4.14)、EmM(En deletedYY1+Mini+pGL4.14)、EMm(En+Mini deletedNkx2.5+pGL4.14)。构建的载体通过PCR鉴定,见图 3A,扩增出片段与预期吻合。对突变载体进行测序鉴定,结果见图 3B~3C,经过与原序列YY1和Nkx2.5的结合元件都已经被定点删除。上述结果说明四个载体构建成功。
|
| LUC:firefly luciferase reporter 图 2 MGA启动子相关重组载体构建示意图 Figure 2 Sketch of MGA promoter related recombinant vectors |

|
| A: Gel electrophoresis of PCR amplification products of MGA promoter fragments; M: DM2000 DNA Marker; Lane 1: Enhancer fragment En1; Lane 2: Enhancer fragment En2; Lane 3: Enhancer fragment En3; Lane 4: Mini MGA promoter fragment; B: Sequencing identification of mutated recombinant vector (EmM); C: Sequencing identification of mutated recombinant vector (EMm) 图 3 MGA启动子各片段的PCR扩增及突变载体鉴定 Figure 3 PCR amplification of each MGA promoter fragment and identification of mutated recombinant vectors |

|
| Activity ratio=firefly luciferase activity/renilla luciferase activity. All data were shown as mean±standard deviation; **: P<0.01; n≥3 图 4 各种MGA启动子在T47D和HEK293T、HepG2、 MG-63细胞中的活性比较 Figure 4 Reporter gene activity of each MGA promoters in HEK293T,HepG2,MG-63 and T47D cells |
为减小细胞活性和转染效率对实验的影响,将含有萤火虫(Firefly)荧光素酶报告基因的各MGA重组载体和含海肾(Renilla)荧光素酶报告MGA启动子在T47D或其他非乳腺癌细胞中的表达活性,在T47D细胞中,与EM相比,EmM和EMm活性分别下降了76.2%和25.7%,说明YY1和Nkx2.5具有调节MGA启动子活性的功能。而MGA启动子在T47D细胞中的活性与它们在其他非乳腺癌细胞中的活性的比值则表现为MGA启动子的细胞特异性。与EM相比,串联两个增强子的EEM在T47D细胞中的特异性并没有显著变化(P=0.084);而EmM和EMm在T47D细胞中的特异性显著降低,分别下降了61.7%和68.1%(P<0.05),见表 2;说明增强子区段中的YY1和最小启动子区段中的Nkx2.5的结合位点对MGA启动子的乳腺肿瘤细胞特异性都具有调节作用。
 |
Nkx2.5是一类心脏特异的同源异形盒基因,在心脏的形成和发育过程中具有重要作用。然而,有文献指出Nkx2.5在乳腺肿瘤细胞中存在表达,并参与某些基因的转录调控[8]。上述结果表明Nkx2.5的结合元件能调节MGA启动子的乳腺肿瘤细胞特异性。为此,提取T47D细胞的RNA并反转录成cDNA,通过PCR扩增得到了Nkx2.5基因片段。见图 5A泳道3所示,扩增的片段大小与预期吻合;测序分析结果,见图 5B表明扩增的片段为Nkx2.5。说明T47D细胞表达Nkx2.5。

|
| A: Gel electrophoresis of PCR amplification; M: DM500 DNA Marker; Lane 1: PCR amplification of positive control β-actin; 2: Negative control; 3: PCR amplification of Nkx2.5; B: Sequencing identification of Nkx2.5 PCR amplification products 图 5 T47D细胞中Nkx2.5基因的PCR扩增及测序验证 Figure 5 PCR amplification and sequencing identification of Nkx2.5 gene in T47D cells |
上述实验表明MGA启动子在乳腺肿瘤细胞中具有高表达活性和特异性。为了观察其在体应用前景,构建了稳定转染EM重组载体的T47D细胞株T47DEM,并进行皮下造瘤和活体成像观察。在T47DEM细胞注射到裸鼠(BALB/c Nude)皮下造瘤2周后,通过精诺真活体成像系统能明显地观察到萤光素酶的活性;表明构建的细胞株能够实现在体成像,见图 6。

|
| Nude mouse on the left was subcutaneously injected with T47DEM, nude mouse on the right was subcutaneously injected with T47D 图 6 萤火虫荧光素酶活性活体成像图 Figure 6 In vivo imaging of firefly luciferase |
确保具有治疗作用的基因准确导入肿瘤组织并在其中高效表达,是基因靶向治疗过程中遇到的一项难题[11]。在乳腺癌的基因靶向治疗研究中,乳腺肿瘤组织高效特异性的基因启动子是构建基因治疗靶向载体系统的重要组成部分。前期研究报道了一些具有乳腺癌基因靶向治疗应用前景的基因启动子,如上皮细胞特异DF3、Ⅱ型己糖激酶、端粒酶逆转录酶、ErbB2、survivin[7, 12],以及人α-乳清蛋白、牛β-乳球蛋白和Mucin-1等基因的启动子[7, 13, 14]。然而,这些基因启动子除了在乳腺肿瘤细胞中具有高表达活性外,在正常乳腺组织和机体其他组织器官也有相当的表达活性。如Mucin-1在正常乳腺组织中有很高的表达量[15]。在8周龄小鼠的胸腺和脾脏中能检测到survivin蛋白的表达[16]。而MGA具有极高的乳腺癌组织特异性,使得MGA启动子成为针对乳腺癌基因靶向治疗的一个高潜力候选对象。为研究MGA启动子的乳腺肿瘤细胞特异性和高效性,本文构建得到含有萤火虫荧光素酶报告基因的重组载体EM和突变载体EmM、EMm。通过双荧光素酶报告基因系统发现,这三个重组载体中的MGA启动子在T47D细胞中的活性是它们在其他非乳腺癌细胞中的60倍左右,表现出极高的乳腺肿瘤细胞特异性,这个结果与文献报道相符[7]。而与EM相比,EmM和EMm中MGA启动子的乳腺肿瘤细胞特异性出现了显著降低,说明MGA启动子中的这两个转录因子结合位点对其乳腺肿瘤细胞特异性具有调节作用。同时,EmM中的MGA启动子活性与EM相比出现了显著的降低,说明YY1对MGA启动子的转录活性具有促进作用。YY1是一个广泛表达的转录因子,因为细胞微环境或辅因子的不同,YY1对下游基因的表达可能起到促进或抑制作用[17]。
为进一步增加MGA启动子的表达活性,在EM的增强子5’端再插入一个增强子获得EEM载体。然而令人意外的是EEM的MGA启动子活性明显下降。通常增强子串联叠加会进一步促进下游基因的转录表达[18, 19]。但也有研究显示多个增强子可能在串联过程中产生二级结构或空间位阻,从而降低下游基因的转录表达水平[20, 21]。Nkx2.5是一类心脏同源异形盒转录因子,但研究显示Nkx2.5也出现在乳腺肿瘤细胞中,并参与转录调控影响某些基因的表达[8]。提取T47D细胞的RNA反转录得到cDNA,并以此为模板扩增得到了Nkx2.5的基因片段,表明T47D细胞表达Nkx2.5。
为探究MGA启动子的应用前景,筛选得到稳定转染EM的T47D细胞株(T47DEM),注射到裸鼠皮下造瘤,并进行活体成像。在T47DEM成瘤处检测到了明显的萤火虫荧光素酶报告基因活性,因此,通过活体检测MGA启动子活性,可以检测肿瘤的生长情况。这为针对乳腺癌的在体药物筛选提供了一个很好的平台。
综上所述,本文构建了四个MGA启动子相关的重组载体,研究了MGA启动子活性和特异性的调控元件,为研究乳腺癌基因靶向治疗的高效特异性载体系统提供实验线索和理论支持;构建的细胞株(T47DEM)可用于治疗乳腺癌药物的在体筛选。
| [1] | Yeo B, Turner NC, Jones A. An update on the medical management of breast cancer[J]. BMJ, 2014, 348: g3608. |
| [2] | Jia LT, Chen SY, Yang AG. Cancer gene therapy targeting cellular apoptosis machinery[J]. Cancer Treat Rev, 2012, 38(7): 868-76. |
| [3] | Ortiz R, Melguizo C, Prados J, et al. New gene therapy strategies for cancer treatment: a review of recent patents[J]. Recent Pat Anticancer Drug Discov, 2012, 7(3): 297-312. |
| [4] | Ghersevich S, Ceballos MP. Mammaglobin A: review and clinical utility[J]. Adv Clin Chem, 2014, 64: 241-68. |
| [5] | Al Joudi FS. Human mammaglobin in breast cancer: a brief review of its clinical utility[J]. Indian J Med Res, 2014, 139(5): 675-85. |
| [6] | Galvis-Jimenez JM, Curtidor H, Patarroyo MA, et al. Mammaglobin peptide as a novel biomarker for breast cancer detection[J]. Cancer Biol Ther, 2013, 14(4): 327-32. |
| [7] | Shi CX, Long MA, Liu L, et al. The human SCGB2A2 (mammaglobin-1) promoter/enhancer in a helper-dependent adenovirus vector directs high levels of transgene expression in mammary carcinoma cells but not in normal nonmammary cells[J]. Mol Ther, 2004, 10(4): 758-67. |
| [8] | Dentice M, Luongo C, Elefante A, et al. Transcription factor Nkx-2.5 induces sodium/iodide symporter gene expression and participates in retinoic acid- and lactation-induced transcription in mammary cells[J]. Mol Cell Biol, 2004, 24(18): 7863-77. |
| [9] | Wan M, Huang W, Kute TE, et al. Yin Yang 1 plays an essential role in breast cancer and negatively regulates p27[J]. Am J Pathol, 2012, 180(5): 2120-33. |
| [10] | Lee MH, Lahusen T, Wang RH, et al. Yin Yang 1 positively regulates BRCA1 and inhibits mammary cancer formation[J]. Oncogene, 2012, 31(1): 116-27. |
| [11] | Lu Q, Ye X, Liu F, et al. Homologous recombination-based adenovirus vector system for tumor cell-specific gene delivery[J]. Cancer Biol Ther, 2013, 14(8): 728-35. |
| [12] | Fang L, Shanqu L, Ping G, et al. Gene therapy with RNAi targeting UHRF1 driven by tumor-specific promoter inhibits tumor growth and enhances the sensitivity of chemotherapeutic drug in breast cancer in vitro and in vivo[J]. Cancer Chemother Pharmacol, 2012, 69(4): 1079-87. |
| [13] | Sinn BV, von Minckwitz G, Denkert C, et al. Evaluation of Mucin-1 protein and mRNA expression as prognostic and predictive markers after neoadjuvant chemotherapy for breast cancer[J]. Ann Oncol, 2013, 24(9): 2316-24. |
| [14] | Huyn ST, Burton JB, Sato M, et al. A potent, imaging adenoviral vector driven by the cancer-selective mucin-1 promoter that targets breast cancer metastasis[J]. Clin Cancer Res, 2009, 15(9): 3126-34. |
| [15] | Miksicek RJ, Myal Y, Watson PH, et al. Identification of a novel breast- and salivary gland-specific, mucin-like gene strongly expressed in normal and tumor human mammary epithelium[J]. Cancer Res, 2002, 62(10): 2736-40. |
| [16] | Bao R, Connolly DC, Murphy M, et al. Activation of cancerspecific gene expression by the survivin promoter[J]. J Natl Cancer Inst, 2002, 94(7): 522-8. |
| [17] | Nicholson S, Whitehouse H, Naidoo K, et al. Yin Yang 1 in human cancer[J]. Crit Rev Oncog, 2011, 16(3-4): 245-60. |
| [18] | Hamamoto H, Hasegawa K, Nakaune R, et al. Tandem repeat of a transcriptional enhancer upstream of the sterol 14alphademethylase gene (CYP51) in Penicillium digitatum[J]. Appl Environ Microbiol, 2000, 66(8): 3421-6. |
| [19] | Park BJ, Brown CK, Hu Y, et al. Augmentation of melanomaspecific gene expression using a tandem melanocyte-specific enhancer results in increased cytotoxicity of the purine nucleoside phosphorylase gene in melanoma[J]. Hum Gene Ther, 1999, 10(6): 889-98. |
| [20] | Latham JP, Searle PF, Mautner V, et al. Prostate-specific antigen promoter/enhancer driven gene therapy for prostate cancer: construction and testing of a tissue-specific adenovirus vector[J]. Cancer Res, 2000, 60(2): 334-41. |
| [21] | Siders WM, Halloran PJ, Fenton RG. Transcriptional targeting of recombinant adenoviruses to human and murine melanoma cells [J]. Cancer Res, 1996, 56(24): 5638-46. |
 2015, Vol. 42
2015, Vol. 42


