文章信息
- 高兴春,冯浩,史宏恩,米亚静,姜凤良.
- GAO Xingchun, FENG Hao, SHI Hongen, MI Yajing, JIANG Fengliang.
- SRC抑制胶质母细胞瘤的增殖、迁移、侵袭和干性维持的分子机制
- SRC Regulates Glioma Proliferation, Migration, Invasion and Cancer Stem-like Cell Self-renewal
- 肿瘤防治研究, 2015, 42(12): 1171-1176
- Cancer Research on Prevention and Treatment, 2015, 42(12): 1171-1176
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.12.001
-
文章历史
- 收稿日期: 2015-01-05
- 修回日期: 2015-07-07
胶质母细胞瘤(glioblastoma multiforme,GBM)是临床上最常见的原发性脑肿瘤,为人类恶性程度最高的肿瘤之一,中位生存期仅为12月左右[1],属于WHO Ⅳ级星形胶质细胞瘤。GBM在体内多呈浸润性生长,肿瘤与正常脑组织无明显界限,手术往往不易将肿瘤组织全部切除而导致术后复发,而且GBM对放、化疗还具有较强的抵抗性,常规的治疗手段不易达到理想的治疗效果。因此,从分子医学角度探索调控胶质瘤发生发展中的关键通路和核心分子将为临床治疗提供新的思路。
肿瘤干细胞(cancer stem cell,CSC)理论认为,胶质母细胞瘤的生长及致瘤性受到其中一部分胶质瘤干细胞(glioma stem cells,GSC)的控制[2, 3]。GSC不仅是GBM发生和生长的重要动力,也是GBM对放化疗具有抵抗性的内在原因[4],具有重要的研究价值。因此,探索调节GSC干性维持的内在分子机制,不仅可加深人们对GSC生物学特性的理解,也有助于探寻针对GSC治疗的特异性靶点,最终为消除GSC抑制GBM的发生发展提供实验和理论依据。
SRC蛋白是一类非受体蛋白酪氨酸激酶,广泛存在于各种组织和细胞中,参与调控细胞的代谢、生长和分化过程。其主要有两种存在形式:病毒癌基因编码蛋白v-SRC和细胞癌基因编码蛋白c-SRC。多项研究证实,c-SRC蛋白表达量的变化和活性异常是很多肿瘤发生发展的重要原因之一[5, 6]。但c-SRC基因及其产物在胶质母细胞瘤发生发展中的作用目前尚未有系统的研究。因此,本研究拟通过shRNA抑制c-SRC基因在胶质母细胞瘤细胞系U87MG中的表达后,在体外实验中系统观察SRC蛋白对胶质瘤母细胞的增殖、迁移、侵袭及对胶质瘤干细胞干性的影响。
1 材料与方法1.1 细胞及试剂人胶质母细胞瘤细胞系U87MG购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所,来源于ATCC;DMEM培养液和胎牛血清购自美国Hyclone公司;青霉素、链霉素和G418购自西安辉瑞生物有限公司;TRIzol试剂和PCR引物购自美国Invitrogen公司;反转录试剂盒购自日本TaKaRa公司;FuGENE HD Transfection Reagent购自德国Roche公司;SRC的shRNA载体由上海吉玛制药技术有限公司合成,SRC-shRNA-1#:AAACTCCCCTTGCTCATGTACTT,SRC-shRNA-2#:CATCCTCAGGAACCAACAATTC;鼠抗人α-tubulin单克隆抗体和兔抗人SRC抗体均购自美国Santa Cruz公司;兔抗人SOX2单克隆抗体购自美国Abcam公司; WST-1和BCA蛋白浓度测定试剂购自上海前尘生物科技有限公司;异硫氰酸荧光素(fluoresceinisothiocyanate,FITC)标记的山羊抗兔IgG、蛋白质印迹及蛋白质提取和冰冻切片相关试剂购自碧云天生物技术研究所。bFGF和EGF购自美国Sigma公司,B27购自美国Life Technologies公司;Transwell小室购自美国Cell Biolabs公司。
1.2 方法1.2 1 细胞培养为贴壁生长,用含10%胎牛血清的DMEM高糖完全培养液培养,内含100 u/ml青霉素和100 μg/ml链霉素。当细胞融合率为70%~80%时,用0.25%胰酶消化并传代,置于37℃、5%CO2的细胞培养箱中培养。U87MG肿瘤干细胞的培养:1×105个每毫升细胞种植于干细胞培养液中(DMEM/F12无血清培养,加入20 ng/ml EGF,20 ng/ml bFGF,20 μl/ml B27,100u/ml青霉素和100 μg/ml链霉素),每2~3 d半量换液,7~8 d可以形成干细胞球。
1.2 2 稳定细胞株的筛选Transfection Reagent试剂盒说明书,将SRC shRNA转染U87MG细胞系,转染后将细胞培养在含有400μg/ml G418的培养液中,连续培养30 d后获得稳定细胞株。
1.2 3 WST-1测定细胞的增殖质瘤细胞接种于96孔板,每孔5 000个细胞,每隔24 h加入WST-1,在450 nm处读数,根据吸光度值分析细胞增殖的能力。
1.2 4 实时荧光定量PCR和蛋白质印迹法检测SRC shRNA对SRC表达的影响SRC shRNA对SRC表达的影响 收集转染72 h后的U87MG细胞,采用TRIzol试剂提取细胞总RNA,取2 μg总RNA,反转录成cDNA。以1 μlcDNA为模板,用Touch down程序进行PCR反应,检测细胞中内参GAPDH和目的SRC的转录水平。GAPDH上游引物序列为5’-GAAGGTGAAGGTCGGAGTC-3’,下游引物序列为5’-GAAGATGGTGATGGGATTTC-3’;SRC上游引物序列为5’-CAGTGTCTGACTTCGACAACGC-3’,下游引物序列为5’-CCATCGGCGTGTTTGGAGTA-3’。PCR反应条件:94℃预变性30 s;94℃变性30 s,60℃退火30 s,40个循环(每个循环依次降低1 ℃),72℃延伸30 s。以相对定量2-ΔΔCt [ΔΔCt=(待测组目的基因平均Ct值-待测组内参照基因平均Ct值)-(对照组目的基因平均Ct值-对照组内参照基因平均Ct值)]值表示各组细胞中SRC的相对表达水平。
提取转染72 h后细胞总蛋白,测定蛋白浓度后,以相同浓度上样,进行10% SDS-PAGE分离蛋白后,湿转至PVDF膜,5%脱脂奶粉封闭2 h,分别加入一抗(SRC和tubulin,稀释比例为1:500;1:2 000),4℃过夜;洗膜,加入二抗(稀释比例为1:5 000),37℃反应1 h;洗膜,按照化学发光试剂盒说明进行显影。以SRC条带灰度值反映蛋白相对表达水平。
1.2 5 划痕愈合实验检测SRC对U87MG细胞的横向迁移能力影响迁移能力影响 接种1.2.2中筛选到的稳定细胞株于6孔板中,待细胞融合度为90%~100%时用200 μl枪头划痕,PBS洗2次后换新鲜无血清培养液,于倒置显微镜下摄片,并沿划痕边缘等间距取6处测量划痕宽度,取平均值,记为0 h划痕宽度。然后分别在12和24 h拍照,在相同观察点测量划痕宽度。划痕愈合率(%)=(0 h划痕宽度-72 h划痕宽度)/0 h划痕宽度×100%,以此反映SRC对U87MG细胞横向迁移能力的影响。
1.2 6 Transwell小室法检测SRC对U87MG细胞的纵向迁移能力和侵袭能力的影响纵向迁移能力和侵袭能力的影响 将1.2.2筛选到的稳定细胞株经胰酶消化,离心后分别用各组共培养体系中的培养液重悬,计数每孔50 000 个细胞,与400 μl共培养体系中的培养液混合一起,加入Transwell上室;下室加入600 μl含10% FBS的共培养体系中培养液。继续培养10 h后棉球擦去上室表面的残留细胞,DAPI染色观察穿过滤网的细胞数目,用以代表细胞的细胞纵向迁移能力的变化;侵袭实验是用Matrigel包被滤网,上室加入无血清培养液,下室加入正常含血清的培养液,孵育48 h后棉球擦去上室表面的残留细胞,DAPI染色观察穿过滤网的细胞数目,用以代表细胞的侵袭能力。
1.2 7 测量胶质瘤干细胞球的直径检测对干细胞增殖的影响增殖的影响 将1.2.2中筛选到的细胞株消化为单细胞悬液,采用锥虫蓝染色计活细胞数,以1×105个每毫升的浓度种植于6孔板中,每2 d加入培养液0.5 ml培养,14 d后拍照观察干细胞球的直径;以干细胞球的直径代表干细胞的增殖能力。
1.2 8 细胞免疫荧光法检测胶质瘤干细胞中SOX2的水平的水平 将1.2.2中筛选到的细胞株在干细胞培养液中培养14 d后,利用4%多聚甲醛固定15 min,蔗糖梯度脱水至30%蔗糖PB溶液,包埋后冰冻切片,切片用PBS漂洗2次,用20%驴血清37℃封闭1 min,加入SOX2一抗(稀释比例为1︰200),4℃过夜;PBS漂洗2次,加入FITC标记的山羊抗兔IgG(稀释比例为1︰800),37℃避光反应1 h;然后加入4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI),室温避光反应15 min,对细胞核进行染色;PBS漂洗2次后,荧光显微镜下观察SOX2的表达变化。
1.2 9 生物信息学分析的生信分析采用OncomineOncomine(https://www.oncomine.org/)数据库[7],通过直接查询获得。
1.3 统计学方法各项实验均重复3次。应用SPSS 20.0软件对实验的结果数据进行统计学分析。计量数据以(x±s)表示,多组数据间的比较采用单因素方差分析,组间两两比较采用t检验。P<0.05为差异有统计学意义。
2 结果2.1 SRC在胶质母细胞瘤中高表达通过查询Oncomine数据库发现,SRC在81例胶质母细胞瘤标本中的平均表达量要高于正常对照组的脑组织(P=0.002),大约是正常组织的1.6倍,提示SRC在胶质瘤母细胞的发生发展中发挥重要作用,见图 1。

|
| 图 1 SRC在胶质母细胞瘤中表达上升( 数据来源于 Oncomine数据库) Figure 1 SRC expression was increased in glioblastoma multiforme(GBM) (Data and statistics were obtained from the Oncomine database) |
为了研究SRC对胶质瘤母细胞发生发展的影响,利用shRNA抑制SRC的表达来研究其功能,SRC shRNA对SRC表达影响利用Western blot和定量PCR来检测。结果发现SRC shRNA-1#和SRCshRNA-2#都可以很好地抑制内源SRC的表达,并且SRC shRNA-1#的效果要优于SRC shRNA-2#,见图 2。所以本研究主要用SRC shRNA-1#来进行功能研究。

|
| 1: control shRNA; 2: SRC-shRNA-1#; 3: SRC-shRNA-2#; A: Western blot analysis of endogenous SRC expression level in U87MG cells treated with SRC shRNAs; B: qRT-PCR analysis of endogenous SRC expression level in U87 MG cells treated with SRC shRNAs 图 2 利用Western blot和定量PCR检测SRC shRNA对SRC 表达的影响 Figure 2 Western blot and quantitative RT-PCR analysis of SRC expression level with SRC shRNAs treatment |
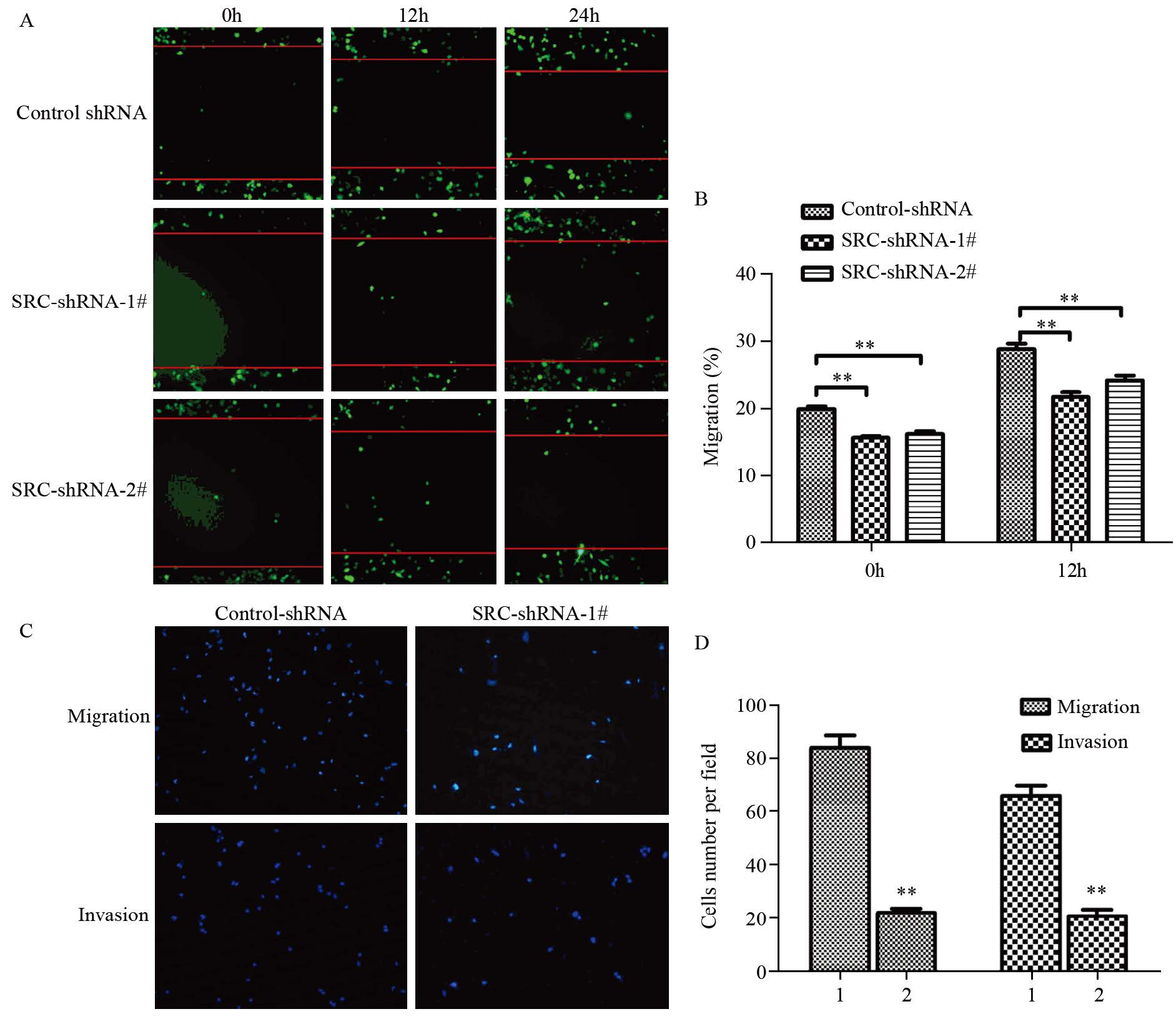
用划痕实验对SRC shRNA胶质瘤细胞系的迁移能力进行分析,发现下调SRC可以抑制胶质瘤细胞的迁移(图 3A~3B)。对照组划痕愈合率在12和24 h分别为19.9%和28.8%,而SRC shRNA-1#为15.7%和21.7%,SRC shRNA-1#为16.2%和24.2%。利用Transwell小室对SRC shRNA的迁移和侵袭能力分析发现,下调SRC的表达可以抑制胶质母细胞瘤细胞的迁移和侵袭,见图 3C~3D。
|
| 1: control shRNA; 2: SRC-shRNA-#; A-B: wound healing assay showed different cell migration in control-shRNA-U87MG,SRC shRNA-1#- U87MG and SRC shRNA-2#-U87MG groups; A: representative images were taken at different time points; B: quantification of cell motility by measuring the wound width. The amount of motility was presented as a percent of migration at the zero time point; C-D: Transwell assay of U87MG cells transfected with control-shRNA and SRC shRNA-1# groups; C: representative fields of invasive cells and migratory cells on the membrane; D: quantitative analysis of the invasive and migratory cells from three independent experiments. Error bars represent SEM; **: P<0.01 图 3 下调SRC表达抑制胶质瘤母细胞的迁移和侵袭 Figure 3 shRNA-mediated knockdown of SRC inhibited glioma cells migration and invasion in vitro |
为了观察SRC对胶质母细胞瘤增殖的影响,利用WST-1检测了下调SRC后细胞的增殖能力。结果显示,下调SRC后可以显著抑制胶质母细胞瘤细胞系U87MG的增殖,见图 4A。通过干细胞培养液获得U87MG的肿瘤干细胞后,发现稳定表达SRC shRNA的胶质瘤细胞系所形成的干细胞球的直径要显著小于对照组,对照组中细胞球的直径是156 μm,而SRC shRNA-1# U87MG是63.1 μm(P <0.001),见图 4B~4C,说明SRC对于胶质瘤干细胞的增殖起重要的促进作用。

|
| 1: control shRNA; 2: SRC shRNA-1#; A: growth curves after cell transfection were assessed by WST-1 assay; B: the morphology of tumor spheres formed by the cancer stem cells from control-shRNA-U87MG and SRC shRNA-1#-U87MG groups; C: glioma neurosphere diameters was decreased in SRC-shRNAs U87MG cancer stem cells. Error bars represent SEM; *: P<0.05; **: P<0.01; ***: P <0.001 图 4 下调SRC的表达抑制胶质瘤母细胞和胶质瘤干细胞的增殖 Figure 4 shRNA-mediated knockdown of SRC inhibited proliferation of glioma cells and glioma stem-like cells |
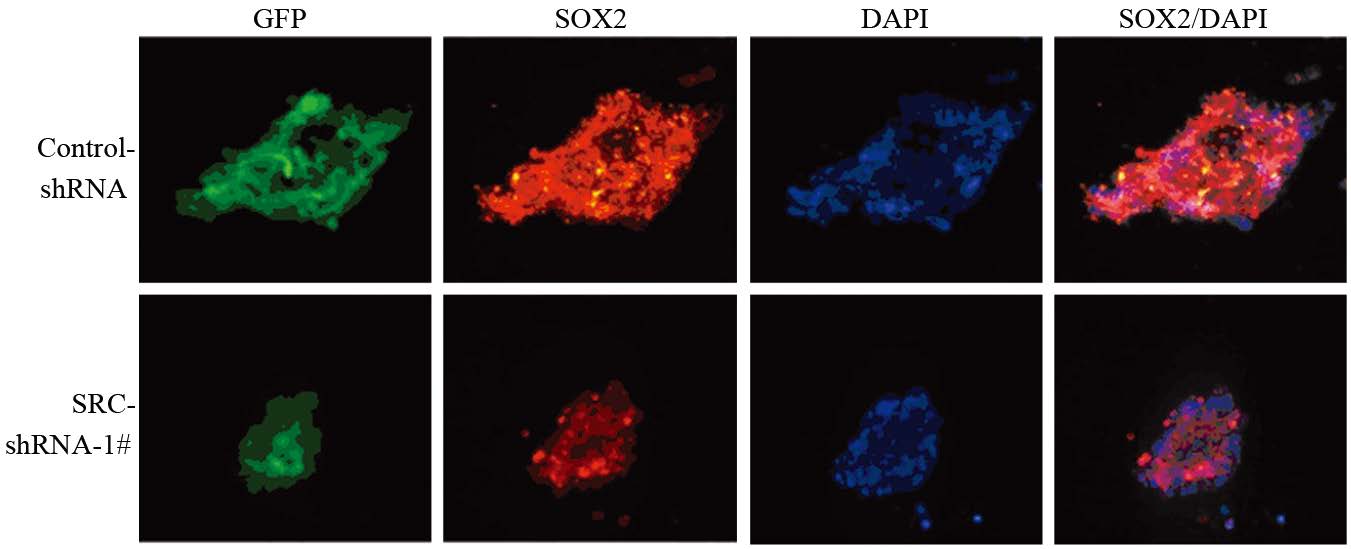
已知转录因子SOX2可以维持干细胞的全能性,参与肿瘤干细胞的自我更新,在多种肿瘤的发生发展中发挥重要作用,是肿瘤干细胞的标记基因。通过细胞免疫荧光法检测,结果发现下调SRC后可以显著抑制SOX2的表达,见图 5。提示SRC可能通过调节SOX2的表达影响胶质瘤干细胞的干性维持。
|
| 图 5 细胞免疫荧光检测SOX2在胶质瘤 干细胞中的表达情况 Figure 5 SOX2 expression in glioma stem cells detected by immunofluorescence |
胶质母细胞瘤是人类恶性程度最高的肿瘤之一,目前传统的治疗手段如手术、放化疗都不能有效根除,给患者和社会带来了沉重的负担,探寻治疗胶质瘤的新方法和新靶标对于治疗胶质瘤具有重要意义。已经有多篇文章报道SRC作为一个原癌基因在许多肿瘤发生发展中发挥重要作用[8, 9, 10]。而且SRC在胶质瘤发生发展中的作用也有一些文献报道[11],但尚未系统的阐明其作用,尤其是在胶质瘤标本中的表达情况鲜有报道。本课题组利用shRNA技术体外筛选获得稳定的下调SRC胶质瘤细胞株,通过观察SRC下调后对胶质母细胞瘤的增殖、迁移和侵袭的影响,证实下调SRC的表达可以抑制胶质母细胞瘤的增殖、迁移和侵袭能力,为探讨SRC在胶质母细胞瘤中的作用机制及其作为潜在治疗靶标的可能性具有重要意义。
近年来关于胶质瘤干细胞的研究已经成为一个新的国际研究热点,大量研究认为胶质瘤干细胞的存在对胶质母细胞瘤的形成及致瘤性至关重要[12]。但是对于GSC的来源还有很大争议,一种观点认为GSC很可能起源于正常神经干细胞(neural stemcells,NSC),因为其保留了NSCs的一些特点:如多分化潜能、自我更新能力及在干细胞培养液中呈现神经球样生长等[13]。另外一些研究人员则认为,GSC细胞是由不同类型的胶质瘤细胞在一些特殊情况下去分化而转变形成的[14]。虽然研究者对GSC的图 5 细胞免疫荧光检测SOX2在胶质瘤干细胞中的表达情况
Figure 5 SOX2 expression in glioma stemcells detected by immunofluorescence来源存在争议,但对其在肿瘤发生中的作用机制的观点仍保持一致。多项研究证实GSC具有强大的致瘤能力,极少量的GSCs即可在体内形成肿瘤[15],并且GSC对常规的放化疗具有较强的抵抗性,很有可能是GBM复发的内在原因[3, 16]。同时GSC还具有极强的浸润性[17],是GBM向正常组织侵袭的关键因素。GSCs还可以向内皮细胞分化[18],从而直接参与GBM中的血管发生,所以有人提出胶质瘤干细胞是胶质瘤治疗的新靶点。目前GSC的建立主要来自两种途径,一是在干细胞培养液(含有生长因子EGF和bFGF的无血清培养液)中培养,二是通过表面标志物分选(如CD133、CD15等)。本研究就是利用干性培养液获得GSC进行研究的。
关于SRC在胶质瘤中的功能,2014年Han等[19]发现利用抑制剂如dasatinib抑制SRC的活性后可以抑制GSCs的迁移,但不影响增殖或自我更新的能力。同年Gangoso等[20]研究发现c-SRC可以调控ID1的表达,ID1又可以影响干性基因SOX2的表达,所以c-SRC最终通过影响SOX2的表达调控GSC的自我更新。Han和Gangoso的研究差别在于他们所用的GSC的细胞系不同,干细胞培养方法中bFGF和EGF添加的量不同。而本研究发现,利用shRNA下调SRC的表达后,可以抑制胶质母细胞瘤细胞系U87MG肿瘤干细胞的增殖,同时可以抑制干性基因SOX2的表达,证明SRC确实可以调控GSC的干性维持,其分子机制可能是通过影响干性基因SOX2的表达,需要指出的是本文对SRC作用机制的研究是基于体外细胞培养的结果,将来更进一步的研究需要补充体内实验。
总之,本研究通过体外实验发现下调SRC的表达可以抑制胶质母细胞瘤的增殖、迁移、侵袭以及GSC的自我更新能力,SRC对GSC干性维持的作用可能是通过影响SOX2的表达实现的。
| [1] | Komotar RJ, Otten ML, Moise G, et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma-a critical review[J]. Clin Med Oncol, 2008, 2: 421-2. |
| [2] | Cho DY, Lin SZ, Yang WK, et al. Targeting cancer stem cells for treatment of glioblastoma multiforme[J]. Cell transplant, 2013, 22(4): 731-9. |
| [3] | Mao XG, Zhang X, Zhen HN. Progress on potential strategies to target brain tumor stem cells[J]. Cell Mol Neurobiol, 2009, 29(2): 141-55. |
| [4] | Zhang X, Zhang W, Mao XG, et al. Targeting role of glioma stem cells for glioblastoma multiforme[J]. Curr Med Chem, 2013, 20(15): 1974-84. |
| [5] | Oneyama C, Yoshikawa Y, Ninomiya Y, et al. Fer tyrosine kinase oligomer mediates and amplifies src-induced tumor progression[J]. Oncogene, 2015, 36(8): 6507-13. |
| [6] | Cui A, Hua H, Shao T, et al. Aflatoxin B1 induces src phosphorylation and stimulates lung cancer cell migration[J]. Tumour Biol, 2015, 36(8): 6507-13. |
| [7] | Rhodes DR, Yu J, Shanker K, et al. Oncomine: A cancer microarray database and integrated data-mining platform[J]. Neoplasia, 2004, 6(1): 1-6. |
| [8] | Liu YN, Yin J, Barrett B, et al. Loss of androgen regulated mir-1 activates src and promotes prostate cancer bone metastasis[J]. Mol Cell Biol, 2015, 35(11): 1940-51. |
| [9] | Sirvent A, Urbach S, Roche S. Contribution of phosphoproteomics in understanding src signalling in normal and tumour cells[J]. Proteomics, 2015, 15(2-3): 232-44. |
| [10] | Ma XM, Shen ZH, Liu ZY, et al. Heparanase promotes human gastric cancer cells migration and invasion by increasing src and p38 phosphorylation expression[J]. Int J Clinical Exp Pathol, 2014, 7(9): 5609-21. |
| [11] | Tang Z, Araysi LM, Fathallah-Shaykh HM. C-SRC and neural wiskott-aldrich syndrome protein (n-wasp) promote low oxygeninduced accelerated brain invasion by gliomas[J]. PLoS One, 2013, 8(9): e75436. |
| [12] | Venere M, Fine HA, Dirks PB, et al. Cancer stem cells in gliomas: Identifying and understanding the apex cell in cancer’s hierarchy[J]. Glia, 2011, 59(8): 1148-54. |
| [13] | Chesler DA, Berger MS, Quinones-Hinojosa A. The potential origin of glioblastoma initiating cells[J]. Front Biosci (Schol Ed), 2012, 4: 190-205. |
| [14] | Germano I, Swiss V, Casaccia P. Primary brain tumors, neural stem cell, and brain tumor cancer cells: Where is the link?[J]. Neuropharmacology, 2010, 58(6): 903-10. |
| [15] | Singh SK, Hawkins C, Clarke ID, et al. Identification of human brain tumour initiating cells[J]. Nature, 2004, 432(7015): 396-401. |
| [16] | Bao S, Wu Q, McLendon RE, et al. Glioma stem cells promote radioresistance by preferential activation of the DNA damage response[J]. Nature, 2006, 444(7120): 756-60. |
| [17] | Cheng L, Wu Q, Guryanova OA, et al. Elevated invasive potential of glioblastoma stem cells[J]. Biochem Biophys Res Commun, 2011, 406(4): 643-8. |
| [18] | Wang R, Chadalavada K, Wilshire J, et al. Glioblastoma stem-like cells give rise to tumour endothelium[J]. Nature, 2010, 468(7325): 829-33. |
| [19] | Han X, Zhang W, Yang X, et al. The role of src family kinases in growth and migration of glioma stem cells[J]. Int J Oncol, 2014, 45(1): 302-10. |
| [20] | Gangoso E, Thirant C, Chneiweiss H, et al. A cell-penetrating peptide based on the interaction between c-src and connexin43 reverses glioma stem cell phenotype[J]. Cell Death Dis, 2014, 5: e1023. |
 2015, Vol. 42
2015, Vol. 42


