文章信息
- 王琳,黄建坤.
- WANG Lin, HUANG Jiankun.
- TFF3作为肿瘤生物标志物的研究
- Review on Researches of TFF3 as Tumor Biomarker
- 肿瘤防治研究, 2015, 42(11): 1156-1160
- Cancer Research on Prevention and Treatment, 2015, 42(11): 1156-1160
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.11.022
-
文章历史
- 收稿日期: 2014-12-08
- 修回日期: 2015-01-08
2. 361004 厦门,厦门大学附属中山医院医学中心实验室
2. Medical Research Laboratory Center, Zhongshan Hospital Affiliated to Xiamen University, Xiamen 361004, China
恶性肿瘤严重威胁人类的健康与生命,相对其他疾病,其临床治疗有效率目前仍偏低[1, 2]。基于二代高通量测序技术的肿瘤基因组学的快速发展,更加全面揭示了肿瘤多成因及高度异质性的特点[3, 4],肿瘤分子诊断与个体化治疗、靶向治疗成为提高肿瘤早期诊断率与治疗效果的有效手段,也是肿瘤临床治疗不断发展的方向与目标,而实现这一目标最终还需依赖于寻找到特异性的肿瘤生物标志物。三叶因子3(trefoil factor 3, TFF3)主要由胃肠道分泌的小分子多肽,与胃肠道及其他肿瘤的发生发展密切相关。临床样本研究显示,TFF3作为肿瘤生物标志物,对胃癌的诊断具有较高的敏感度与特异性[5, 6, 7],也可应用于胃肠道肿瘤化疗药效评价、患者预后评估等[8, 9],同时它作为如甲状腺癌术前诊断的标志物也具有重要临床价值[10]。
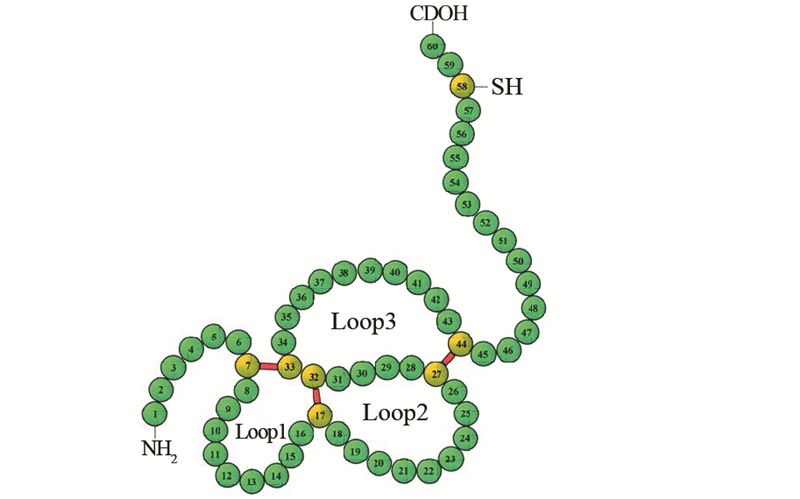
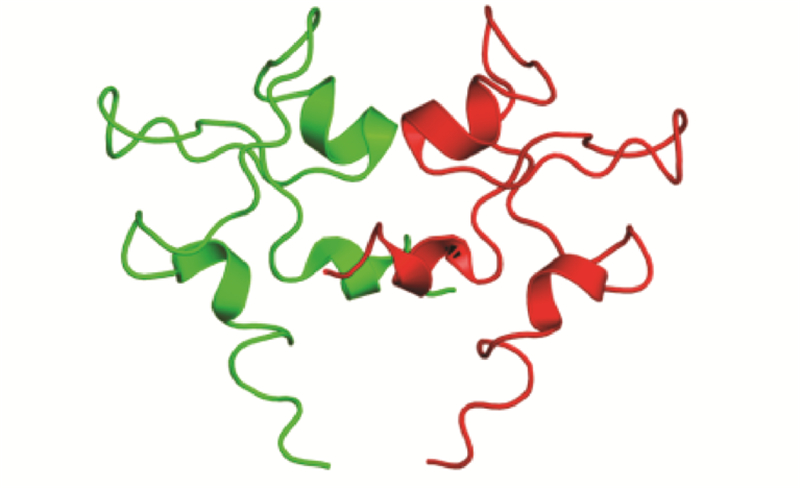
1 TFF3分子结构与功能TFF3是主要由胃肠道细胞分泌的三叶因子(trefoil factor family, TFF)家族成员之一,该家族在哺乳动物体内还有其他2个成员:三叶因子1(trefoil factor 1, TFF1)和三叶因子2(trefoil factor 2, TFF2)。这一家族均为富含半胱氨酸的小分子多肽,二级结构上,由38~39个氨基酸通过6个高度保守的半胱氨酸残基形成的3个分子内二硫键折叠形成“三叶状”结构(trefoil domain),也叫P结构域(P domain),见图 1[11]。这种“三叶状”结构非常稳定,使三叶因子具有很强的抗酸、抗蛋白酶水解及耐热等特性,能在胃肠道复杂的生理环境中保持生物活性,起到 黏膜保护和损伤修复的作用。
人TFF3的肽链由59个氨基酸组成,分子量约6.7 kDa,二级结构含有一个P结构域,以二聚体的形式发挥生理功能,见图 2[12]。TFF3蛋白表达与分泌具有组织细胞特异性,主要由小肠和结肠的杯状细胞特异性表达和分泌[13],在其他正常组织如甲状腺、子宫内膜、乳腺等也有表达。当组织发生炎性反应及恶变时,TFF3表达的组织特异性及表达水平均发生改变,在胃肠道肿瘤组织中表达水平升高[5],而在甲状腺癌组织中表达水平下降[10],表明TFF3可能参与肿瘤的发生与发展,这引发国内外学者对这一小分子多肽的功能及作用机制研究的兴趣。
2 TFF3肿瘤生物标志物研究研究表明TFF3在肿瘤发生发展进程中具有重要作用,作为潜在的生物标志物,在肿瘤诊断与治疗中应具有较大的临床应用价值[14]。最近以TFF3作为肿瘤新型标志物的研究成了三叶因子多肽家族研究领域的热点,主要围绕作为胃肠道肿瘤的标志物,也包括作为其他肿瘤如子宫内膜癌、甲状腺癌等诊断的标志物研究。
2.1 TFF3作为胃癌诊断的血清标志物胃癌是引起恶性肿瘤死亡的最主要肿瘤之一,其治疗效果及患者生存率很大程度取决于肿瘤是否处于早期。内镜检查是发现早期胃癌的最佳途径,但该方法具侵入性,不适用于大量人群的筛查,且内镜确诊胃癌的患者半数以上已属中晚期[6]。血清学生物标志物诊断可提高胃癌患者的早期诊断率,从而提高治疗效果且延长生存期。血清胃蛋白酶原(pepsinogen, PG)虽已应用于胃癌的检测,但其敏感度有限,远未达到大规模筛查的要求。因此探索和发现新的适用于胃癌筛查与早期诊断的理想标志物尤为迫切。TFF3因其独特的分子结构与特性及组织表达的特异性,促使众多学者将其作为胃癌诊断的血清标志物进行研究。
2.1.1 胃癌患者血清TFFs蛋白水平与稳定性日本学者Kaise等[5]最早开展了血清TFFs水平与胃癌诊断关系的研究,他们采用ELISA法检测192例胃癌组及1254例健康对照组血清中TFF1、TFF2、TFF3、HP抗体(幽门螺杆菌抗体)与PG水平,以评价这种非内镜方式检测胃癌的可行性与价值。Aikou等[6]在183例胃癌组、98例HP阳性健康对照组及172例HP阴性健康对照组中分析同样的几个指标。国内学者Huang等[7]也分析了72例胃癌组、61例慢性萎缩性胃炎、27例慢性非萎缩性胃炎与37例健康对照组血清TFFs水平。三组研究获得不同血清样本中TFFs水平的数据,经受试者工作特征曲线(receiver operating characteristic curve)分析表明,胃癌患者血清中TFFs三个成员较对照组均升高,但TFF1与TFF2水平与HP感染有关,而TFF3水平不受HP感染及胃炎等因素的影响,在血清中的水平保持比较稳定。针对HP感染对血清TFFs水平的影响,Kaise等[15]继续开展一项包含1 260例临床样本的研究,比较 HP感染与治疗清除后血清TFFs水平的变化。结果显示,血清TFF1和TFF2水平在HP阳性组显著高于阴性组,而TFF3水平在两组间差异无统计学意义。且还发现178例胃溃疡患者经治疗清除HP两月后,其血清TFF1和TFF2水平显著下降,而TFF3水平基本没有变化,甚至在HP清除5年后,TFF3水平仍保持比较稳定。因此相对于TFFs其他两个成员,TFF3作为胃癌血清标志物更具稳定性。
2.1.2 TFF3对胃癌诊断的敏感度、特异性及特点Kaise等[5]以TFF3敏感度为30 pg/ml对胃癌血清样本进行诊断分析,并比较TFF3、PG及二者联合对胃癌诊断的敏感度与特异性,结果显示,TFF3的敏感度与特异性分别为66.1%和91.7%,PG的敏感度与特异性分别为67.2%和81.7%,二者联合的敏感度与特异性分别为80.2%和80.1%。Aikou等[6]也以TFF3敏感度为30 pg/ml进行同样实验,结果为:TFF3的敏感度与特异性分别为80.9%和81.0%,PG的敏感度与特异性分别为44.8%和87.4%,二者联合的敏感度与特异性分别为81.18%和91.75%。Huang[7]设TFF3敏感度为52 pg/ml,与PG进行比较对胃癌诊断的敏感度与特异性,实验数据显示,TFF3的敏感度与特异性分别为66.67%和83.78%,PG的敏感度与特异性分别为37.5%和81.08%,二者联合可将胃癌诊断的敏感度提高至75%。三组研究综合表明TFF3对胃癌诊断的敏感度优于PG,TFF3与PG联合可明显提高对胃癌诊断的敏感度和特异性,二者联合检测结果优于任一单个标志物,是诊断胃癌的理想标志物。进一步分析发现,TFF3对胃癌诊断的敏感度与肿瘤分期及病理分型有关。TFF3对晚期胃癌诊断的敏感度高于早期胃癌,这可能与TFF3在晚期胃癌表达水平更高有关。而不同病理分型对TFF3敏感度的影响存在两种相反结果,Kaise等[5]实验显示TFF3对高分化肠型胃癌诊断敏感度(67.0%)高于对低分化弥漫型胃癌诊断的敏感度(63.5%);而Huang等[7]的实验结果为TFF3对高分化肠型胃癌诊断的敏感度(43.87%)低于对低分化弥漫型胃癌诊断敏感度(54.72%),这可能与单中心实验在临床样本选择存在偏向性及样本数量有关[5, 6, 7] 。
2.1.3 血清TFF3水平与胃癌发生的关系及机制临床样本检测数据已显示,血清TFF3水平与胃癌的发生有关,但二者内在联系的机制并不明确。TFF3水平可能与胃癌并存的肠化生及程度相关,组织病理研究显示TFF3在胃癌组织弱表达,而在胃癌肠化生部位高表达,而这异位高表达的TFF3进入血液使得血清TFF3水平升高。Aikou等[6]研究显示,胃癌患者术后血清TFF1和TFF2水平明显下降,而TFF3水平却未发生明显变化,仍保持与术前一致高水平,而术后高水平TFF3的来源及原因也不明确,推测可能与手术创伤及术后食物路径改变有关,也可能是身体其他肿瘤或疾病的反应,因为在其他肿瘤(如子宫内膜癌、肺癌)及肾炎患者血清中TFF3水平也明显升高[16, 17, 18, 19],因此血清TFF3并非完全是胃癌发生特异性的标志物,二者相互联系的内在机制仍有许多问题待解决,因此,需要开展更多的研究来阐明血清TFF3水平与胃癌发生的关系及相关机制。
2.2 TFF3作为胃肠道肿瘤预后及药效评价的标志物TFF3与胃肠道肿瘤的转移、复发及预后也密切相关,可作为肿瘤患者不良预后独立的预测因子,同时也是胃肠癌化疗药效评价的一个重要指标。
胃肠癌组织中TFF3呈高水平表达或表达阳性的患者易发生肿瘤转移和复发,预后较差,生存率也低。Ding等[20]在一组142例胃癌组织样本中分析了TFF3表达与肿瘤淋巴结转移及患者预后的关系,结果表明,在淋巴结转移阳性的样本组中TFF3阳性率(50%)高于淋巴结转移阴性组(33%),且TFF3表达阳性患者组生存率低于TFF3阴性组。在结直肠癌样本研究中,Morito等[21]发现癌组织中TFF3表达阳性组与肿瘤远端转移有关,且患者术后一年复发率远高于TFF3表达阴性组,表明TFF3作为结直肠癌术后复发的风险因子及术后远期治疗效果评估的标志物具有重要意义。Li等[9]分析108例胃癌组织TFF3表达与患者术后预后的关系,结果显示有50%表达TFF3的患者术后预后较差。Meng等[22]研究也表明TFF3和survivin共表达与胃癌患者低生存率紧密相关。Im等[23]比较292例胃癌与20例正常组织的TFF3表达水平,发现有44.2%胃癌组织高表达TFF3,且TFF3呈高表达患者组的生存期也较短。
在TFF3蛋白水平变化与化疗效果关系的研究中,Casado等[8]发现化疗后结直肠癌组织中TFF3水平升高的患者获得的治疗效果及预后均较差;Xiao等[24]也发现经化疗后癌灶减小、病情获得部分缓解的晚期胃肠癌患者,其血清TFF3水平明显下降,提示TFF3可作为化疗疗效监测的药效学指标。
2.3 TFF3作为其他肿瘤标志物的研究TFF3作为肿瘤标志物研究主要集中于胃肠道肿瘤,但作为其他肿瘤标志物的研究近期也有许多报道,包括作为子宫内膜癌及甲状腺癌术前诊断的标志物。
2.3.1 作为子宫内膜癌标志物TFF3在子宫内膜癌中也呈高表达,与子宫内膜癌的发生发展紧密相关。TFF3作为子宫内膜癌诊断的标志物其感敏度和特异性优于肿瘤标志物CA125[16],特别是TFF3与其他标志物ER(雌激素受体)、PR(孕激素受体)及IMP3(胰岛素样生长因子II mRNA-结合蛋白3)联合,可将临床病理较难鉴别的子宫内膜样腺癌、浆液性癌及透明细胞癌三者进行有效区分,且ER+/PR+/TFF3+/IMP3-作为独立的免疫组织化学组合标志物,有望推广并应用于子宫内膜样腺癌的临床病理诊断[25]。
2.3.2 作为甲状腺癌标志物TFF3可将甲状腺微小浸润性滤泡癌与滤泡性腺瘤进行有效区分,对甲状腺肿瘤术前活检组织良恶的鉴别具有重要临床意义。当甲状腺肿瘤术前采用细针穿刺抽吸活检时,因病变的组织结构、包膜侵犯及血管情况等病理学特征较难观察,甲状腺微小浸润性滤泡癌与滤泡性腺瘤从细胞学上比较难于鉴别。研究表明,TFF3 mRNA在良性甲状腺瘤高表达,其表达水平是β-actin的10~100倍,而TFF3 mRNA在滤泡癌中的表达水平比在腺瘤中低10~100倍,从而以TFF3 mRNA水平的变化作为甲状腺微小浸润性滤泡癌诊断的标志物。Foukakis等[26, 27]在所研究的浸润滤泡癌和微小浸润滤泡癌标本中,均检测到TFF3 mRNA表达水平的下降,表明其具有较高的灵敏度。以此方法Takano率先开展130例患者的临床检测试验,并有望将其推广成为甲状腺肿瘤活检组织良恶性诊断的新方法[28, 29]。
此外,TFF3作为乳腺癌骨转移预测及内分泌治疗效果与预后评价的标志物也具有很大应用价值[30, 31]。
3 TFF3作为肿瘤生物标志物的临床应用与机制研究作为胃肠道及其他肿瘤标志物,TFF3在肿瘤诊断、治疗及预后等已显现较大的应用前景。但TFF3与肿瘤发生的关系,及在肿瘤发生发展过程中发挥作用的分子机制仍不明确[14]。因此,最终实现TFF3作为肿瘤标志物并应用于临床,还需依赖于其作用机制的研究与完全阐明。
三叶因子家族一方面是胃肠正常黏膜的组成部分,在维持胃肠道黏膜完整性、促进胃肠黏膜修复等具有重要作用。另一方面与肿瘤发生发展相关,特别是TFF3可促进肿瘤的生长、侵袭、转移与血管生成,在肿瘤发生发展过程中起重要作用,但其发挥生物学功能的具体分子机制目前仍不明确。
三叶因子通过受体或结合蛋白发挥生物学效应得到多数学者的普遍认同,已有研究也有力支持TFF是通过结合蛋白或受体-配体相互作用的方式发挥生物学功能[32, 33, 34],也有相关候选受体的报道[35, 36]。研究表明,TFF3可激活EGF受体信号转导级联反应,导致β-连结素磷酸化,这使得钙黏蛋白表达水平下降,改变细胞之间的相互作用,破坏细胞之间的粘连,促进细胞迁移,加快损伤黏膜的修复与重建。还可调节COX-2和EGF-R介导的信号途径,通过MAPK 、JNK、p38等途径发挥信号转导影响细胞的生长、增殖、迁移和血管生成[37, 38]。最近研究发现,TFF3受Toll样受体2调节,通 过PI3K/Akt信号转导途径发挥肠道黏膜保护作用[39];在胃癌细胞中TFF3通过Twist通路促进细胞的迁移[40];在子宫内膜癌中,TFF3与雌激素受体发生相互作用[41]。但确切的受体或结合蛋白都还未知,TFF3属于孤儿配体,由TFF3受体或相互作用蛋白介导的具体信号转导途径也不明确。因此寻找并确定TFF3受体或发挥功能需要的结合蛋白,成了阐明其分子机制关键的第一步,对推动TFF3作为肿瘤生物标志物的临床应用研究也具有重大意义。
4 展望TFF3作为肿瘤特别是胃癌非侵入性诊断的新型标志物具有独特的优势和临床价值,但其对肿瘤诊断的敏感度与特异性仍有许多问题待研究,如TFF3对不同病理分型胃癌诊断的敏感度存在差异、对胃癌诊断的特异性受其他肿瘤或疾病的影响、TFF3对低分化弥漫型胃癌诊断的敏感度仍偏低等。因此需要有更多的临床中心参与并开展更多的前瞻性研究,以进一步阐明其肿瘤发生、诊断的关系;还需要有更多的临床队列实验数据,以确定其作为肿瘤标志物的敏感度与特异性。针对肿瘤高异质性的特点,寻找与TFF3联合的标志物并组成标志物群,有望提高TFF3对胃癌诊断的敏感度与特异性,这也是肿瘤标志物未来发展的重要方向。
未来望有更多的临床中心互相协作,共同开展TFF3作为肿瘤标志物的临床应用研究,更快地实现将其应用于肿瘤早期诊断、治疗与预后评估的目标,让更多肿瘤患者受益。
| [1] | Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2): 69-90. |
| [2] | DeSantis CE, Lin CC, Mariotto AB, et al. Cancer treatment and survivorship statistics.2014[J]. CA Cancer J Clin, 2014, 64(4): 252-71. |
| [3] | Gerlinger M, Rowan AJ, Horswell S, et al. Intratumor heterogeneity and branched evolution revealed by multiregion sequencing[J]. N Engl J Med, 2012, 366(10): 883-92. |
| [4] | Oesper L, Satas G, Raphael BJ, et al. Quantifying tumor heterogeneity in whole-Genome and whole-exome sequencing data[J]. Bioinformatics, 2014, 30(24): 3532-40. |
| [5] | Kaise M, Miwa J, Tashiro J, et al. The combination of serum trefoil factor 3 and pepsinogen testing is a valid non-endoscopic biomarker for predicting the presence of gastric cancer: a new marker for gastric cancer risk[J]. J Gastroenterol, 2011, 46(6): 736-45. |
| [6] | Aikou S, Ohmoto Y, Gunji T, et al. Tests for serum levels of trefoil factor family proteins can improve gastric cancer screening[J]. Gastroenterology, 2011, 141(3): 837-45. |
| [7] | Huang Z, Zhang X, Lu H, et al. Serum trefoil factor 3 is a promising non-invasive biomarker for gastric cancer screening: a monocentric cohort study in China[J]. BMC Gastroenterol, 2014, 14:74. |
| [8] | Casado E, Garcia VM, Sánchez JJ, et al. Upregulation of trefoil factor 3(TFF3) after rectal cancer chemoradiotherapy is an adverse prognostic factor and a potential therapeutic target[J]. Int J Radiat Oncol Biol Phys, 2012, 84(5): 1151-8. |
| [9] | Li Y, Sun Z, Liu K, et al. Prognostic significance of the co-expression of nucleophosmin and trefoil factor 3 in postoperative gastric cancer patients[J]. Mol Clin Oncol, 2014, 2(6): 1055-61. |
| [10] | Takano T, Yamada H. Trefoil factor 3 (TFF3): a promising indicator for diagnosing thyroid follicular carcinoma[J]. Endocr J, 2009, 56(1): 9-16. |
| [11] | Taupin D, Podolsky DK. Trefoil factors: initiators of mucosal healing[J]. Nat Rev Mol Cell Bio, 2003, 4(9): 721-32. |
| [12] | Kjellev S. The trefoil factor family-small peptides with multiple functionalities[J]. Cell Mol Life Sci, 2009, 66(8): 1350-69. |
| [13] | Madsen J, Nielsen O, Tornøe I, et al. Tissue localization of human trefoil factors 1, 2, and 3[J]. J Histochem Cytochem, 2007, 55(5): 505-13. |
| [14] | May PE. The potential of trefoil proteins as biomarkers in human cancer[J]. Biomarkers Med, 2012, 6(3): 301-4. |
| [15] | Kaise M, Miwa J, Fujimoto A, et al. Influence of Helicobacter pylori status and eradication on the serum levels of trefoil factors and pepsinogen test: serum trefoil factor 3 is a stable biomarker[J]. Gastric Cancer, 2013, 16(3): 329-37. |
| [16] | Bignotti E, Ravaggi A, Tassi RA, et al. Trefoil factor 3: a novel serum marker identified by gene expression profiling in high-grade endometrial carcinomas[J]. Br J Cancer, 2008, 99(5): 768-73. |
| [17] | Qu Y, Yang Y, Ma D, et al. Increased trefoil factor 3 levels in the serum of patients with three major histological subtypes of lung cancer[J]. Oncol Rep, 2012, 27(4): 1277-83. |
| [18] | Astor BC, K?ttgen A, Hwang SJ, et al. Trefoil factor 3 predicts incident chronic kidney disease: a case-control study nested within the Atherosclerosis Risk in Communities (ARIC) study[J]. Am J Nephrol, 2011, 34(4): 291-7. |
| [19] | Du TY, Luo HM, Qin HC, et al. Circulating serum trefoil factor 3 (TFF3) is dramatically increased in chronic kidney disease[J]. PLoS One, 2013, 8(11): e80271. |
| [20] | Ding A, Zhao W, Shi X, et al. Impact of NPM, TFF3 and TACC1 on the prognosis of patients with primary gastric cancer[J]. PLoS One, 2013, 8(12): e82136. |
| [21] | Morito K, Nakamura J, Kitajima Y, et al. The value of trefoil factor 3 expression in predicting the long-term outcome and early recurrence of colorectal cancer[J]. Int J Oncol, 2015, 46(2): 563-8. |
| [22] | Meng JR, Tang HZ, Zhou KZ, et al. TFF3 and survivin expressions associate with a lower survival rate in gastric cancer[J]. Clin Exp Med, 2013, 13(4): 297-303. |
| [23] | Im S, Yoo C, Jung JH, et al. Reduced expression of TFF1 and increased expression of TFF3 in gastric cancer: correlation with clinicopathological parameters and prognosis[J]. Int J Med Sci, 2013, 10(2): 133-40. |
| [24] | Xiao L, Liu YP, Xiao CX, et al. Serum TFF3 may be a pharamcodynamic marker of responses to chemotherapy in gastrointestinal cancers[J]. BMC Clin Pathol, 2014, 14: 26. |
| [25] | Mhawech-Fauceglia P, Yan L, Liu S, et al. ER+/PR+/TFF3+/IMP3- immunoprofile distinguishes endometrioid from serous and clear cell carcinomas of the endometrium: a study of 401 cases[J]. Histopathology, 2013, 62(7): 976-85. |
| [26] | Foukakis T, Gusnanto A, Au AY, et al. A PCR-based expression signature of malignancy in follicular thyroid tumors[J]. Endocr Relat Cancer, 2007, 14(2): 381-91. |
| [27] | Krause K, Eszlinger M, Gimm O, et al. TFF3-based candidate gene discrimination of benign and malignant thyoid tumors in a region with borderline iodine deficiency[J]. J Clin Endocrinol Metab, 2008, 93(4): 1390-3. |
| [28] | Yamada H, Takano T, Kihara M, et al. Measurement of TFF3 mRNA in aspirates from thyroid nodules using mesh filtration: the first clinical trial in 130 cases[J]. Endocr J, 2012, 59(7): 621-30. |
| [29] | Takano T. Aspiration biopsy-nucleic acid diagnosis for widely used preparative testing[J]. Rinsho Byori, 2012, 60(2): 132-8. |
| [30] | Ahmed AR, Griffiths AB, Tilby MT, et al. TFF3 is a normal breast epithelial protein and is associated with differentiated phenotype in early breast cancer but predisposes to invasion and metastasis in advanced disease[J]. Am J Pathol, 2012, 180(3): 904-16. |
| [31] | Pandey V, Wu ZS, Zhang M, et al. Trefoil factor 3 promotes metastatic seeding and predicts poor survival outcome of patients with mammary carcinoma[J]. Breast Cancer Res, 2014, 16(5): 429. |
| [32] | May FEB, Griffin SM, Westly BR, et al. The trefoil factor interacting protein TFIZ1 binds the trefoil protein TFF1 preferentially in normal gastric mucosal cells but the co-expression of these proteins is deregulated in gastric cancer[J]. Int J Biochem Cell Biol, 2009, 41(3): 632-40. |
| [33] | Yu H, He Y, Zhang X, et al. The rat IgGFcγBP and Muc2 C-terminal domains and TFF3 in two intestinal mucus layers bind together by covalent interaction[J]. PLoS One, 2011, 6(5): e20334. |
| [34] | Yang XN, Lu YP, Liu JJ, et al. Piezo1 is as a novel trefoil factor family 1 binding protein that promotes gastric cancer cell mobility in vitro[J]. Dig Dis Sci, 2014, 59(7): 1428-35. |
| [35] | Dubeykovskaya Z, Dubeykovskiy A, Solal-Cohen J, et al. Secreted trefoil factor 2 activates the CXCR4 receptor in epithelial and lymphocytic cancer cell lines[J]. J Biol Chem, 2009, 284(6): 3650-62. |
| [36] | Zhang Y, Yu G, Wang Y, et al. Activation of protease-activated receptor (PAR) 1 by frog trefoil factor (TFF) 2 and PAR4 by human TFF2[J]. Cell Mol Life Sci, 2011, 68(22): 3771-80. |
| [37] | Storesund T, Schenck K, Osmundsen H, et al. Signal transduction and gene transcription induced by TFF3 in oral keratinocytes[J]. Eur J Oral Sci, 2009, 117(5): 511-7. |
| [38] | Guleng B, Han J, Yang JQ, et al. TFF3 mediated induction of VEGF via hypoxia in human gastric cancer SGC-7901 cells[J]. Mol Biol Rep, 2012, 39(4): 4127-34. |
| [39] | Lin N, Xu LF, Sun M. The protective effect of trefoil factor 3 on the intestinal tight junction barrier is mediated by toll-like receptor 2 via a PI3K/Akt dependent mechanism[J]. Biochem Biophys Res Commun, 2013, 440(1): 143-9. |
| [40] | Zheng Q, Gao J, Li H, et al. Trefoil factor 3 peptide regulates migration via a Twist-dependent pathway in gastric cell[J].Biochem Biophys Res Commun, 2013, 438(1): 6-12. |
| [41] | Mhawech-Fauceglia P, Wang D, Samrao D, et al. Trefoil factor family 3(TFF3) expression and its interaction with estrogen receptor (ER) in endometrial adenocarcinoma[J]. Gynecol Oncol, 2013, 130(1): 174-80. |
 2015, Vol. 42
2015, Vol. 42