文章信息
- 黄裕,李雨聪,王冬,周琦.
- Huang Yu, Li Yucong, Wang Dong, Zhou Qi.
- 不同治疗方式对卵巢上皮癌患者铂类药物耐药性的影响
- SPlatinum Resistance after Neoadjuvant Chemotherapy Interval Debulking Surgery Compared with Primary Debulking Surgery on Patients with Advanced Epithelial Ovarian Carcinoma
- 肿瘤防治研究, 2015, 42(11): 1139-1143
- Cancer Research on Prevention and Treatment, 2015, 42(11): 1139-1143
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.11.0018
-
文章历史
- 收稿日期: 2014-12-31
- 修回日期: 2015-04-07
晚期卵巢上皮癌是目前病死率最高的妇科恶性肿瘤,虽然经过数十年不懈研究和努力,即使患者接受规范手术和化疗,75%患者仍在2~3年内复发,其5年生存率始终徘徊在20%~35%,无病生存时间和生存率一直未能取得突破性进展[1]。目前晚期卵巢上皮癌的标准治疗方案仍是初始肿瘤细胞减灭术(primary debulking surgery, PDS)辅以铂类药物的联合化疗[2]。然而晚期卵巢癌患者中接受PDS能达到满意肿瘤细胞减灭者(optimal cytoreduction)仅为30%~60% [3],针对未能达到满意的肿瘤细胞减灭的患者以及高龄、有合并症等不适合直接手术的患者,新辅助化疗(neoadjuvant chemotherapy, NACT)联合间隔性细胞减灭术(interval debulking surgery, IDS)成为了治疗的另一选择。本研究对87例临床病理分期为Ⅲ期和Ⅳ期的卵巢上皮癌患者病历资料进行回顾性分析,探讨两种治疗方式对患者首次复发时间的影响,并分析产生铂类药物耐药的相关因素。
1 资料与方法 1.1 研究对象选择2007年1月—2013年12月在重庆市肿瘤医院完成治疗的87例晚期卵巢上皮癌患者病历资料进行统计分析,所有患者均按期复查随访至肿瘤首次复发。
1.2 纳入和排除标准纳入标准为:(1)按2009年FIGO卵巢癌分期标准,经手术-病理分期诊断为ⅢA、ⅢB、ⅢC和Ⅳ期的原发性卵巢上皮癌、输卵管癌或腹膜癌的患者;(2)所有患者的外科手术均由重庆市肿瘤研究所妇瘤科肿瘤医师团队完成;(3)所有患者术后完成了4~8周期以铂类药物联合紫杉醇类药物为基础的辅助化疗;(4)术前新辅助化疗方案亦为铂类药物联合紫杉醇类药物;(5)末次化疗结束后在我院定期复查随访至首次复发。
排除标准:病理类型为非上皮性、合并严重内科疾患未能接受手术、术后未能完成4周期以上联合化疗、非铂类联合紫杉醇类药物化疗方案、临床病理资料不完整、未在我院定期随访等患者。
1.3 治疗方式 1.3.1 手术肿瘤细胞减灭术的手术范围为全子宫、大网膜、双附件、阑尾及其他部位肉眼可见病灶的全部切除,若探查有肿大淋巴结者则行淋巴结切除术。满意肿瘤细胞减灭术定义为完成手术后,肉眼不可见肿瘤或最大残余肿瘤结节的直径 < 1 cm[4]。
1.3.2 新辅助化疗紫杉醇(脂质体)联合卡铂或紫杉醇(脂质体)联合顺铂化疗方案,剂量选择为紫杉醇(脂质体)150 mg/m2 ,卡铂AUC=5(静脉滴注)或顺铂80 mg/m2(腹腔灌注)。化疗14 d后评估疗效,1~4周期后进行间隔性细胞减灭术,手术距离末次化疗时间间隔为18~25 d。
1.3.3 术后辅助化疗选择铂类联合紫杉醇类药物为基础的化疗方案,紫杉醇或紫杉醇脂质体联合卡铂或顺铂,按标准剂量用药[紫杉醇(脂质体)150 mg/m2 、卡铂AUC=5或顺铂60 mg/m2],给药方式主要为静脉滴注,仅腹膜癌患者术后进行了2周期的顺铂腹腔灌注化疗(顺铂80 mg/m2)。
1.4 疗效评价采用RECIST标准评价标准,完全缓解(CR):肿瘤病灶全部消失,无新病灶出现,血清糖类抗原125(CA125)≤35 u/ml;部分缓解(PR):肿瘤病灶最大直径之和减少≥30%,维持4周,血清CA125>35 u/ml但低于最初的50%以上;疾病稳定(SD):肿瘤病灶最大直径之和缩小未达PR,或增大未达疾病进展(PD),血清CA125未见明显升高;PD:肿瘤病灶最大直径之和至少增加20%,或出现新的病灶,血清CA125 显著增加。
判断卵巢癌复发定义为:再次出现腹水,和(或)血清糖类抗原125(CA125)﹥35 u/ml,和(或)影像学提示出现复发或转移病灶[5]。
1.5 铂类药物耐药分析记录患者接受铂类药物化疗的末次治疗时间至诊断卵巢癌复发的间隔时间,停用化疗药物12月以上的复发患者定义为铂类药物敏感型,12月以内、6月以上的复发患者定义为铂类药物部分敏感型,6月以内或疾病持续进展者定义为铂类药物耐药型[5]。以上均由有经验的妇科肿瘤专科医师进行复查和判定,87例患者均未失访。
1.6 统计学方法采用SPSS 17.0统计软件进行统计学处理,计量资料以(x±s)表示,组间比较采用t检验;分类资料比较采用χ2检验或Fisher精确概率检验;疗效分析采用Ridit分析法;铂类药物耐药影响因素分析采用Logistic多变量回归分析;P﹤0.05为差异有统计学意义。
2 结果 2.1 临床特征分析比较87例患者年龄32~72岁,平均(53±7)岁,其中卵巢癌81例,腹膜癌2例,输卵管癌4例。FIGO 分期: Ⅲ期79例,Ⅳ期8例。卵巢癌患者病理类型分布为浆液腺癌56例,癌肉瘤1例,子宫内膜样癌6例,黏液腺癌7例,透明细胞癌8例,混合性癌3例。另有癌肉瘤1例,见表 1。
 |
按照治疗方法的不同,将两组患者分为PDS组及NACT-IDS组(56例 vs. 31例),其平均年龄、术前CA125值、满意肿瘤细胞减灭率差异均无统计学意义(P>0.05),NACT-IDS组有较高的Ⅳ期患病率(22.6% vs. 1.8%),PDS组术后接受6周期以上的紫杉醇联合铂类药物化疗者人数较多,但组间差异均无统计学意义(P=0.2)。
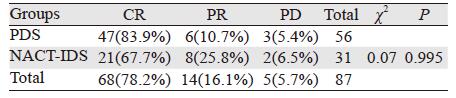
2.2 疗效分析比较所有化疗疗程完成后,对患者疗效进行评估,总体化疗有效率为94.3%,NACT-IDS组有效率为93.5%;PDS组有效率为94.6%。虽然PDS组术后应用铂类为基础的化疗治疗反应率稍高,但并不优于NACT-IDS组(χ2=0.07, P=0.995),见表 2。
 |
末次化疗结束后,两组分别有4例(7.1% vs.12.9%)在6月内复发,总耐药率为9.2%,铂类药物敏感率为71.3%,铂类药物部分敏感率为19.5%,两组化疗铂类药物耐药比较,差异有统计学意义(χ2=6.52, P=0.03),提示新辅助化疗使患者铂类药物耐药风险增加,见表 3。
 |
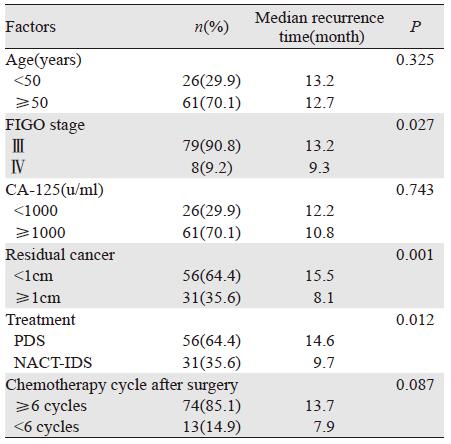
单因素非条件Logistic 回归分析结果显示,肿瘤临床分期、满意肿瘤细胞歼灭率和治疗方式为影响铂耐药产生的显著因素,两组总体方差的F检验差异具有统计学意义(P=0.012),见表 4。
 |
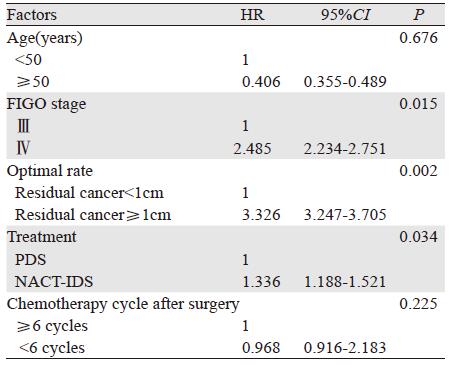
选择年龄、临床分期、治疗方式、术后化疗次数、手术残留病灶大小等几方面为自变量,复发时间为被解释变量,建立逐步回归模型,结果对铂类药物耐药有显著影响的指标是手术残留病灶≥1 cm(HR=3.326,P=0.002)、临床分期(HR=2.485, P=0.027)和治疗方式(HR=1.336, P=0.034),见表 5。
 |
卵巢癌被认为是实体瘤中对细胞毒性化疗药物最为敏感的肿瘤之一,因原发输卵管癌及腹膜癌生物学行为与卵巢癌相近,在初始细胞减灭术的基础上施以铂类药物为主的联合化疗已成为此三种恶性肿瘤的常规治疗方案,并有效延长了晚期患者的生存期。近年来多项研究证实新辅助化疗后行间隔性肿瘤细胞减灭术(NACT-IDS),能够获得更高的满意肿瘤细胞减灭率、有效降低手术并发症,此方案也成为临床医师乐于选择的治疗策略[6,7]。Vergote等[8]一项前瞻性随机对照研究结果显示采取两种治疗方案,患者的总生存率和无疾病生存率相当,而其他回顾性研究结果则认为NACT-IDS组的总生存率低于PDS组,而无疾病生存率相当[9,10]。本研究因入组患者治疗时间长、复发后治疗选择影响因素多而复杂、随访数据缺失等因素,难以对患者的中位无病生存期和总生存率进行比较分析,主要侧重分析NACT-IDS方案是否会提高晚期卵巢癌患者的铂类药物耐药性。
卵巢癌铂类药物耐药产生的机制十分复杂,是一个多基因、多因素、多水平共同参与的结果,包括肿瘤本身性质及治疗过程中的获得性因素。新辅助化疗提高了满意肿瘤细胞歼灭率,缩小了肿瘤体积,降低了手术并发症,但并未能有效延长患者的生存时间,是否会导致铂类药物耐药更早发生,从而缩短患者的无疾病生存时间,尚存在争议[11,1213]。
本研究一般临床特征显示,相对于PDS组NACT-IDS组Ⅳ期患者数量更多,但中位年龄、分期、病理类型等无显著差异。从表 2可见两组化疗反应有效率均高于90%,PDS组相较更优,有研究认为原因一方面是肿瘤细胞减灭术切除不良血供的大块肿瘤后,化疗药物更易渗透进入残留的小体积肿瘤;另一方面手术后肿瘤细胞的增殖周期加快,对化疗药物的敏感度更高,因此在进行初始肿瘤细胞减灭术后再补充系统化疗能够更有效提高化疗药物的作用[14,15]。而体积较大的肿瘤存在更多的耐药细胞,采用NACT-IDS治疗方案则将很可能增加肿瘤细胞获得性耐药的风险[16]。
本研究对比不同治疗方式的两组患者出现铂类药物耐药的时间和耐药率均有显著差异,与前述文献结果一致。而Rauh-Hain等[17]认为采取NACT-IDS方案治疗的患者首次治疗发生铂类药物耐药率与PDS组相较无明显差异,但该组患者复发后再化疗时出现的铂类药物耐药率会更高。本研究选择年龄、临床分期、治疗方式、术后化疗次数、手术残留病灶大小等因素建立逐步回归模型,结果显示无论哪种治疗方式,对患者复发时间和铂类药物耐药率有显著影响的指标仍是手术残留病灶大小与临床分期,已成为共识[18,19]。Hynninen等[20]提出新辅助化疗使病灶退缩,外科医师实施手术时肉眼识别率降低,减灭不足造成微小病灶的残留,或是化疗瘢痕纤维化组织中肿瘤干细胞的存在,继而易出现耐药,对预后产生不利影响。一些研究认为减瘤术前化疗次数、间隔周期长短也与产生铂类药物耐药风险有关,Bristow等[21]研究认为术前每增加一周期新辅助化疗将会使中位生存时间减少4.1月。而一项新辅助化疗6周期后再手术的晚期卵巢癌研究却认为化疗次数并未使患者的铂类药物耐药率显著上升[22]。在本研究中,由于剔除了非铂类药物联合紫杉醇化疗方案,术后化疗少于6周期的入选人数相对较少,统计分析偏倚较大,需要进一步增加样本量,获得更加客观的结果。
许多基因分子途径参与了铂类药物耐药的产生,包括肿瘤细胞DNA分子损伤修复系统的改变、信号通路的变化、细胞内降低铂类药物有效浓度、细胞凋亡调控的异常以及分子电子循环等[23,24,25],是极其复杂多源的,抑制这些单一途经并不能使耐药得到改善,需根据患者的个体差异进行临床干预,对患者进行分层治疗以获得最优治疗效果,因此目前并未标准化肿瘤细胞减灭术前应给予的新辅助化疗疗程时间,从3~6周期或更多,最优NACT-IDS方案尚待开展更多的前瞻性临床试验进一步制定[26]。
本研究回顾性分析晚期卵巢癌(包括输卵管癌及腹膜癌)患者对铂类药物耐药性的风险,比较了PDS与NACT-IDS两种方案治疗后患者对铂类药物敏感度的差异,虽然存在样本量较小和选择偏倚的缺陷,但仍显示了新辅助化疗后行间隔细胞减灭术治疗有效率与初始肿瘤细胞减灭术后联合铂类为基础的化疗有效治疗反应率相当,但增加了铂类药物耐药风险,指导临床在治疗方案的选择上需更加慎重。
| [1] | Siegel R, Naishadham D, Jemal A. Cancer statistics[J]. CA Cancer J Clin, 2013, 63(1): 11-30. |
| [2] | van Meurs HS, Tajik P, Hof MH, et al. Which patients benefit most from primary surgery or neoadjuvant chemotherapy in stage ⅢC or Ⅳ ovarian cancer? An exploratory analysis of the European Organization for Research and Treatment of Cancer 55971 randomised trial[J]. Eur J Cancer, 2013, 49(15): 3191-201. |
| [3] | Chang SJ, Bristow RE, Ryu HS. Impact of complete cytoreduction leaving no gross residual disease associated with radical cytoreductive surgical procedures on survival in advanced ovarian cancer[J]. Ann Surg Oncol, 2012, 19(13): 4059-67. |
| [4] | Chang SJ, Bristow RE. Evolution of surgical treatment paradigms for advanced stage ovarian cancer: redefining ′optimal′ residual disease[J]. Gynecol Oncol, 2012, 125(2): 483-92. |
| [5] | Rauh-Hain JA, Nitschmann CC, Worley MJ Jr, et al. Platinum resistance after neoadjuvant chemotherapy compared to primary surgery in patients with advanced epithelial ovarian carcinoma[J].Gynecol Oncol, 2013, 129(1): 63-8. |
| [6] | Dewdney SB, Rimel BJ, Reinhart AJ, et al. The role of neoadjuvant chemotherapy in the management of patients with advanced stage ovarian cancer: survey results from members of the Society of Gynecologic Oncologists[J]. Gynecol Oncol, 2010, 119(1): 18-21. |
| [7] | Keyver-Paik MD, Zivanovic O, Rudlowski C, et al. Interval debulking surgery in patients with Federation of Gynecology and Obstetrics(FIGO) stage ⅢC and Ⅳovarian cancer[J]. Onkologie, 2013, 36(6): 324-32. |
| [8] | Vergote I, Tropé CG, Amant F, et al. Neoadjuvant chemotherapy or primary surgery in stage ⅢC or Ⅳovarian cancer[J]. N Engl J Med, 2010, 363(10): 943-53. |
| [9] | Rauh-Hain JA, Rodriguez N, Growdon WB, et al. Primary debulking surgery versus neoadjuvant chemotherapy in stage Ⅳ ovarian cancer[J]. Ann Surg Oncol, 2012, 19(3): 959-65. |
| [10] | Chi DS, Musa F, Dao F, et al. An analysis of patients with bulky advanced stage ovarian, tubal, and peritoneal carcinoma treated with primary debulking surgery (PDS) during an identical time period as the randomized EORTC-NCIC trial of PDS vs. neoadjuvant chemotherapy( NACT)[J]. Gynecol Oncol, 2012, 124(1): 10-4. |
| [11] | Le T, Faught W, Hopkins L, et al. Can surgical debulking reverse platinum resistance in patients with metastatic epithelial ovarian cancer?[J]. J Obstet Gynaecol Can, 2009, 31(1): 42-7. |
| [12] | Milam MR, Tao X, Coleman RL, et al. Neoadjuvant chemotherapy is associated with prolonged primary treatment intervals in patients with advanced epithelial ovarian cancer[J]. Int J Gynecol Cancer, 2011, 21(1): 66-71. |
| [13] | Fagö-Olsen CL, Ottesen B, Kehlet H, et al. Does neoadjuvant chemotherapy impair long-term survival for ovarian cancer patients? A nationwide Danish study[J]. Gynecol Oncol, 2014, 132(2): 292-8. |
| [14] | Muraji M, Sudo T, Iwasak, et al. Histopathology predicts clinical outcome in advanced epithelial ovarian cancer patients treated with neoadjuvant chemotherapy and debulking surger[J]. Gynecol Oncol, 2013, 131(3): 531-4. |
| [15] | Kehoe S, Hook J, Nankivell M, et al. Chemotherapy or upfront surgery for newly diagnosed advanced ovarian cancer: results from the MRC-CHORUS trial[J]. J Clin Oncol, 2013, 31(Suppl):abstr 5500. |
| [16] | Sato S, Itamochi H. Neoadjuvant chemotherapy in advanced ovarian cancer: latest results and place in therapy[J]. Ther Adv Med Oncol, 2014, 6(6): 293-304. |
| [17] | Rauh-Hain JA, Rodriguez N, Growdon WB, et al. Primary debulking surgery versus neoadjuvant chemotherapy in stage Ⅳ ovarian cancer[J]. Ann Surg Oncol, 2012, 19(3): 959-65. |
| [18] | Luyckx M, Leblanc E, Filleron T, et al. Maximal cytoreduction in patients with FIGO stage ⅢC to stage Ⅳovarian, fallopian, and peritoneal cancer in day-to-day practice: a retrospective french multicentric study[J]. Int J Gynecol Cancer, 2012, 22(8): 1337-43. |
| [19] | Fagö-Olsen CL, Håkansson F, Antonsen SL, et al. Diagnostic accuracy of risk of malignancy index in predicting complete tumor removal at primary debulking surgery for ovarian cancer patients[J]. Acta Obstet Gynecol Scand, 2013, 92(6): 721-6. |
| [20] | Hynninen J, Lavonius M, Oksa S, et al. Is perioperative visual estimation of intra-abdominal tumor spread reliable in ovarian cancer surgery after neoadjuvant chemotherapy?[J]. Gynecol Oncol, 2013, 128(2): 229-32. |
| [21] | Bristow RE, Eisenhauer EL, Santillan A, et al. Delaying the primary surgical effort for advanced ovarian cancer: a systematic review of neoadjuvant chemotherapy and interval cytoreduction[J]. Gynecol Oncol, 2007, 104 (2): 480-90. |
| [22] | Vanessa CM, Ângelo BS, Carlos HA, et al. Neoadjuvant chemotherapy with six cycles of carboplatin and paclitaxel in advanced ovarian cancer patients unsuitable for primary surgery:safety and effectiveness[J]. Gynecol Oncol, 2014, 132(2): 287-91. |
| [23] | Xiao X, Melton DW, Gourley C. Mismatch repair deficiency in ovarian cancer-molecular characteristics and clinical implications[J]. Gynecol Oncol, 2014, 132(2): 506-12. |
| [24] | Zhang GN, Liu H, Huang JM, et al.TP53 K351N mutation-associated platinum resistance after neoadjuvant chemotherapy in patients with advanced ovarian cancer[J]. Gynecol Oncol, 2014, 132(3): 752-7. |
| [25] | Matsuo K, Eno ML, Im DD, et al. Chemotherapy time interval and development of platinum and taxane resistance in ovarian, fallopian, and peritoneal carcinomas[J]. Arch Gynecol Obstet, 2010, 281(2): 325-8. |
| [26] | Segev Y, Gemer O, Auslender R, et al. Advanced ovarian cancer: primary debulking(PDS) or neoadjuvant chemotherapy(NACT)-still a debate[J]. Harefuah, 2014, 153(9): 527-31, 558. |
 2015, Vol. 42
2015, Vol. 42
