文章信息
- 李劲松,韩亮,于洋,刘勇.
- LI Jinsong, HAN Liang, YU Yang, LIU Yong.
- HOXB7对人非小细胞肺癌A549细胞增殖的影响
- HOXB7 Regulates Proliferation of Non-small Cell Lung Cancer Cell A549
- 肿瘤防治研究, 2015, 42(11): 1119-1123
- Cancer Research on Prevention and Treatment, 2015, 42(11): 1119-1123
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.11.013
-
文章历史
- 收稿日期: 2014-11-20
- 修回日期: 2015-05-20
肺癌是严重危害人类健康的恶性肿瘤之一,在世界范围内,肺癌发病率高居恶性肿瘤第二位。非小细胞肺癌(non-small cell lung cancer, NSCLC)约占肺癌的80%[1]。目前,非小细胞肺癌患者治疗效果不佳、预后差,5年生存率仍低于11%[2, 3]。HOX家族基因是与细胞正常分化、发育相关的转录因子,又称Ⅰ型同源异形盒基因,近年来研究表明HOX家族基因不仅与正常细胞的分化发育及器官形成密切相关[4],而且其家族许多基因的表达失调参与了人类多种肿瘤的发生发展及生物学行为的调控[5],在肿瘤疾病进程中具有非常重要的作用。因而,明确HOX家族基因在肿瘤发生发展中的作用,对肿瘤的诊断、治疗及预后评估具有指导意义。本课题以HOXB7为研究切入点,阐明其在非小细胞肺癌发生、发展过程中的作用。
1 资料与方法 1.1 资料非小细胞肺癌组织及癌旁组织标本来自于江苏省徐州市中心医院组织标本库,从2007—2008年开始收集整理(包括病理资料),并经过病理科严格鉴定共40例,其中男22例、女18例;年龄60岁以上24例、60岁及以下16例;Ⅰ期患者12例、Ⅱ期16例、Ⅲ期11例、Ⅳ期1例。所有入组患者手术前均未接受放化疗。
1.2 试剂非小细胞肺癌细胞系(A549、NCI-H1650、SK-MES-1),人支气管上皮细胞16HBE细胞系购自中国科学院典型培养物保藏委员会细胞库。RPMI 1640和DMEM培养液、胎牛血清(Gibco)、Antibiotic-Antimycotic(×100)、TRIzol均购自美国Invitrogen公司;SYBR荧光染料试剂、实时定量PCR试剂盒购自日本TaKaRa公司;MTT购于美国Sigma公司,二甲基亚砜(DMSO)购于美国Biosharp公司。Anti-HOXB7抗体购自美国Abcam公司。
1.3 方法 1.3.1 细胞培养16HBE、A549、NCI-H1650、SK-MES-1细胞用RPMI 1640或DMEM培养液培养。培养液中含有10% FBS、100 u/ml青霉素以及100 mg/L链霉素,于37℃、含5%CO2的恒温培养箱中常规培养。每1~2天更换新鲜培养液,当细胞融合度达到80%~90%时传代。
1.3.2 实时定量PCR提取非小细胞肺癌组织及细胞总RNA,Real-time PCR检测非小细胞肺癌组织和细胞中HOXB7的表达水平。总的反应体系20 μl:ddH2O 7.8 μl、DNA模板1 μl、上下游引物各0.4 μl、ROX Reference Dye(×50)0.4 μl、SYBR10 μl。反应条件为:预变性95℃ 30 s,接着95℃ 5 s,60℃ 34 s进行40个循环,在PCR反应体系中,加入SYBR荧光染料试剂,每个样本设置3个复孔。HOXB7上游引物:5’-CCTTTGAGCAGAACCTCTCC-3’,下游引物:5’-GTCTTTCCGTGAGGCAGAG-3’;GAPDH上游引物:5’-AGCCACATCGCTCAGACAC-3’,下游引物:5’-GCCCAATACGACCAAATCC-3’。
1.3.3 免疫组织化学EnVision法检测HOXB7的表达病理标本取材后,经10%中性甲醛固定、组织脱水、二甲苯透明、石蜡包埋切片、脱蜡水化、抗原热修复等步骤,鼠抗人HOXB7单抗(Santa Cruz Biotechnology,CA)1∶500稀释,4℃过夜,二抗( Dako,Ely,UK)室温孵育30 min,DAB显色,以PBS作为阴性对照。光学显微镜下读片,抗体表达于细胞核,呈棕黄色或棕褐色颗粒者为阳性细胞。在待测样本内选取5个代表性的视野,同一医生计算阳性率(肿瘤细胞中的阳性细胞数/瘤细胞总数)根据表达水平分为<25%、25%~50%,>50%~75%及>75% 这4个级别,分别计算为1~4分。
1.3.4 转染si-HOXB7抑制HOXB7表达将A549细胞分为两组,分别为抑制阴性对照组和处理组。两组分别转染si-NC(非特异性的干扰序列)、si-HOXB7。运用转染试剂LipofectamineTM 2000进行转染,稀释DNA以及LipofectamineTM 2000,混合两种稀释液保温20 min,加入培养细胞中孵育。转染后24~48 h收集各组细胞用于后续实验。si-HOXB7 5’-CUAUUCGAUUUGAGUUUCCdTdT-3’和si-NC由Invitrogen公司设计并合成。
1.3.5 MTT实验检测细胞增殖将转染si-NC、si-HOXB7两组A549细胞分别接种于96孔板,置于37℃、5%CO2饱和湿度培养箱中培养过夜。分别在0、24、48、72、96 h时每孔加入5 mg/ml MTT 20 μl,继续培养4 h后吸弃培养液,每孔加入150 μl的DMSO。微样振荡器振荡10 min后用酶联免疫检测仪测定490 nm处的吸光度值并分析数据。
1.3.6 流式细胞术检测细胞周期将(1~2)×105个A549细胞接种于6孔板,待细胞贴壁后分别转染si-NC、si-HOXB7,24 h后离心收取细胞,70%冰冻酒精固定细胞2 h或过夜,用流式细胞仪分别检测两组的细胞周期,实验重复三次。
1.4 统计学方法采用SPSS17.0软件进行统计学处理,数据以均数±标准差(x± s)表示,单因素样本均数比较采用单因素方差分析(One-way ANOVA),分类资料比较采用卡方检验,多样本均数间两两比较采用LSD检验。生存曲线用KM曲线描述并用时序检验评价两组患者间的差别。P<0.05为差异有统计学意义。
2 结果 2.1 非小细胞肺癌组织中HOXB7的表达与NSCLC患者预后的关系为了检测HOXB7在非小细胞肺癌组织中的表达,利用实时定量PCR检测了40例非小细胞肺癌及相应的40例癌旁组织中HOXB7的表达水平。结果显示与肺正常组织相比,非小细胞肺癌组织中HOXB7的表达显著上调,平均约3.1倍,见图 1A。根据患者的病理资料初步分析发现,HOXB7的表达与患者的病理分期及肿瘤大小密切相关,Ⅲ/Ⅳ期HOXB7的表达水平高于Ⅰ/Ⅱ期,见图 1B,并且肿瘤越大的患者,HOXB7的表达越高,见图 1C。其他临床资料与HOXB7表达量的相关性分析见表 1,差异均无统计学意义。同时应用免疫组织化学法检测了25对组织切片中HOXB7表达水平,与癌旁组织相比,在肺腺癌和肺鳞癌组织中HOXB7的表达均增强,见图 1E。为了验证HOXB7在评价患者预后中的价值,选取HOXB7表达的中位数将患者进行分组,高于中位数的患者认为是高表达,低于中位数的患者认为是低表达,并在两组间进行比较总生存期(OS)的差别。结果显示,高表达HOXB7的患者5年整体生存率较低表达的患者差,见图 1D。

|
| A: the HOXB7 expression in NSCLC tissues was significantly upregulated, compared with normal tissues; B: the expression levels of HOXB7 in stage Ⅲ/Ⅳwere higher than those in stageⅠ/Ⅱ; C: the expression levels of HOXB7 in the tumors whose diameter >5cm were significantly higher than those≤5cm; D: the prognosis of patients with high HOXB7 expression was poor; E: the EnVision immunohistochemical results indicated that the expression of HOXB7 were enhanced both in lung adenocarcinoma and squamous cell lung carcinoma, compared with the adjacent tissues (*: P<0.05 ; **: P<0.01) 图 1 非小细胞肺癌患者组织中HOXB7表达水平与其预后密切相关 Figure 1 HOXB7 expression in non-small cell lung cancer(NSCLC) tissues were closely related to the prognosis of NSCLC patients |
综上所述,HOXB7的表达在非小细胞肺癌组织中表达均显著上调,并且HOXB7的表达与NSCLC进程及预后密切相关。
2.2 HOXB7在非小细胞癌细胞株中表达水平检测及干扰实验在非小细胞肺癌细胞系(A549、NCI-H1650、SK-MES-1)中HOXB7表达显著高于16HBE细胞,P值分别为0.004、0.007、0.005,见图 2A。因为HOXB7在肺癌中是高表达的,我们选择相对高表达的细胞株A549,在A549细胞中敲低HOXB7的表达。通过外源性转染了HOXB7的干扰序列,以si-NC作为对照,提取细胞RNA,通过实时定量PCR检测干扰效率。结果显示与对照组相比,转染si-HOXB7的细胞中HOXB7的抑制率在70%左右(P=0.003),见图 2B。上述结果证实外源性的敲低出现了显著效果。
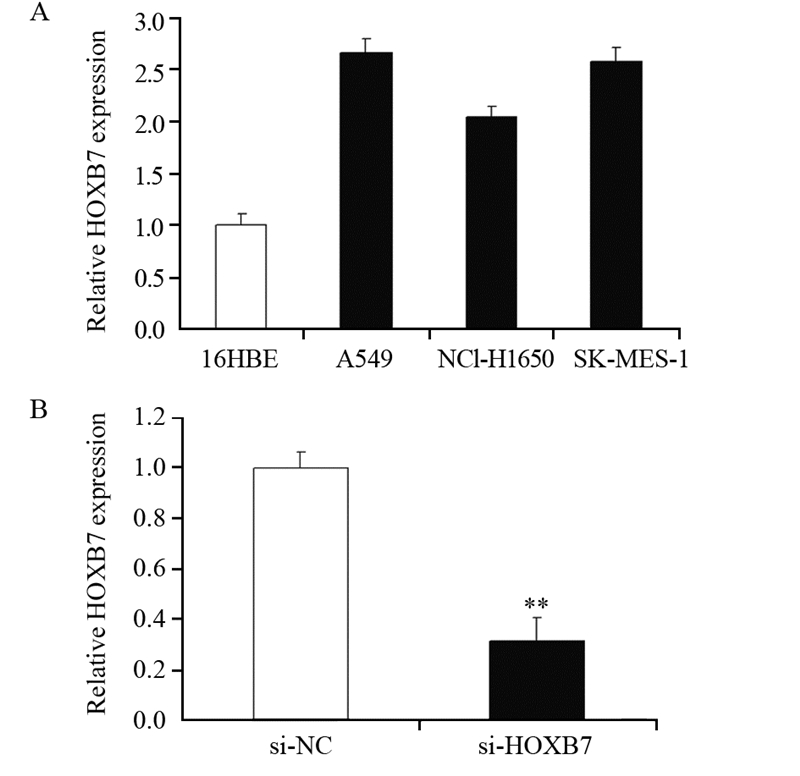
|
| A: the HOXB7 expression in lung cancer cells A549, NCI-H1650 and SK-MES-1 were significantly upregulated, compared with that in 16HBE cells; B: after transfected with si-HOXB7, HOXB7 expression in A549 cells was significantly reduced (**: P<0.01) 图 2 HOXB7在非小细胞肺癌细胞株中表达水平检测及干扰实验 Figure 2 The expression of HOXB7 in NSCLC cell lines and the knock-down experiment in A549 cells |
为了检测HOXB7对非小细胞肺癌细胞增殖能力的影响,在A549细胞中分别转染si-NC和si-HOXB7后,进行MTT实验检测对其细胞增殖能力的影响。结果显示,与对照组相比,干扰HOXB7之后细胞增殖能力明显降低,见图 3A。为进一步探索HOXB7影响细胞增殖是否通过影响细胞周期来实现的,在A549细胞中分别转染si-NC和si-HOXB7后,检测细胞周期,发现细胞能够被抑制在G1期,见图 3B。上述结果显示HOXB7表达水平下调能明显抑制非小细胞肺癌细胞A549的增殖能力。

|
| A: compared with si-NC transfection group, the cell proliferation in si-HOXB7 transfection group was significantly reduced; B: flow cytometry cyle monitoring showed that the cells in si-HOXB7 transfection group were significantly arrested in G1 phase (**: P<0.01) 图 3 抑制HOXB7的表达对A549细胞增殖及细胞周期的 影响 Figure 3 Down-regulating of HOXB7 expression could inhibit A549 cells proliferation and cycle |
HOX基因家族(同源异形盒基因)首先在果蝇体内发现的,它所编码的一系列蛋白质决定了果蝇的形态发育过程,如果该基因突变,将使果蝇的发育产生畸形[6]。在脊椎动物和哺乳动物的DNA中都发现同源异形盒的存在,根据其在染色体上的位置可以将Hox基因分为4 簇,HoxA、HoxB、HoxC和HoxD,排列在一条同源DNA链上,称为Hox位点,分别定位于不同染色体的特定区域[7, 8]。作为一类重要的正性和负性转录因子,Hox基因不仅在调控胚胎细胞的增殖和分化方面具有重要作用,也是成体组织细胞增殖和分化的重要调节因子。如果Hox基因发生异常表达,就会导致个体发育和组织器官形成过程中出现异常的形态结构,并可导致细胞恶化形成肿瘤[9, 10]。研究发现已有许多HOX家族基因表达异常及与多种肿瘤密切相关。其中,HOXA5在乳腺癌、胃癌中的表达均显著下调,过表达HOXA5能显著抑制细胞增殖,且HOXA5的启动子区存在高度甲基化[11, 12]。在肺癌中HOXA7和HOXA9由于其启动子区高度甲基化,其表达明显下调[13]。在宫颈癌中HOXC10表达明显上调,过表达的HOXC10能够促进细胞的侵袭[14]。而HOXB13与ER阳性乳腺癌细胞耐药性密切相关,高表达的HOXB13能够促进细胞的侵袭和迁移[15, 16, 17]。
本研究中,我们发现HOXB7的表达水平在非小细胞肺癌组织及细胞系中出现了显著的上调,并且高表达的HOXB7具有较差的预后。提示HOXB7在非小细胞肺癌的发生、发展过程中可能起着重要作用。为了阐明HOXB7在非小细胞肺癌发生中的确切作用,进一步研究HOXB7对非小细胞肺癌细胞的A549生物学功能的影响,结果发现在干扰HOXB7之后能显著促进A549细胞的增殖能力,并可阻滞细胞周期进程于G1期,有研究表明此种周期阻滞是由于上调p27Kip1引起的[18]。
新近研究表明HOXB7的异常表达与多种肿瘤的发生及肿瘤进程密切相关。HOXB7在乳腺癌中表达明显上调,并且能够促进乳腺癌的侵袭转移,与EMT(上皮细胞-间充质转化)密切相关[19, 20]。并且HOXB7在结肠癌中的表达也显著上调,HOXB7表达越高,患者5年整体生存率越差,高表达的HOXB7能够明显促进结肠癌细胞的增殖[18]。HOXB7在胰腺癌中的表达上调,能够促进胰腺癌细胞的侵袭,且高表达的HOXB7提示较差的预后[21]。
综上所述,我们的研究证实HOXB7在非小细胞肺癌组织及细胞中的表达显著上调,并且HOXB7的表达与NSCLC患者的病理分期与预后密切相关。抑制其表达则能显著抑制非小细胞肺癌细胞增殖能力,提示HOXB7的表达上调在非小细胞肺癌的进展过程中起着重要作用。然而HOXB7在非小细胞肺癌发生、发展中的确切作用机制尚需进一步阐明,将为未来临床上非小细胞肺癌的早期诊断、后期药物治疗提供有效的分子标志物。
| [1] | Goldstraw P, Crowley J, Chansky K, et al. The IASLC lung cancer staging project: proposals for the revision of the TNM stage groupings in the forthcoming(seventh) edition of the TNM classification of malignant tumours[J]. J Thorac Oncol, 2007, 2: 706-14. |
| [2] | Jemal A, Siegel R, Xu J, et al. Cancer statistics, 2010[J]. CA Cancer J Clin, 2010, 60(5): 277-300. |
| [3] | Verdecchia A, Francisci S, Brenner H, et al. Recent cancer survival in Europe: a 2000-02 period analysis of EUROCARE-4 data[J]. Lancet Oncol, 2007, 8(9): 784-96. |
| [4] | Pearson JC, Lemons D, McGinnis W. Modulating Hox gene functions during animal body patterning[J]. Nat Rev Genet, 2005, 6(12): 893-904. |
| [5] | Shah N, Sukumar S. The Hox genes and their roles in oncogenesis[J]. Nat Rev Cancer, 2010, 10(5): 361-71. |
| [6] | Gorski DH, Walsh K. The role of homeobox genes in vascular remodeling and angiogenesis[J]. Circ Res, 2000, 87(10): 865-72. |
| [7] | Cillo C, Cantile M, Faiella A, et al. Homeobox genes in normal and malignant cells[J]. J Cell Physiol, 2001, 188(2): 161-9. |
| [8] | Ford HL. Homeobox genes: a link between development, cell cycle, and cancer?[J]. Cell Biol Int, 1998, 22(6): 397-400. |
| [9] | Abate-Shen C. Deregulated homeobox gene expression in cancer: cause or consequence?[J]. Nat Rev Cancer, 2002, 2(10): 777-85. |
| [10] | Rao MK, Maiti S, Ananthaswamy HN, et al. A highly active homeobox gene promoter regulated by Ets and Sp1 family members in normal granulosa cells and diverse tumor cell types[J]. J Biol Chem, 2002, 277(29): 26036-45. |
| [11] | Raman V, Martensen SA, Reisman D, et al. Compromised HOXA5 function can limit p53 expression in human breast tumours[J]. Nature, 2000, 405(6789): 974-8. |
| [12] | Liu XH, Lu KH, Wang KM, et al. MicroRNA-196a promotes non-small cell lung cancer cell proliferation and invasion through targeting HOXA5[J]. BMC Cancer, 2012, 12: 348. |
| [13] | Rauch T, Wang Z, Zhang X, et al. Homeobox gene methylation in lung cancer studied by genome-wide analysis with a microarray-based methylated CpG island recovery assay[J]. Proc Natl Acad Sci U S A, 2007, 104(13): 5527-32. |
| [14] | Zhai Y, Kuick R, Nan B, et al. Gene expression analysis of preinvasive and invasive cervical squamous cell carcinomas identifies HOXC10 as a key mediator of invasion[J]. Cancer Res, 2007, 67(21): 10163-72. |
| [15] | Wang Z, Dahiya S, Provencher H, et al. The prognostic biomarkers HOXB13, IL17BR, and CHDH are regulated by estrogen in breast cancer[J]. Clin Cancer Res, 2007, 13(21): 6327-34. |
| [16] | Ma XJ, Wang Z, Ryan PD, et al. A two-gene expression ratio predicts clinical outcome in breast cancer patients treated with tamoxifen[J]. Cancer Cell, 2004, 5(6): 607-16. |
| [17] | Jerevall PL, Brommesson S, Strand C, et al. Exploring the two-gene ratio in breast cancer--independent roles for HOXB13 and IL17BR in prediction of clinical outcome[J]. Breast Cancer Res Treat, 2008, 107(2): 225-34. |
| [18] | Liao WT, Jiang D, Yuan J, et al. HOXB7 as a prognostic factor and mediator of colorectal cancer progression[J]. Clin Cancer Res, 2011, 17(11): 3569-78. |
| [19] | Wu X, Chen H, Parker B, et al. HOXB7, a homeodomain protein, is overexpressed in breast cancer and confers epithelial-mesenchymal transition[J]. Cancer Res, 2006, 66(19): 9527-34. |
| [20] | Rubin E, Wu X, Zhu T, et al. A role for the HOXB7 homeodomain protein in DNA repair[J]. Cancer Res, 2007, 67(4): 1527-35. |
| [21] | Nguyen Kovochich A, Arensman M, Lay AR, et al. HOXB7 promotes invasion and predicts survival in pancreatic adenocarcinoma[J]. Cancer, 2013, 119(3): 529-39. |
 2015, Vol. 42
2015, Vol. 42



