文章信息
- 周冲,练炼,郭林,康迪,李向阳,张伟,卜祥兆,殷海涛.
- ZHOU Chong, LIAN Lian, GUO Lin, KANG Di, LI Xiangyang, Zhang Wei, BU Xiangzhao, YIN Haitao.
- 食管癌放疗患者淋巴细胞最低值与疗效和预后的关系
- Relationship Between Lymphocyte Nadir and Radiotherapy Efficacy or Prognosis of Patients with Esophageal Carcinoma
- 肿瘤防治研究, 2015, 42(11): 1104-1108
- Cancer Research on Prevention and Treatment, 2015, 42(11): 1104-1108
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.11.010
-
文章历史
- 收稿日期: 2015-01-20
- 修回日期: 2015-04-28
2. 215131 苏州,苏州市相城区人民医院肿瘤内科
2. Department of Oncology, Suzhou Xiangcheng People’s Hospital, Suzhou 215131, China
淋巴细胞可特异性识别并杀伤肿瘤细胞或释放一系列细胞因子激活免疫系统,在肿瘤免疫反应方面起重要作用。淋巴细胞对辐射敏感,放疗可以杀伤循环血中的淋巴细胞从而干扰宿主免疫抗肿瘤效应。既往研究表明放疗所致的淋巴细胞降低在有的肿瘤中提示预后不良,如非小细胞肺癌[1, 2]、胰腺癌[3],脑胶质瘤[4]及头颈部癌[5],但有关放疗过程中的淋巴细胞抑制与临床病理因素的关系以及与食管癌疗效、预后关系的报道较少,本研究拟探讨初诊食管癌患者接受根治性放疗过程中淋巴细胞最低值与食管癌疗效和预后的关系。
1 资料与方法 1.1 患者资料本研究为回顾性队列研究。选取2011年1月至2012年12月期间145例食管癌在徐州市中心医院接受根治性放疗患者作为研究对象。纳入标准:(1)年龄≥18岁,卡氏评分≥70分且病理确诊为食管鳞癌或腺癌患者。(2)既往未接受过放化疗。(3)治疗前无穿孔、出血征象,治疗目的为根治性放疗。(4)治疗期间血常规资料完整。排除标准:(1)未完成放疗中途退出者。(2)放疗部位为非原发部位。(3)手术后辅助放疗或术前新辅助放疗者。本研究方案经徐州市中心医院伦理委员会审核通过。最终112例患者符合纳入标准。全组患者男71例,女41例,中位年龄71岁(37~91)岁。病理类型:鳞癌110例,腺癌2例。病变部位:颈段9例,胸上段28例,胸中段59例,胸下段16例。临床分期按照AJCC 2002分期:Ⅱ期76例,Ⅲ期36例。治疗方法:三维适形放疗87例,调强放疗25例。全组34例患者接受同期化疗。
1.2 治疗方法 1.2.1 放疗方法采取仰卧位热塑体膜固定体位,定位CT扫描,扫描层厚5 mm。CT数据集导入治疗计划系统。肿瘤大体靶区(gross tumor volume, GTV):参考纤维食管镜和钡餐造影检查所示病变长度及定位CT所示病变宽度勾画,同时包括CT所示的短径≥1.0 cm或PET/CT示代谢阳性的转移性颈部及纵隔肿大淋巴结。临床靶区(clinical tumor volume, CTV):为GTV前后左右方向外放0.5~0.8 cm、上下方向外扩3~5 cm,同时按照文献[6]包括相应淋巴引流区。计划靶区(planning tumor volume, PTV):根据我科摆位误差的实际情况在CTV的基础上前后左右方向外扩0.5 cm,上下方向外扩0.8 cm。PTV处方剂量56~66 Gy(中位值6 0 Gy)。危及器官勾画包括脊髓,双肺,心脏。计划评价要求95% PTV接受100%处方剂量照射,靶体积内的剂量均匀度为95%~105%等剂量线范围内。双肺V20≤25%~28%,肺平均剂量≤13 Gy,心脏V30≤40%,V40≤30%,脊髓最大剂量≤45 Gy。放疗技术采用三维适形或调强放疗。
1.2.2 化疗方法化疗方案为顺铂30 mg/m2×3天,5-Fu 500 mg/m2×5天,或紫杉醇135 mg/m2×1天,顺铂30 mg/m2×3天。同步化疗给药时间为放疗开始第1天,辅助化疗开始时间为放疗结束后1周,28天为一个周期。放疗过程中给予1~2周期化疗,放化疗期间定期复查血常规、生化,如第1周期出现Ⅲ度骨髓抑制,减少化疗药物20%用量,出现Ⅳ度骨髓抑制,终止第2周期化疗。
1.3 观察指标及疗效评价记录患者放疗前、放疗中(每周)及放疗结束后1月血常规资料,记录淋巴细胞计数。记录患者年龄、性别、卡氏评分、胃镜所示病变部位及长度、病理类型、临床TNM分期(AJCC 2002版)、是否同期化疗、治疗计划系统内测量食管病变处最大径、食管病变体积。治疗相关血液学毒性的评价依据美国癌症常见不良反应事件评价标准(common terminology criteria for adverse events, CTCAE)4.0版。近期疗效评价标准参照韩春等[7]食管癌放疗后近期疗效评价标准,将放疗结束1月食管钡餐结果分为完全缓解、部分缓解、无缓解或进展,有效为完全缓解+部分缓解。生存时间定义为从治疗开始至患者死亡时间。随访采用门诊定期复诊及电话随访两种方式,末次随访日期为2014年10月,中位随访时间27月(20~41月),失访8例,随访率93%。治疗结束后1月复查胸部CT、食管造影评价近期疗效,2年内每3月随访1次,2年以后每6月复查1次。
1.4 统计学方法使用SAS9.3统计软件进行统计分析。正态分布连续性变量采用均数±标准差表示。计数资料率的比较采用卡方检验或Fisher确切概率法。Kaplan-Meier法计算生存率,并绘制生存曲线,生存曲线间的比较采用Log rank检验。临床病理因素对预后的影响采用Cox比例风险模型分析。先行单因素分析,对有统计学意义的变量纳入多因素分析。以上所有检验均行双侧检验,检验水准α取0.05。
2 结果 2.1 放疗前后患者淋巴细胞计数变化趋势112例患者放疗前淋巴细胞计数平均数为(1.78±0.76)个/毫米3。放疗期间淋巴细胞随着治疗时间推移逐渐降低,一般在放疗接近结束时达最低值。放疗过程中淋巴细胞计数最低值为(0.45±0.22)个/毫米3,放疗结束后1月平均数为(0.94±0.30)个/毫米3,虽较放疗期间最低值有所升高,但仍较放疗前基线状态降低47%,放疗后1年为(1.15±0.39)个/毫米3。放疗结束后1年内患者淋巴细胞计数未随时间进一步进行性下降,但仍不能恢复至放疗前基线值,见图 1。

|
| 图 1 112例食管癌患者血淋巴细胞计数在放疗前及治疗后12月内变化趋势图 Figure 1 Lymphocyte count trend before and within 12 months after radiotherapy on 112 esophageal carcinoma patients |
将全组患者放疗期间淋巴细胞最低值以0.5个/毫米3(CTCAE 2级毒性)为界分为两组。两组患者在食管癌病变长度、病变最大宽度及同期化疗3个临床指标中差异有统计学意义(P<0.05),而在性别、年龄、病理类型、病变部位、TNM分期及治疗方法中差异无统计学意义(P>0.05),见表 1。
 |
放疗期间淋巴细胞最低值≥0.5个/毫米3组完全缓解13例,部分缓解31例,无缓解4例;<0.5个/毫米3组完全缓解7例,部分缓解38例,无缓解19例,两组之间近期有效率分别为92%及70%(χ2 =7.66, P=0.007)。
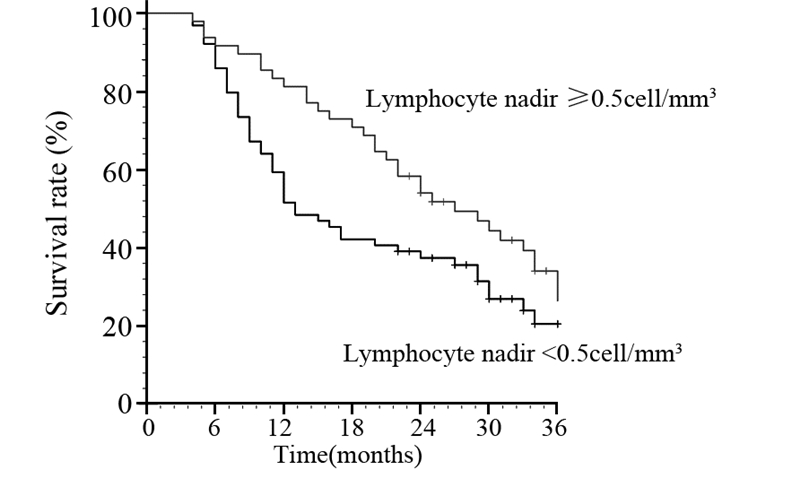
2.4 放疗期间淋巴细胞最低值和患者预后的关系生存分析显示淋巴细胞最低值<0.5个/毫米3组生存差于≥0.5个/毫米3组(χ2=4.489, P=0.034),见图 2。两组1年及2年生存率分别为51.6%、37.4%及81.3%、54.0%。单因素及多因素Cox回归分析均显示,疾病TNM分期、病变长度及放疗期间淋巴细胞最低值是影响OS的独立因素,见表 2。
|
| 图 2 食管癌患者治疗期间淋巴细胞最低值<0.5个/毫米3组 及≥0.5个/毫米3组患者的生存曲线 Figure 2 Kaplan-Meyer survival curves of esophageal carcinoma patients with lymphocyte nadirs < 0.5 cell/mm3 and ≥0.5 cell/mm3 during treatment |
 |
辐射对机体免疫效应的影响具有双重性[8],一方面辐射可通过远位效应等激活免疫系统促进机体抗肿瘤效应[9, 10],另一方面也可抑制机体免疫反应。淋巴细胞主要由T淋巴细胞和B淋巴细胞组成,是机体重要的免疫抗肿瘤反应介导细胞。经典放射生物学研究表明,淋巴细胞对辐射特别敏感,即使很低剂量的辐射也会引起淋巴细胞的死亡。一项体外研究表明,淋巴细胞的D10(细胞存活分数降低至10%所需的辐射剂量)仅约3 Gy[11]。本研究显示,食管癌患者随着放疗的进行,淋巴细胞绝对值呈下降趋势,治疗结束1月的淋巴细胞计数水平约为治疗前的53%。其他研究在非小细胞肺癌、头颈部癌及胰腺癌也发现了类似的现象[1,3,5]。本研究还发现放疗结束后1年内患者淋巴细胞计数仍然不能恢复至放疗前的基线水平,Ellsworth等在胶质瘤放疗中也发现类似现象,放疗结合替莫唑胺治疗后会引起持续性的淋巴细胞抑制[12]。
放疗所致的淋巴细胞抑制的具体机制及影响因素至今仍不甚明确。Kuo等[13]在非小细胞癌中的研究发现淋巴细胞降低可能是由于一种肿瘤分泌因子Galectin-1蛋白介导而引起。本研究发现,影响放疗期间淋巴细胞降低的临床因素为治疗前食管癌的长度及宽度。在食管癌放疗过程中,原发肿瘤的长度及宽度数值越大,为保证足够的临床靶区接受照射,往往照射范围越大。究其原因,考虑在放疗过程中,除了骨髓抑制对造血系统的影响以外,射野内的循环血也必然会接受照射,因此,照射范围越大,淋巴细胞抑制越明显。Tang等[2]对肺癌的研究也发现放疗所致的淋巴细胞抑制与放疗前肿瘤体积相关,研究者进一步将放疗计划系统的剂量体积参数,不同剂量照射的肺体积百分比与放疗所致的淋巴细胞抑制做相关分析,结果发现双肺V5(Vx指大于等于x Gy照射的肺体积)与放疗期间淋巴细胞最低值显著相关,而V10、V20、V60值相关性依次减低,这提示放疗所致的淋巴细胞减低主要与低剂量区照射的体积有关。此外,本研究也发现同期放化疗的患者淋巴细胞抑制更严重,推测系放化疗协同增加了肿瘤患者的骨髓抑制,进而导致淋巴细胞进一步降低。
目前有证据表明放疗期间所致的淋巴细胞抑制与肿瘤患者近期疗效及预后相关。本研究结果指出放疗期间,淋巴细胞最低值越高,提示近期疗效越好。Tang等[2]研究发现放疗期间淋巴细胞最低值与肺癌放疗的局部控制率有关。Verastegui等[14]对包含头颈部肿瘤、宫颈癌及中枢神经系统肿瘤的患者研究发现放疗所致的淋巴细胞减少与放疗后疾病复发相关。有研究者指出[13]放疗引起的淋巴细胞减少与非小细胞患者的预后有关。Campian等[1,15]发现高级别的胶质瘤与Ⅲ期非小细胞肺癌同样存在放疗所致的淋巴细胞抑制程度与总生存率相关。本研究结果也显示放疗期间淋巴细胞降低是影响食管癌患者预后的独立因素。有关淋巴细胞降低影响患者生存率的具体机制目前仍不清楚,推测可能系与淋巴细胞减低所致的机体抗肿瘤免疫反应降低有关。
总之,淋巴细胞计数是临床常见检验指标,获取方便,放疗期间淋巴细胞最低值可为临床医生提供有价值的近期疗效及预后信息。本研究也存在一些局限性,除回顾性研究存在选择性偏倚外,如样本数目较少,放化疗方案及时机均存在一定差异,且患者放疗期间淋巴细胞降低的程度个体变异度较大等。同样由于样本例数较少,未对单纯放疗和同步放化疗分层研究淋巴细胞最低值与疗效的关系,尚需进一步大样本的前瞻性研究加以确认。
| [1] | Campian JL, Ye X, Brock M, et al. Treatment-related lymphopenia in patients with stage Ⅲ non-small-cell lung cancer[J]. Cancer Invest, 2013, 31(3): 183-8. |
| [2] | Tang C, Liao Z, Gomez D, et al. Lymphopenia association with gross tumor volume and lung V5 and its effects on non-small cell lung cancer patient outcomes[J]. Int J Radiat Oncol Biol Phys, 2014, 89(5): 1084-91. |
| [3] | Balmanoukian A, Ye X, Herman J, et al. The association between treatment-related lymphopenia and survival in newly diagnosed patients with resected adenocarcinoma of the pancreas[J]. Cancer Invest, 2012, 30(8): 571-6. |
| [4] | Yovino S, Kleinberg L, Grossman SA, et al. The etiology of treatment-related lymphopenia in patients with malignant gliomas: modeling radiation dose to circulating lymphocytes explains clinical observations and suggests methods of modifying the impact of radiation on immune cells[J]. Cancer Invest, 2013, 31(2): 140-4. |
| [5] | Campian JL, Sarai G, Ye X, et al. Association between severe treatment-related lymphopenia and progression-free survival in patients with newly diagnosed squamous cell head and neck cancer[J]. Head Neck, 2014, 36(12): 1747-53. |
| [6] | Wang QF, Xiao ZF, Wang LH, et al. Efficacy of three-dimensional conformal radiotherapy for 132 patients with esophageal carcinoma[J]. Zhonghua Fang She Zhong Liu Xue Za Zhi, 2009, 18(1): 47-51. [王奇峰, 肖泽芬, 王绿化, 等. 132例食管癌三维适形放疗的疗效分析[J]. 中华放射肿瘤学杂志, 2009, 18(1): 47-51.] |
| [7] | Han C, Ren XJ, Wang L, et al. Evaluating short-term radiotherapeutic effect on esophageal cancer by barium meal combined with CT scans[J]. Zhonghua Fang She Zhong Liu Xue Za Zhi, 2013, 22(1): 26-9. [韩春, 任雪娇, 王澜, 等. 钡餐造影结合CT评价食管癌放疗近期疗效的研究[J]. 中华放射肿瘤学杂志, 2013, 22(1): 26-9.] |
| [8] | Formenti SC, Demaria S. Combining radiotherapy and cancer immunotherapy: a paradigm shift[J]. J Natl Cancer Inst, 2013, 105(4): 256-65. |
| [9] | Gameiro SR, Jammeh ML, Wattenberg MM, et al. Radiation-induced immunogenic modulation of tumor enhances antigen processing and calreticulin exposure, resulting in enhanced T-cell killing[J]. Oncotarget, 2014, 5(2): 403-16. |
| [10] | Park B, Yee C, Lee KM. The effect of radiation on the immune response to cancers[J]. Int J Mol Sci, 2014, 15(1): 927-43. |
| [11] | Nakamura N, Kusunoki Y, Akiyama M. Radiosensitivity of CD4 or CD8 positive human T-lymphocytes by an in vitro colony formation assay[J]. Radiat Res, 1990, 123(2): 224-7. |
| [12] | Ellsworth S, Balmanoukian A, Kos F, et al. Sustained CD4+T cell-driven lymphopenia without a compensatory IL-7/IL-15 response among high-grade glioma patients treated with radiation and temozolomide[J]. Oncoimmunology, 2014, 3(1): e27357. |
| [13] | Kuo P, Bratman SV, Shultz DB, et al. Galectin-1 mediates radiation-related lymphopenia and attenuates NSCLC radiation response[J]. Clin Cancer Res, 2014, 20(21): 5558-69. |
| [14] | Verastegui EL, Morales RB, Barrera-Franco JL, et al. Long-term immune dysfunction after radiotherapy to the head and neck area[J]. Int Immunopharmacol, 2003, 3(8): 1093-104. |
| [15] | Grossman SA, Ye X, Lesser G, et al. Immunosuppression in patients with high-grade gliomas treated with radiation and temozolomide[J]. Clin Cancer Res, 2011, 17(16): 5473-80. |
 2015, Vol. 42
2015, Vol. 42