文章信息
- 江龙委,蔡凯,黄伟谦,张燕,张闯,高艳荣,艾月琴,贾绍昌,丁蓉蓉
- JIANG Longwei, CAI Kai, HUANG Weiqian, ZHANG Yan, ZHANG Chuang, GAO Yanrong, AI Yueqin, JIA Shaochang, DING Rongrong
- rhG-CSF与rhGM-CSF动员人外周血单核细胞后DC疫苗数量及功能变化的比较
- Support Vector Machine Predicts Survival of Esophageal Squamous Cell Carcinoma Patients
- 肿瘤防治研究, 2015, 42(11): 1095-1099
- Cancer Res Prev Treat, 2015, 42(11): 1095-1099
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.08.004
-
文章历史
- 收稿日期: 2014-11-20
- 修回日期: 2015-05-22
2. 210002 南京,中国人民解放军第81医院门诊部
2. Department of Outpatient, 81 Hospital of PLA, Nanjing 210002, China
树突状细胞(dendritic cell, DC)是目前所认识的体内功能最强大的抗原提呈细胞(antigen—presenting cell, APC),能特异性激活针对肿瘤抗原的细胞免疫[1]。然而,晚期肿瘤患者往往处于免疫失调状态,且肿瘤细胞会分泌一些免疫抑制因子,如转化生长因子(transforming growth factor-β, TGF-β)等,导致DC往往处于功能缺陷状态而不能有效地激活细胞免疫[2, 3, 4, 5]。将外周血单核细胞体外诱导培养成DC并活化的技术为DC肿瘤疫苗的应用提供了基础。DC疫苗的疗效与负荷抗原类型、疫苗制备DC亚型和成熟/活化DC数量等密切相关[6, 7]。因此,制备更多数量的DC疫苗是提高疗效的一个探索方向。
我们前期的研究成果显示,粒细胞集落刺激因子(granulocyte colony-stimulating factor, G-CSF)动员能促进肿瘤患者外周血单核细胞数量增加[8]。G-CSF与粒细胞巨噬细胞集落刺激因子(granulocyte/macrophage colony-stimulating factor, GM-CSF)同属于集落刺激因子(colony-stimulating factor, CSF),在造血系统的分化过程中都起着重要的作用,但GM-CSF作用靶细胞的范围更广,且在造血干细胞分化为单核细胞的过程中起着主要的作用[9]。因此,GM-CSF在动员肿瘤患者外周血单核细胞的应用上与G-CSF相比谁更有优势需要进一步探讨。本研究旨在通过分析重组人粒细胞集落刺激因子(rhG-CSF)动员与重组人粒细胞巨噬细胞集落刺激因子(rhGM-CSF)动员后患者外周血单核细胞的数量及诱导促熟形成的DC产量、表型,探索大量制备DC疫苗的适宜方法。
1 资料与方法 1.1 研究对象与分组研究对象为2011年8月至2013年12月在中国人民解放军第81医院肿瘤生物治疗科行DC疫苗治疗的晚期(Ⅲ、Ⅳ期)肿瘤患者134例,均经病理确诊,治疗前做详细的体格检查,评估心、肺、肝和肾等重要脏器功能,同时进行梅毒和艾滋病检测,以及HBV和HCV病毒学检测。患者随机分为两组: rhG-CSF动员组69例,采集前行rhG-CSF动员3 μg/(kg·d),rhGM-CSF动员组65例,采集前行rhGM-CSF动员3 μg/(kg·d)。两组患者一般资料详见表 1,组间具有可比性(P > 0.05)。所有患者的临床试验程序均经81医院伦理委员会审查批准,全部受试患者均签署自体免疫细胞知情同意书。
主要试剂与设备注射用rhG-CSF购自深圳新鹏生物工程有限公司,注射用rhGM-CSF购自厦门特宝生物工程股份有限公司,白细胞介素-4(IL-4)及肿瘤坏死因子α(TNF-α)均为PeproTech公司产品,淋巴细胞分离液购自天津灏洋生物制品科技有限公司。X-VIVO培养液为美国LONZA公司产品。CD86-PE-CY5为BD公司产品, HLA-DR-ECD、CD83-FITC、CD80-FITC、CD54-PE-CY5均为美国Beckman公司产品。COM.TEC血细胞分离机为德国Fresenius公司产品,Beckman Coulter XL流式细胞仪为Beckman公司产品。
1.3 血象分析所有患者在动员前后行血常规检查。重点了解外周血中性粒细胞、淋巴细胞、单核细胞计数。
1.4 单个核细胞采集采用COM.TEC血细胞分离机进行单个核细胞采集,根据采集前血常规检查结果调整好参数,静脉穿刺或行深静脉插管。采集前血象要求:白细胞计数WBC>1×109/L,血细胞计数PLT>50×109/L,红细胞压积HCT>20%。
1.5 细胞培养经Ficoll密度梯度离心分离采集产物中单个核细胞,计数铺入75 cm2培养瓶,添加X-VIVO培养液至浓度为2×106/ml,摇匀后平放于37℃、5%CO2细胞培养箱培养1~2 h,吸取悬浮细胞用于CIK细胞培养。在附有贴壁细胞的空瓶中加入含rhGM-CSF(500 u/ml)及rhIL-4(10 ng/ml)的X-VIVO培养液,置于37℃、5%CO2细胞培养箱中培养。第3、5天半量换液1次,第6天加入负荷抗原,第7天加入TNF-α(500 u/ml),第8天收获肿瘤抗原致敏的DC疫苗用于回输患者。
1.6 流式细胞仪检测取部分收获的DC细胞,PBS洗涤和离心后,制成细胞悬液加入EP管内,每管5×105个,分两组加入流式抗体,第一组加入HLA-DR-ECD、CD11c-PE、CD83-FITC、CD54-PE-CY5;第二组加入HLA-DR-ECD、CD11c-PE、CD80-FITC、CD86-PE-CY5;4℃避光染色30 min,再次离心洗涤2次,上机检测,检测结果用CXP(v2.1)软件分析。
1.7 ELISA检测取小部分细胞培养9天后(即促熟48 h)收集细胞上清液,按ELISA试剂盒要求进行酶联免疫吸附试验检测IL-12(p70)、IFN-γ和IL-10细胞因子浓度。
1.8 统计学方法用SPSS 18.0统计软件处理资料,计量资料以(x±s)表示,两组间比较采用t检验(正态分布时)或者Wilcoxon秩和检验(非正态分布时)。P<0.05为差异有统计学意义。制图采用Origin 7.5软件。
2 结果 2.1 两组患者动员前后血象变化比较动员前后rhGM-CSF动员组中性粒细胞的增高值(动员后减去动员前)显著低于rhG-CSF动员组(P≤0.001), 而单核细胞的增高值高于rhG-CSF动员组(P≤0.001),两者淋巴细胞的增高值差异无统计学意义(P=0.649),见图 1。
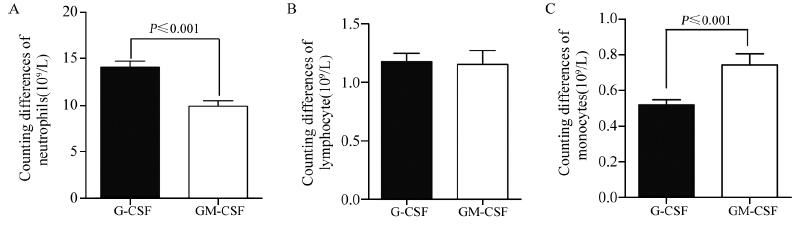
|
| 图 1 rhG-CSF与rhGM-CSF动员前后患者血象变化 Figure 1 Differences of routine blood test results before and after rhG-CSF and rhGM-CSF mobilization |
对两组患者采集终产品进行流式检测,结果显示rhGM-CSF动员组采集终产品中CD14+单核细胞的比例平均为(25.32±4.37)%,rhG-CSF动员组采集终产品中CD14+单核细胞的比例平均为(23.32±5.02)%,两者差异无统计学意义(P=0.023)。图 2为两组中各取一个患者的流式散点图。

|
| A: rhG-CSF group; B: rhGM-CSF group 图 2 流式细胞术检测两组患者采集终产物中CD14+单核细 胞的比例 Figure 2 Ratio of CD14+ monocytes in end-product collected from two groups detected by flow cytometry |
动员后rhGM-CSF组采集得到的PBMC数量显著高于rhG-CSF组(P=0.046),且培养所得终产物DC的数量也显著高于rhG-CSF组(P=0.011),见图 3。
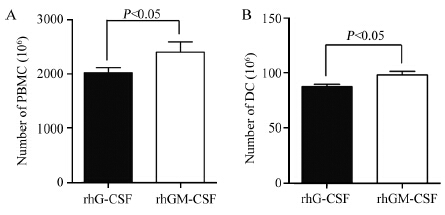
|
| 图 3 rhG-CSF与rhGM-CSF两组患者PBMC及DC的差异 Figure 3 Differences of peripheral blood mononuclear cell(PBMC) and (dendritic cell)DC between rhG-CSF group and rhGM-CSF group |
将第8天收获的两组DC进行流式细胞仪检测,检测DC的表型,结果见表 2。rhGM-CSF动员组HLA-DR的表达显著高于rhG-CSF组(P=0.001),CD80、CD83、CD86、CD11C及CD54的表达与rhG-CSF组差异无统计学意义。
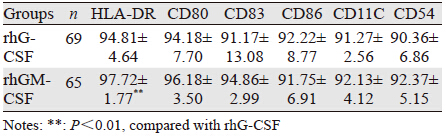 |
ELISA检测促熟48h后的细胞上清液,结果显示,rhGM-CSF组与rhG-CSF组上清液中Th1细胞因子IFN-γ和IL-12p70的表达量差异无统计学意义(P=0.312, P=0.275);Th2细胞因子IL-10的表达差异也无统计学意义(P=0.671),见图 4。

|
| 图 4 rhG-CSF动员组和rhGM-CSF动员组DC细胞因子表达 Figure 4 Cytokines expression of DC in rhG-CSF group and rhGM-CSF group |
目前,DC疫苗作为肿瘤免疫治疗的一种手段已显示出重要的临床应用价值[10],其主要通过启动患者自身特异性肿瘤免疫反应,增强机体抗肿瘤能力,特异性杀伤肿瘤细胞,避免了对机体正常细胞的损害[1, 6]。然而,DC疫苗在临床应用过程中仍存在许多问题,不同种类及不同成熟状态DC的选取,针对不同的肿瘤采用何种肿瘤抗原和DC疫苗的使用数量、接种途径和免疫频率等均需进一步探讨。人体外周血中DC数量极少,不足人外周血单个核细胞的1%[11],且肿瘤患者往往处于免疫失衡状态,因此直接利用人外周血DC制备肿瘤疫苗在临床研究中较为少见。人DC起源于造血干细胞,分为髓样DC(来源于髓样干细胞)和淋巴样DC(来源于淋巴样干细胞)。其中,淋巴样DC抗原提呈能力差,刺激T细胞增殖的能力弱,能诱导CD4+T细胞无能,因此不能用于DC疫苗的制备[12]。髓样DC的前体细胞主要包括CD34+造血前体细胞和外周血单核细胞[13]。CD34+造血前体细胞主要来源有外周血、骨髓和脐血,但要达到临床数量级别,需富集大量前体细胞,加之培养周期长(9~28天)、诱导细胞因子多、总体代价高、限制了其临床应用[8]。因此,目前大部分DC肿瘤疫苗的临床试验采用分离单核细胞来诱导DC的方法[14, 15]。
已有研究证实DC肿瘤疫苗的疗效与其数量密切相关,更大数量的DC能取得更好的疗效[6, 7]。因此,如何取得更多的单核细胞用于诱导DC在临床应用中非常重要。我们前期的研究成果显示,粒细胞集落刺激因子(G-CSF)动员能促进肿瘤患者外周血单核细胞数量增加[8],与常英军等[16]研究成果相似。GM-CSF与G-CSF同属于CSF,在造血系统的分化过程中都起着重要的,但rhGM-CSF作用的靶细胞范围更广,且在造血干细胞分化为单核细胞的过程中起着主要的作用[9]。因此,本研究探讨了在动员肿瘤患者外周血单核细胞的应用上rhGM-CSF与rhG-CSF相比谁更有优势。结果显示,动员1天后,rhGM-CSF动员组的单核细胞计数显著高于rhG-CSF组,中性粒细胞计数低于rhG-CSF组,淋巴细胞计数两组差异无统计学意义。说明rhGM-CSF更能提升肿瘤患者外周血单核细胞的数量。目前,利用血细胞分离机来分离外周血单个核细胞(peripheral blood mononuclear cell, PBMC)在临床上使用较为广泛。患者外周血单核细胞的数量增多是否意味着血细胞分离机所采集到的PBMC越多呢?本研究对患者采集前(即动员后)外周血单核细胞的数量与分离到的PBMC数量进行了相关分析,结果显示两者呈正相关,说明提升肿瘤患者外周血中单核细胞的数量能提高采集到的PBMC数量。据此,本研究比较了两组患者采集所得PBMC数量及最终诱导的DC数量,结果显示,rhGM-CSF动员组的PBMC及DC数量都显著高于rhG-CSF动员组。上述结果说明,rhGM-CSF动员比rhG-CSF更能提升DC疫苗的产量。
同时,人髓样DC成熟后高表达MHCⅠ类、Ⅱ类分子,协同刺激分子(CD80、CD86)、黏附分子(CD11c、CD54)、成熟相关分子CD83等。DC通过这些分子发挥其激活T细胞的功能。因此,本研究检测了两组DC表面分子的表达,结果显示rhGM-CSF动员组HLA-DR表达显著高于rhG-CSF组,而CD80、CD83、CD86、CD11C及CD54的表达与rhG-CSF组无差异。HLA-DR是MHC-Ⅱ类分子,是DC向T细胞提呈抗原的主要功能分子,其表达越高说明DC的提呈抗原能力越强。因此,上述结果说明rhGM-CSF动员组DC的提呈功能强于rhG-CSF组。除此之外,本研究比较了两组DC细胞Th1型和Th2型细胞因子的表达。Th1细胞参与细胞免疫调节,在抗肿瘤免疫中起重要作用,Th2细胞主要参与体液免疫调节。结果显示两组之间没有显著性差异,说明rhG-CSF动员和rhGM-CSF动员对DC的Th1/Th2漂移没有明显影响。
综上所述,相比于rhG-CSF,采用rhGM-CSF动员能培养出更多数量的DC疫苗,且培养出的DC的提呈功能更强。因此,临床上利用单核细胞来源的DC疫苗治疗肿瘤患者时,采用rhGM-CSF动员效果优于rhG-CSF。
| [1] | Steinman RM, Banchereau J.Taking dendritic cells into medicine[J]. Nature, 2007, 449(7161): 419 -26. |
| [2] | Strioga MM, Felzmann T, Powell DJ Jr, et al. Therapeutic dendritic cell-based cancer vaccines: the state of the art[J].Crit Rev Immunol, 2013, 33(6):489-547. |
| [3] | Radford KJ, Tullett KM, Lahoud MH. Dendritic cells and cancer immunotherapy[J]. Curr Opin Immunol, 2014, 27: 26-32. |
| [4] | Kantoff PW, Higano CS, Shore ND, et al. Sipuleucel-T immunotherapy for castration-resistant prostate cancer[J]. N Engl J Med, 2010, 363(5): 411-22. |
| [5] | Cools N, Petrizzo A, Smits E, et al. Dendritic cells in the pathogenesis and treatment of human diseases: a Janus Bifrons[J]. Immunotherapy, 2011, 3(10): 1203-22. |
| [6] | Harada Y, Yonemitsu Y. Dramatic improvement of DC-based immunotherapy against various malignancies[J]. Front Biosci, 2011, 16: 2233-42. |
| [7] | Oshita C, Takikawa M, Kume A, et al. Dendritic cell-based vaccination in metastatic melanoma patients: Phase Ⅱclinical trial[J]. Oncol Rep, 2012, 28(4): 1131-8. |
| [8] | Cai K, Gao YR, Ke Y, et al. Recombinant human granulocyte colony-stimulating factor mobilized human peripheral blood monocytes derived dendritic cell vaccine as a tumor immunotherapy[J]. Yi Xue Yan Jiu Sheng Xue Bao, 2012, 25(6): 616-21. [蔡凯, 高艳荣, 柯燕, 等. 重组人粒细胞集落刺激因子动员后人外周血单核细胞来源树突状细胞肿瘤疫苗治疗研究[J].医学研究生学报, 2012, 25(6): 616-21.] |
| [9] | Clark SC, Kamen R. The human hematopoietic colony stimulating factors[J].Science, 1987, 236(4806): 1229-37. |
| [10] | Hang XS, Shi Y, Li L, et al. Clinical effect of vaccination with autolougous dendritic cells against advanced non-small cell lung cancer[J]. Zhong Liu Fang Zhi Yan Jiu, 2012, 39(2): 205-9. [杭晓声, 史央, 李丽, 等.树突状细胞免疫治疗晚期非小细胞肺癌的临床观察[J]. 肿瘤防治研究, 2012, 39(2): 205-9.] |
| [11] | Kassianos AJ, Jongbloed SL, Hart DN, et al. Isolation of human blood DC subtypes[J]. Methods Mol Biol, 2010, 595: 45-54. |
| [12] | Colonna M, Trinchieri G, Liu YJ. Plasmacytoid dendritic cells in immunity[J]. Nat Immunol, 2004, 5(12): 1219-26. |
| [13] | Gottfried E, Kreutz M, Mackensen A. Tumor-induced modulation of dendritic cell function[J]. Cytokine Growth Factor Rev, 2008, 19(1): 65-77. |
| [14] | Lepisto AJ, Moser AJ, Zeh H, et al. A phase I/II study of a MUC1 peptide pulsed autologous dendritic cell vaccine as adjuvant therapy in patients with resected pancreatic and biliary tumors[J]. Cancer Ther, 2008, 6(B): 955-64. |
| [15] | Bauer C, Dauer M, Saraj S, et al. Dendritic cell-based vaccination of patients with advanced pancreatic carcinoma: results of a pilot study[J].Cancer Immunol Immunother, 2011, 60(8): 1097-107. |
| [16] | Chang YJ, Zhao XY, Huang XJ. Effects of rhG-CSF mobilization on immunological characteristics of peripheral blood grafts and steady-state bone marrow[J]. Zhongguo Shi Yong Nei Ke Za Zhi, 2007, 27(15): 1178-80. [常英军, 赵翔宇, 黄晓军. 人重组粒细胞集落刺激因子动员的外周血采集物和稳态骨髓采集物免疫学特性的对比研究[J].中国实用内科杂志, 2007, 27(15): 1178-80.] |
 2015, Vol. 42
2015, Vol. 42



