文章信息
- 郭敬杰,袁昌劲,刘礼,吕秀玮,余涛,贺文煜,陈燕浩
- GUO Jingjie, YUAN Changjing, LIU Li, LV Xiuwei, YU Tao, HE Wenyu, CHEN Yanhao
- 重组质粒pCMV AIM-1 antisense对卵巢癌裸鼠移植瘤的抑瘤效应研究
- Effect of pCMV AIM-1 antisense Constructs on Human Ovarian Cancer Xenografts Growth in Nude Mice
- 肿瘤防治研究, 2015, 42(11): 1086-1090
- Cancer Res Prev Treat, 2015, 42(11): 1086-1090
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.11.006
-
文章历史
- 收稿日期: 2015-02-11
- 修回日期: 2015-06-03
2. 430014 武汉,武汉市中心医院影像诊断科
2. Department of Diagnostic Radiology, Wuhan Central Hospital, Wuhan 430014, China
Aurora激酶家族成员之一AIM-1,又名Aurora-B是染色体的过客蛋白,它常定位于有丝分裂早期的染色体着丝粒区域,到分裂后期阶段,它则从着丝粒转移到嵌入纺锤体赤道板的微管。内着丝粒蛋白(INCENP)、Survivin和Borealin为过客蛋白, AIM-1与它们相结合,对染色体的浓缩起着非常重要的作用。 AIM-1的另一个重要的功能是调节动粒,它能够纠正染色体的排列和分裂,并具有调整纺锤体检查点的功能和胞质分裂所必需的物质[1, 2]。AIM-1在肿瘤细胞的有丝分裂过程中起着重要的作用,这使得它成为肿瘤治疗的新靶点,越来越受到大家的关注。因此本实验将AIM-1作为研究靶点,通过建立卵巢癌裸鼠移植瘤模型,探讨pCMV AIM-1 antisense重组质粒对卵巢癌裸鼠移植瘤的体内抑瘤效应。
1 材料与方法 1.1 细胞株、质粒、实验动物及试剂华中科技大学同济医学院免疫学系提供实验所用的卵巢癌亲本细胞株A2780;pCMV AIM-1 antisense质粒由意大利Federico大学Portella教授惠赠[2]。BALB/C裸小鼠购自北京维通利华实验动物技术有限公司,所有实验动物均为雌性动物,体重约为20 g,4~6周龄。所有实验动物均委托同济医学院SPF级层流动物房饲养。
AIM-1及β-actin引物由上海英骏生物有限公司合成;RT-PCR试剂盒购自美国天根生化科技(北京)有限公司;GAPDH抗体购自美国Sigma公司;鼠抗AIM-1多克隆抗体为武汉三鹰公司赠送;二抗购自美国Invitrogen公司;新生牛血清、DMEM培养液、Lipofectamine 2000均购自美国Gibco公司; 实验所用的plasmid Mini Kit D6915去内毒素试剂盒购自美国Omega公司;免疫组织化学通用型SP试剂盒购自北京中杉金桥生物有限公司。
1.2 细胞培养将卵巢癌亲本细胞株A2780接种于含10%小牛血清的DMEM培养液中,置于37°C、5% CO2培养箱中,每3~4天传代一次。
1.3 稳定转染细胞转染分三组进行:pCMV空载体组、pCMV AIM-1 antisense重组质粒组及A2780对照组。转染前24 h计数,接种于6孔板,每孔2.5×105个细胞,细胞达90%融合时转染。具体转染步骤按Lipofectamine 2000试剂说明书上操作。以400 μg/ml浓度G418进行抗性克隆筛选,以250 μg/ml浓度G418维持筛选。
1.4 接种细胞的处理当细胞生长达到约90%融合,弃培养液,PBS洗涤细胞2次,以清除死亡脱落的细胞;0.25%胰蛋白酶消化细胞,PBS重悬细胞,1 000 r/min、室温下离心3 min,弃上清液;用PBS再次充分洗涤细胞2次;离心后用PBS重悬成高浓度的单细胞悬液,约浓度为每毫升1×107个。
1.5 RT-PCR检测用TRIzol提取稳定转染的pCMV空载体组、pCMV AIM-1 antisense重组质粒组和A2780对照组细胞的总RNA,按厂家说明书进行反转录,取等体积RT产物进行PCR检测。内参β-actin上游引物序列:5’-ATCTGGACACCTTCTACAATGGCTGCG-3’, 下游引物序列:5’-CGTCATACTCCTGCTTGCTGATCCACATCTGC-3’,扩增片段为834 bp;AIM-1上游引物序列:5’-AAGGAGCTGCAGAAGAGCTG-3’,下游引物序列:5’-GGCGATAGGTCTCGTTGTGT-3’, 扩增片段为361 bp。
1.6 Western blot检测0.25%胰酶消化收集上述三组细胞,离心后PBS重悬,再次离心去上清液,加入1×SDS裂解液,入100℃水浴锅中煮5 min后,离心取上清液测蛋白浓度,取等量样本60 μg上样于12%聚丙烯酰胺凝胶电泳,再转移至硝酸纤维素膜上,膜用TBST洗5 min×3次,加入5%牛奶(TBST配置)封闭抗体,室温下摇床上振荡1 h。TBST洗5 min×3次,加入AIM-1抗体或GAPDH抗体,4℃冰箱过夜。TBST洗5 min×3次,加入二抗,室温下摇床上振荡90 min。TBST洗5 min×3次,加ECL试剂,X线胶片曝光,洗片。
1.7 肿瘤模型的制备、肿瘤抑制生长的观察将符合条件的24只BALB/C裸小鼠,随机分成3组,每组8只即A2780对照组、pCMV空载体组和pCMV AIM-1 antisense重组质粒组。于每只裸鼠近后肢背部皮下分别缓慢注射每毫升1×107个A2780或A2780-pCMV空载体或A2780-pCMV AIM-1 antisense细胞,10~15天后可发现裸鼠皮下组织内开始出现肿瘤结节,仔细观察成瘤的情况,将皮下结节直径达约0.5 cm作为成瘤的标准。注射后每天观察各实验组肿瘤生长情况,用游标卡尺测量肿瘤体积。注射45天后用脱颈椎法处死实验用鼠,取得肿瘤,称重;测量肿瘤的重量以及肿瘤的最大直径(L)和最小直径(W),按下列公式计算体积:V(mm3)=L×W2/2。计算抑瘤率,按公式:抑瘤率(%)=(对照组平均瘤体积-重组质粒组平均瘤体积)/对照组平均瘤体积×100%。
1.8 裸鼠移植瘤石蜡切片免疫组织化学染色取石蜡块,每例均制成厚约4 µm的连续切片。切片常规脱蜡水化。 0.3%H2O2去除内源性过氧化物酶,微波抗原修复,10%正常羊血清封闭,依次加入抗体,DAB显色,细胞核内光学显微镜下见棕黄色颗粒为阳性细胞。结果判断参考Qi[3]的判断标准,显微镜下随机选10个高倍视野,逐个视野观察,每个视野计数100个细胞,计数每个视野下细胞核为阳性的细胞数目,根据阳性细胞数计算出阳性率和阳性标记指数(positive labeling index, PLI)。
1.9 统计学方法采用SPSS18.0统计软件进行统计学处理,计量资料以(x±s)表示,组间均数的比较采用F检验;计数资料以百分率表示,组间率的比较采用χ2检验。以P<0.05为差异有统计学意义。
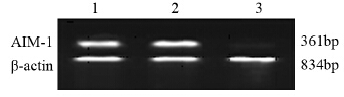
2 结果 2.1 RT-PCR检测三组细胞AIM-1 mRNA的表达通过RT-PCR检测三组细胞AIM-1 mRNA显示:A2780 pCMV AIM-1 antisense重组质粒组AIM-1 mRNA的表达基本完全抑制,而A2780 pCMV空载体组和的未转染组AIM-1 mRNA表达无明显改变,见图 1。
图 1 食管鳞状细胞癌患者Kaplan-meier生存曲线
|
| 1: A2780 control group; 2: A2780-pCMV empty plasmids group; 3: A2780-pCMV AIM-1 antisense group 图 1 A2780裸鼠移植瘤对照组、空载体组和重组质粒组细 胞AIM-1 mRNA的表达 Figure 1 mRNA expression levels of AIM-1 in A2780control, A2780-pCMV empty plasmids and A2780-pCMVAIM-1 antisense groups |
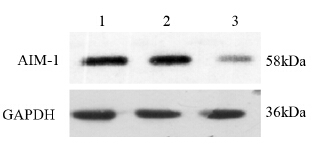
通过Western blot检测三组细胞AIM-1蛋白显示:A2780 pCMV AIM-1 antisense重组质粒组AIM-1蛋白的表达明显减少,而A2780 pCMV空载体组和未转染组AIM-1蛋白表达无明显改变,见图 2。
|
| 1:A2780 control group; 2: A2780-pCMV empty plasmids group;3: A2780-pCMV AIM-1 antisense groups 图 2 A2780裸鼠移植瘤对照组、空载体组和重组质粒组细 胞AIM-1蛋白的表达 Figure 2 Protein expression level of AIM-1 in A2780control, A2780-pCMV empty plasmids and A2780-pCMVAIM-1 antisense groups |
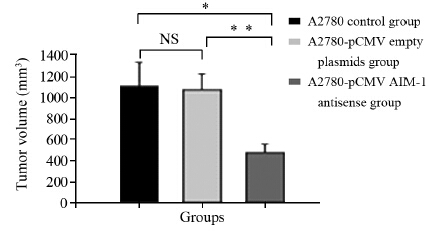
在细胞种植的第10~15天后,可以观察及触摸到裸鼠皮下组织内的肿瘤,每天准确检测肿瘤体积,并做好记录,在45天后,准确测量出肿瘤的体积,并依据公式计算出各肿瘤的体积,进而计算出抑瘤率,结果显示:A2780对照组、A2780转染pCMV空载体组和A2780转染pCMV AIM-1 antisense重组质粒组的裸鼠肿瘤重量分别为(1.93±0.21)g、(1.90±0.39)g和(0.77±0.34)g;移植瘤体积分别为(1 011.7±235.6)mm3、(981.2±162.3)mm3和(468.7±119.6)mm3,重组质粒组与空载体组和对照组相比,差异有统计学意义(P=0.000和P=0.000);pCMV AIM-1 antisense重组质粒的抑瘤率可达53.8%,见图 3、4。

|
| The tumor weight in A2780 control, A2780-pCMV empty plasmids and A2780-pCMV AIM-1 antisense groups were (1.93±0.21), (1.90 ±0.39) and (0.77±0.34)g, respectively; *: P and **: P<0.01; NS: no significance 图 3 A2780裸鼠移植瘤对照组、空载体组和重组质粒组重 量比较 Figure 3 Comparison of tumor weight between A2780 control, A2780-pCMV empty plasmids and A2780-pCMV AIM-1 antisense groups |
|
| The tumor volume in A2780 control, A2780-pCMV empty plasmids and A2780-pCMV AIM-1 antisense groups were (1011.7±235.6), (981.2 ±162.3) and (468.7±119.6)mm3, respectively. *: P and **: P <0.01; NS: no significance 图 4 A2780裸鼠移植瘤对照组、空载体组和重组质粒组体 积比较 Figure 4 Comparison of tumor volume between A2780 control, A2780-pCMV empty plasmids and pCMV AIM-1 antisense groups |
免疫组织化学结果显示A2780裸鼠移植瘤瘤组织中AIM-1蛋白主要在胞核表达,阳性表达表现为黄褐色颗粒。pCMV AIM-1 antisense重组质粒组AIM-1阳性细胞表达率和表达强度较对照组和空载体组明显减弱,见表 1。
 |
AIM-1是Aurora激酶家族的新进成员,是一种与细胞有丝分裂有关的丝氨酸/苏氨酸磷酸化激酶,与许多肿瘤的发生,发展有密切关系。AIM-1是染色体过客蛋白之一,研究表明,AIM-1在染色体的浓缩和分离中起着重要作用[4],过度表达AIM-1将发生多核化并产生异倍体细胞,在肿瘤的发生发展过程中起重要作用。另外两个被发现的染色体过客蛋白分别是存活素(Survivin)和着丝粒中心蛋白(INCENP)。Survivin参与调控细胞周期、促进细胞分裂、血管形成,与程序性死亡有关,在Survivin的协助下,AIM-1的磷酸化作用相比AIM-1单独存在时增强十倍[5, 6]。INCENP与姐妹染色体分离和胞质分裂有关。由AIM-1、Survivin和INCENP形成的复合体称为染色体过客蛋白复合体[7],参与调控有丝分裂的重要过程[8, 9, 10]。大量研究表明,三者同步高表达于人类的某些肿瘤细胞中[10],这提示AIM-1、Survivin和INCENP可能参与了肿瘤的发生、发展和演变。
因AIM-1在肿瘤发生进程中的重要作用,目前国内外很多学者把AIM-1作为一个抗肿瘤作用的靶点。通过抑制AIM-1的表达和活性,阻止灾难性有丝分裂的发生,使这些细胞退出有丝分裂,形成基因组不稳定的四倍体,从而抑制肿瘤的发生和发展。
RNAi是新近发展起来的一种较新的基因治疗手段,与常用的反义RNA技术等其他基因方法相比,具有经济、高度特异性、操作简便、快速等优点,该技术为分子肿瘤学的基础和临床研究开辟了新思路,而人体肿瘤/裸小鼠系统是研究人体肿瘤的一种较为理想的模型系统。两者结合,可能对寻找有效的恶性肿瘤分子治疗靶点起重要作用。
研究证实,siRNA或其前体shRNA,均可通过RNAi机制来沉默目的基因表达。研究表明,将针对H-rasV(12)突变基因设计的siRNA通过反转录病毒载体转染至人卵巢癌上皮细胞系中发现,经过siRNA转染后可以阻断癌细胞的转化,而且,当转染siRNA的细胞株接种于裸鼠,建造人卵巢癌裸鼠模型,发现裸鼠体内移植瘤的体积缩小,重量减轻[4]。Yin和Liu[6, 11]等发现体外转染bcl-2、cdk-2、mdm-2、pkc-alpha、tgf-beta1、H-ras、VEGF和GFP mRNAs的siRNA对人肿瘤细胞有明显的生长抑制作用,其生长抑制作用呈剂量依赖性和时间依赖性。它们通过对细胞周期调控分子的干扰,引起肿瘤细胞周期阻断、诱导细胞凋亡。进一步研究显示,转染后的anti-Mdm2-siRNA明显抑制人乳腺癌MCF-7细胞的生长。anti-Mdm2-siRNA能显著抑制Mdm2的表达,同时提高p53的蛋白水平,使细胞阻断在G1期,并引起核染色体浓缩和DNA断裂,导致细胞凋亡。体内研究结果显示,anti-Mdm2-siRNA可以降低人乳腺癌裸鼠Mdm2的表达,抑制MCF-7细胞的生长,并增加抗肿瘤药物对肿瘤的生长抑制作用。RNAi在转录后水平沉默目的基因,具有高效及高度基因特异性, 其在病毒感染、肿瘤以及基因疾病的治疗方面研究已经初步开展[12, 13]。
与细胞周期调控有关的基因都可以作为设计RNAi的靶分子。本实验选择与肿瘤增殖、生长密切相关的有丝分裂期的关键调节因子—Aurora家族成员之一的AIM-1作为研究靶点。近年有研究[5, 6]显示,AIM-1高表达于卵巢癌细胞株中,不仅如此,通过RNAi基因沉默技术抑制A2780细胞的AIM-1的表达后发现,处于G2/M期细胞在总的细胞中比例明显增加,多倍体增多,随后凋亡细胞增多,肿瘤细胞增殖受阻,肿瘤得以控制;而在RNAi技术抑制AIM-1表达后,再用紫杉醇处理卵巢癌细胞,发现卵巢癌细胞对紫杉醇的化疗敏感度增高,说明AIM-1表达降低可以协同化疗药对肿瘤的抑制作用。本文通过RT-PCR和Western blot对稳定转染pCMV 空载体和 pCMV AIM-1 antisence重组质粒的A2780细胞和未转染A2780细胞进行AIM-1 mRNA和蛋白表达的检测,结果显示,A2780 pCMV AIM-1 antisense重组质粒组AIM-1 mRNA和蛋白的表达明显减少,而A2780 pCMV空载体组和未转染组AIM-1 mRNA和蛋白表达无明显改变。
本文进一步通过卵巢癌裸鼠移植瘤模型显示pCMV AIM-1 antisense重组质粒对A2780裸鼠移植瘤生长有明显的抑制作用。
| [1] | Hégarat N, Smith E, Nayak G, et al. Aurora A and Aurora B jointly coordinate chromosome segregation and anaphase microtubule dynamics[J]. J Cell Biol, 2011, 195(7): 1103-13. |
| [2] | Wu Q, Zhang W, Mu T, et al. Aurora B kinase is required for cytokinesis through effecting spindle structure[J]. Cell Biol Int, 2013, 37(5): 436-42. |
| [3] | Qi G, Ogawa I, Kudo Y, et al. Aurora-B expression and its correlation with cell proliferation and metastasis in oral cancer[J].Virchows Arch, 2007, 450(3): 297-302. |
| [4] | Sabino D, Brown NH, Basto R. Drosophila Ajuba is not an Aurora-A activator but is required to maintain Aurora-A at the centrosome[J]. J Cell Sci, 2011, 124(Pt 7): 1156-66. |
| [5] | Baratchi S, Kanwar RK, Kanwar JR. Survivin: a target from brain cancer to neurodegenerative disease[J]. Crit Rev Biochem Mol Biol, 2010, 45(6): 535-54. |
| [6] | Yin JQ, Gao J, Shao R, et al. siRNA agents inhibit oncogene expression and attenuate human tumor cell growth[J]. J Exp Ther Oncol, 2003, 3(4): 194-204. |
| [7] | Kollareddy M, Zheleva D, Dzubak P, et al. Aurora kinase inhibitors: progress towards the clinic[J]. Invest New Drugs, 2012, 30(6): 2411-32. |
| [8] | Collette KS, Petty EL, Golenberg N, et al. Different roles for Aurora B in condensin targeting during mitosis and meiosis[J]. J Cell Sci, 2011, 124(Pt 21): 3684-94. |
| [9] | Adams RR, Maiato H, Earnshaw WC, et al. Essential roles of Drosophila inner centromere protein (INCENP) and aurora B in histone H3 phosphorylation, metaphase chromosome alignment, kinetochore disjunction, and chromosome segregation[J]. J Cell Biol, 2001, 153(4): 865-80. |
| [10] | Snoek R, Cheng H, Margiotti K, et al. In vivo knockdown of the androgen receptor results in growth inhibition and regression of well-established, castration-resistant prostate tumors[J]. Clin Cancer Res, 2009, 15(1): 39-47. |
| [11] | Liu TG, Yin JQ, Shang BY, et al. Silencing of hdm2 oncogene by siRNA inhibits p53-dependent human breast cancer[J]. Cancer Gene Ther, 2004, 11(11): 748-56. |
| [12] | Terakawa T, Miyake H, Kumano M, et al. Growth inhibition and enhanced chemosensitivity induced by down-regulation of Aurora-A in human renal cell carcinoma Caki-2 cells using short hairpin RNA[J]. Oncol Lett, 2011, 2(4): 713-7. |
| [13] | Shen YM, Yang XC, Song ML, et al. Growth inhibition induced by short hairpin RNA to silence survivin gene in human pancreatic cancer cells[J]. Hepatobiliary Pancreat Dis Int, 2010, 9(1): 69-77. |
 2015, Vol. 42
2015, Vol. 42


