文章信息
- 周亭芳,邱波,唐晶,张淑芳,谭丽梅,欧阳威.
- ZHOU Tingfang, QIU Bo, TANG Jing, ZHANG Shufang, TAN Limei, OUYANG Wei.
- 双泛素蛋白诱导自噬对肝癌细胞放射
- FAT10-induced Autophagy Regulates Radiosensitivity of Hepatocellular Carcinoma Cells
- 肿瘤防治研究, 2015, 42(11): 1081-1085
- Cancer Research on Prevention and Treatment, 2015, 42(11): 1081-1085
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.11.005
-
文章历史
- 收稿日期: 2014-12-09
- 修回日期: 2015-05-05
目前早期肝癌仍然以外科手术切除或肝移植为最佳选择,但因大多数患者就诊时已是中晚期而丧失了手术机会[1]。对于局部晚期肝癌,放射治疗目前仍然是一种有效的治疗手段[2]。越来越多的研究表明肝癌属放射敏感肿瘤[3, 4, 5],然而由于肿瘤组织的异质性及肝脏和周围重要器官放射剂量的限制性,部分肝癌患者表现为放射抵抗[6]。如何寻找及识别影响肝癌患者放射敏感度的因素,进而制定个体化的治疗方案成为我们下一步重要的研究内容。
近年来,自噬在肿瘤治疗中的作用越来越突出。研究发现,射线除了可诱发细胞凋亡外,还能引发细胞自噬,这种电离辐射诱发的自噬能减轻细胞的电离辐射损伤,促进细胞存活。这些结果表明,自噬可能是导致肿瘤细胞放射抗拒的关键因素之一[7]。
FAT10也称为双泛素蛋白,研究表明FAT10在肝癌细胞及组织中高表达,且高表达FAT10促进肝癌细胞的增殖、侵袭及抑制细胞的凋亡,最终导致肝癌的恶性进展[8]。然而FAT10是否参与肝癌细胞的自噬调节过程目前还未见相关报道,本文旨在初步探讨FAT10是否通过调节肝癌细胞的自噬水平进而影响肝癌细胞的放射敏感度。
1 材料与方法 1.1 材料人肝癌细胞株HepG2、Huh7由南方医科大学南方医院放疗科赠送。LipofectamineRNAiMAX、Opti-MEM购自美国Invitrogen公司。慢病毒载体pENTR221购自广州复能基因公司。Beclin1干扰siRNA购自上海吉玛基因有限公司。FAT10 多克隆抗兔抗体购自美国Proteintech公司;Beclin1、LC3-Ⅰ/Ⅱ及p62单克隆抗鼠抗体购自美国Abcom公司;β-actin单克隆抗鼠抗体购自美国Sigma公司。
收集2010年—2012年在株洲市中心医院住院期间行经皮肝内肿块穿刺活检的35例肝细胞癌标本,其中男29例、女6例;年龄42~68岁(平均55岁);2010AJCC/UICC TNM分期Ⅰ~Ⅱ期18例,Ⅲ~Ⅳ期17例。全部研究对象术前均未接受放化疗。
1.2 方法 1.2.1 细胞培养人肝癌细胞株HepG2、Huh7采用含10%胎牛血清DMEM培养液置于37℃、5% CO2培养箱内培养,倒置显微镜下观察细胞生长情况,每3~4 d用含EDTA的胰酶消化、传代培养,取生长状态良好的细胞用于实验。
1.2.2 构建FAT10稳定表达细胞构建包含FAT10基因慢病毒载体pENTR221(GeneCopoeia, USA)将其命名为LV-FAT10,将空载对照病毒命名为NC。将LV-FAT10及空载病毒分别感染HepG2细胞从而构建稳定表达FAT10的细胞,通过Western blot检测明确细胞内FAT10表达的稳定性。
1.2.3 siRNA转染采用Lipofectamine RNAiMAX进行siRNA干扰,HuH7细胞进行FAT10 特异性siRNA及阴性对照(scramble)干扰;HepG2细胞进行Beclin 1特异性siRNA及阴性对照(scramble)干扰。转染后通过Western blot技术测定转染后FAT10及Beclin1蛋白表达以确定干扰效果。
1.2.4 Western blot检测蛋白表达取等量30 μg蛋白行12%SDS-PAGE凝胶电泳分离蛋白质,其后转移至PVDF膜上,再以含5%脱脂奶粉TBST缓冲液室温封闭1 h,加入一抗工作液并置4℃过夜;TBST缓冲液漂洗3次,每次5 min,加入二抗室温孵育1 h,再用TBST漂洗3次,每次10 min,ECL显影发光,β-actin为内对照。
1.2.5 免疫组织化学检测肝癌组织中相关蛋白表达按照DAKO EnVisionTM说明书操作。石蜡切片常规脱腊水化,微波修复,3%H2O2室温孵育10 min,PBS冲洗,加入FAT10或Beclin1抗体,4℃孵育过夜,PBS冲洗,加入酶标抗鼠/兔聚合物(二抗),室温孵育1 h,PBS冲洗后,DAB显色,苏木精对比染色,0.1%盐酸分化,PBS返蓝,常规脱水透明,中性树脂封固。PBS液取代一抗作阴性对照。
免疫组织化学结果判断方法如下:染色强度分数标准:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。同样物镜下计数阳性细胞数,1%~25%为1分,>25%~50%为2分,>50%~75%为3分,>75%为4分。两项得分相加,满3分为“+”;4分为“++”;5分以上为“+++”,其中“++~+++”为阳性表达。
1.2.6 克隆形成实验检测细胞放射敏感度将过表达FAT10细胞株HepG2与干扰细胞株Huh7分别与对照组细胞按不同稀释比例接种至六孔板中,每组设3个复孔,细胞贴壁过夜,给予不同剂量X射线(0、2、4、6、8、10 Gy)照射。处理后的细胞继续培养10~14 d,肉眼可见细胞团形成后终止培养,甲醇固定,结晶紫染色,肉眼或显微镜下(>50个细胞)计数克隆数。应用GraphPad prism 5.0软件进行线性二次模型及多靶单击模型拟合生存曲线,求出α、β、SF2(< span class="x----" xml:lang="en-US">survival fraction values at two gray)及D0、Dq、N值并求得放射增敏比值(sensitization enhancement ratio, SER)。
1.3 统计学方法采用SPSS 16.0对各组实验数据进行t检验。肝癌组织中FAT10与Beclin1进行Spearman相关分析。所有数值用平均值±标准差表示。P<0.05为差异有统计学意义。
2 结果 2.1 FAT10调节X射线诱导下的肝癌细胞自噬形成Western blot结果显示在未经照射的肝癌细胞HepG2中,FAT10过表达可促进自噬相关蛋白Beclin1及LC3Ⅰ/Ⅱ的表达,同时降低p62表达。当接受6 Gy X射线照射后FAT10过表达细胞与对照组细胞中上述三种自噬相关蛋白表达差异更加明显。此外,通过对Huh7细胞中FAT10进行siRNA干扰后,同样发现敲除了FAT10后的细胞经过X射线照射后自噬相关蛋白表达量也发生了显著的改变,见图 1。
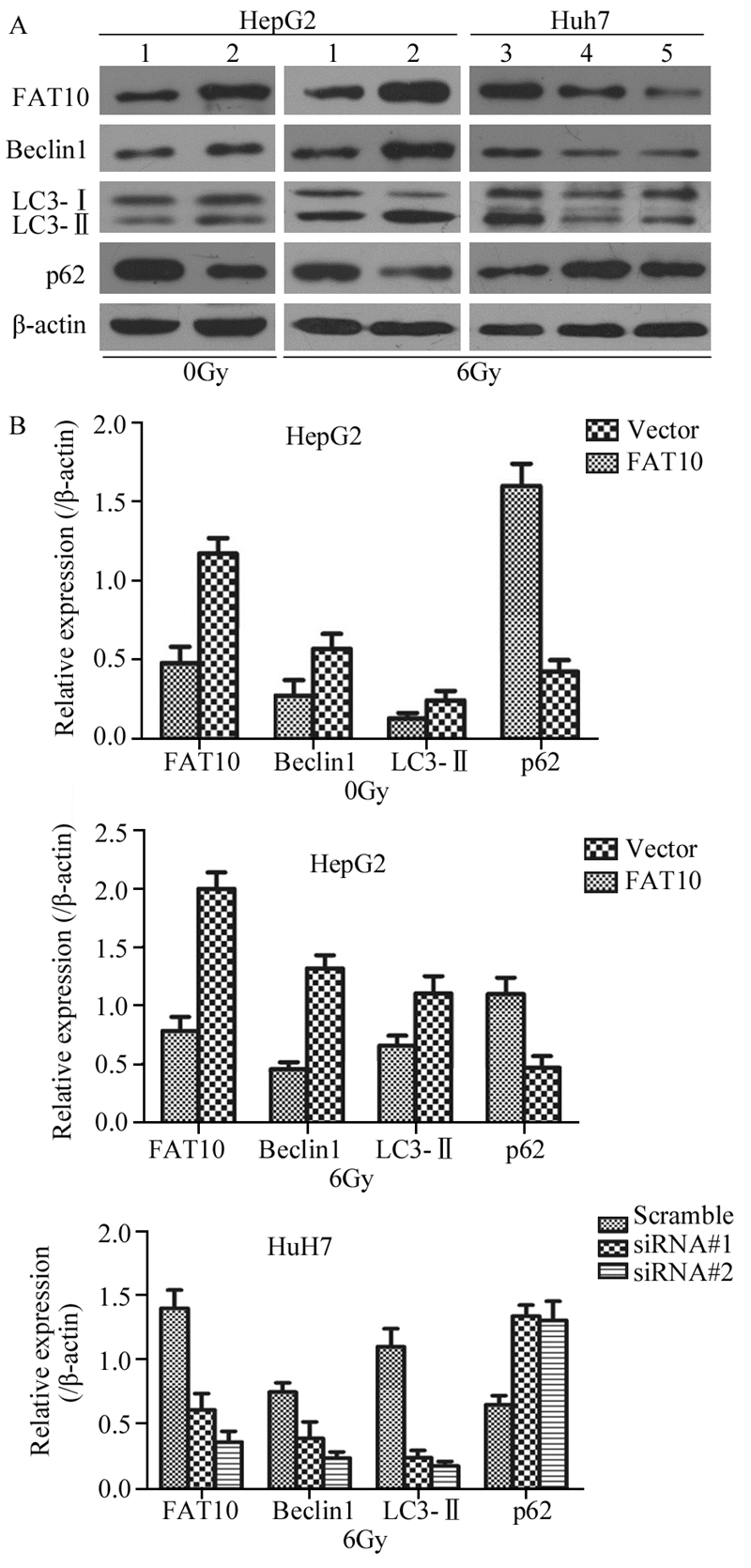
|
| 1: vector; 2: LV-FAT10; 3: scramble; 4: siRNA#1; 5: siRNA#2; A: expression of FAT10 and autophagy-related proteins in HepG2 and Huh7 cells under different conditions detected by Western blot; B: graphic representation of relative protein expression normalized to β-actin; siRNA#1, siRNA#2: small interference RNA (siRNA) sequence 1 and 2 of FAT10; scramble: negative control interference RNA sequence 图 1 双泛素蛋白FAT10调节自噬相关蛋白的表达 Figure 1 Expression of autophagy-related proteins regulated by FAT10 |
通过对35例肝癌患者临床标本进行免疫组织化学检测,结果表明FAT10表达阳性率为62.9%(22/35),Beclin1表达阳性率为45.7%(16/35),见图 2A。通过对同一患者标本进一步分析,观察到有12例患者同时表达FAT10与Beclin1蛋白阳性,有10例患者则表现为FAT10与Beclin1同时表达阴性,见图 2B。Pearson相关性分析表明两者相关系数为0.524(P=0.000),进一步支持肝癌组织中高表达的FAT10与Beclin1具有显著相关性。

|
| A: FAT10 and Beclin1 expression were both negative and positive in the same HCC patient’s specimens detected by IHC staining; B: positive rates of FAT10 and Beclin1 expression in 35 HCC specimens 图 2 免疫组织化学检测FAT10与Beclin1在肝癌标本中的表达 Figure 2 Expression of FAT10 and Beclin1 in 35 HCC specimens detected by IHC |
克隆形成试验结果表明FAT10过表达肝癌细胞HepG2与对照组相比,前者的细胞存活率更高,SER值为1.25,见表 1、图 3A。同样,对Huh7细胞进行FAT10干扰后,与对照组相比,后者的细胞存活率更高,SER值为0.69,见图 3B。以上结果表明FAT10过表达可增加肝癌细胞的放射抵抗性。
 |

|
| A: clonogenic survival curves of HepG2/LV-FAT10 and HepG2/NC; B: clonogenic survival curves of Hun7/FAT10-siRNA and Huh7/scramble; C: clonogenic survival curves of HepG2/LV-FAT10 and HepG2/NC treated with 3-MA (10 mM) for 24h; D: clonogenic survival curves of HepG2/LV-FAT10 and HepG2/NC after knockdown of Beclin1 and scramble-siRNA 图 3 不同分组条件下细胞克隆存活曲线分析 Figure 3 Survival curves of cell clone under different conditions |
为了明确FAT10是否通过诱导自噬干预肝癌细胞的放射敏感度,本研究将FAT10过表达HepG2细胞及对照组细胞同时进行自噬抑制剂3-MA处理,通过克隆形成试验发现两组细胞在接受不同剂量放射治疗后的细胞存活率没有明显差异,见图 3C。进一步通过干扰Beclin1以阻断自噬形成来观察不同组细胞放射敏感度的变化。克隆形成试验结果表明同时敲除Beclin1后,FAT10过表达组与对照组相比两组细胞克隆存活率没有明显差异。而对于转染非特异的siRNA(scramble)后,FAT10过表达组细胞的克隆存活率明显高于对照组。而在FAT10过表达的细胞中,对比干扰Beclin1与非特异siRNA干扰组,前者克隆存活率明显低于后者,见表 2、图 3D。以上结果进一步明确了FAT10可通过诱导自噬形成增强肝癌细胞的放射抵抗性。
 |
近年来Aichem等[9]发现FAT10在细胞中可以与自噬相关蛋白SQSTM1/p62发生细胞内共定位,并且促进p62泛素化最终促进其被蛋白酶体降解。p62是一种多功能的泛素化结合的折叠蛋白,其在自噬调控、蛋白酶体通路、NF-κB等信号通路中起着重要的作用。自噬抑制导致p62过度表达,并可通过调节NF-κB信号通路、ROS积聚及DNA损伤促进肿瘤细胞增殖[10]。本研究发现FAT10可以抑制p62及促进Beclin1和LC3-Ⅰ/Ⅱ等自噬相关蛋白的表达最终诱导自噬水平增加。这一结果也进一步支持了FAT10 可能是通过调节p62的泛素化从而参与自噬的调节作用,然而相关的分子机制还需要进一步的研究。
FAT10属于泛素样调节子(UBL)蛋白家族,UBL蛋白家族通过与其他蛋白质共价结合而行使泛素样修饰作用,并最终导致蛋白质降解。泛素调节的蛋白质降解过程与细胞的自噬现象都是细胞自我调节的基本机制。其中,泛素可能作为一种普遍的识别信号参与了自噬过程;而自噬的诱导又能促进泛素化作用,从而增强对底物的降解[11]。研究人员发现具有肿瘤抑制活性的泛素连接酶HACE1能够与细胞自噬受体蛋白OPTN直接相互作用,并催化OPTN的多泛素化,泛素化后的OPTN被p62的泛素结合结构域识别,并形成大的自噬受体蛋白复合物,显著增加细胞内自噬途径降解蛋白质的通量,从而“激活”细胞自噬,揭示了细胞内泛素化信号系统调节细胞选择性自噬的一种新的模式[12]。上述观点也进一步从理论上支持了双泛素蛋白FAT10参与自噬过程。
既往研究表明肿瘤细胞接受射线照射后,凋亡是细胞的主要死亡形式。通过干预凋亡过程,可以有效改变细胞的放射敏感度[13]。近年研究发现,射线除了可诱发细胞凋亡外,还能引发细胞自噬,这种电离辐射诱发的自噬能减轻细胞的电离辐射损伤,促进细胞存活,其机制可能是自噬可清除电离辐射时受损的大分子或细胞器(如线粒体),从而逃避凋亡而存活下来[14]。Chen等[15]发现抑制细胞自噬可增加食管癌的放射敏感度,同时肿瘤细胞发生凋亡的比例也增加。这些结果表明,自噬可能是导致肿瘤细胞放射抵抗的关键因素。然而,自噬对肿瘤细胞放射敏感度的影响不尽相同,在乳腺癌、胰腺癌、胶质瘤中,自噬水平的增高可提高肿瘤细胞的放射敏感度[16, 17, 18]。Apel等[19]发现自噬水平的增加对于放射敏感程度不同的肿瘤细胞而言具有截然相反的作用:自噬导致放射敏感肿瘤细胞辐射抗拒,而提高放射抗拒肿瘤细胞的放射敏感度。因此,自噬对肿瘤细胞放射敏感度的影响可能取决于肿瘤细胞类型及生物环境。本研究发现FAT10诱导肝癌细胞自噬水平从而提高肝癌细胞的放射抵抗性。而放射抵抗作用在自噬抑制剂3-MA及对Beclin1进行干扰后被显著逆转。NTCP模型证明肝癌α/β值大于10 Gy,致死剂量约60 Gy/6周,其本身属于放疗敏感类肿瘤。本研究与Apel等[19]的研究具有一致性,自噬可诱导放射敏感度肿瘤对射线的抵抗作用。
综上所述,FAT10过表达不仅可以促进肝癌细胞的增殖、侵袭及抑制肝癌细胞的凋亡,同时还可以提高肝癌细胞自噬水平,从而增强肝癌的放射抵抗性。这一结果也可以从侧面解释临床工作中部分肝癌患者对放疗表现出抗拒性的原因,从而为筛选肝癌放疗敏感型患者及靶定相关基因研究分子靶向治疗提供了理论基础。
| [1] | Poon RT. Prevention of recurrence after resection of hepatocellular carcinoma: a daunting challenge[J]. Hepatology, 2011, 54(3): 757-9. |
| [2] | Sugiyama S, Beppu T, Ishiko T, et al. Efficacy of radiotherapy for PV and IVC tumor thrombosis in unresectable HCC[J]. Hepatogastroenterology, 2007, 54(78): 1779-82. |
| [3] | Hennequin C, Quero L, Rivera S. Radiosensitivity of hepatocellular carcinoma[J]. Cancer Radiother, 2011, 15(1): 39-42. |
| [4] | Seong J, Lee IJ, Shim SJ, et al. A multicenter retrospective cohort study of practice patterns and clinical outcome on radiotherapy for hepatocellular carcinoma in Korea[J]. Liver Int, 2009, 29(2): 147-52. |
| [5] | Yamashita H, Onishi H, Murakami N, et al. Survival outcomes after stereotactic body radiotherapy for 79 Japanese patients with hepatocellular carcinoma[J]. J Radiat Res, 2015, 56(3): 561-7. |
| [6] | Wigg AJ, Palumbo K, Wigg DR. Radiotherapy for hepatocellular carcinoma: systematic review of radiobiology and modeling projections indicate reconsideration of its use[J]. J Gastroenterol Hepatol, 2010, 25(4): 664-71. |
| [7] | Chang L, Graham PH, Hao J, et al. PI3K/Akt/mTOR pathway inhibitors enhance radiosensitivity in radioresistant prostate cancer cells through inducing apoptosis, reducing autophagy, suppressing NHEJ and HR repair pathways[J]. Cell Death Dis, 2014, 5: e1437. |
| [8] | Liu L, Dong Z, Liang J, et al. As an independent prognostic factor, FAT10 promotes hepatitis B virus-related hepatocellular carcinoma progression via Akt/GSK3beta pathway[J]. Oncogene, 2014, 33(7): 909-20. |
| [9] | Aichem A, Kalveram B, Spinnenhirn V, et al. The proteomic analysis of endogenous FAT10 substrates identifies p62/SQSTM1 as a substrate of FAT10ylation[J]. J Cell Sci, 2012, 125(Pt 19): 4576-85. |
| [10] | Moscat J, Diaz-Meco MT. p62 at the crossroads of autophagy, apoptosis, and cancer[J]. Cell, 2009, 137(6): 1001-4. |
| [11] | Seiliez I, Dias K, Cleveland BM. Contribution of the autophagy-lysosomal and ubiquitin-proteasomal proteolytic systems to total proteolysis in rainbow trout (Oncorhynchus mykiss) myotubes[J]. Am J Physiol Regul Integr Comp Physiol, 2014, 307(11): R1330-7. |
| [12] | Liu Z, Chen P, Gao H, et al. Ubiquitylation of autophagy receptor Optineurin by HACE1 activates selective autophagy for tumor suppression[J]. Cancer Cell, 2014, 26(1): 106-20. |
| [13] | Akimov AA, Ivanov SD, Khanson KP. Apoptosis and radiotherapy in malignancies[J]. Vopr Onkol, 2003, 49(3): 261-9. |
| [14] | Paglin S, Hollister T, Delohery T, et al. A novel response of cancer cells to radiation involves autophagy and formation of acidic vesicles[J]. Cancer Res, 2001, 61(2): 439-44. |
| [15] | Chen YS, Song HX, Lu Y, et al. Autophagy inhibition contributes to radiation sensitization of esophageal squamous carcinoma cells[J]. Dis Esophagus, 2011, 24(6): 437-43. |
| [16] | Mukubou H, Tsujimura T, Sasaki R, et al. The role of autophagy in the treatment of pancreatic cancer with gemcitabine and ionizing radiation[J]. Int J Oncol, 2010, 37(4): 821-8. |
| [17] | Karantza-Wadsworth V, White E. Role of autophagy in breast cancer[J]. Autophagy, 2007, 3(6): 610-3. |
| [18] | Ito H, Daido S, Kanzawa T, et al. Radiation-induced autophagy is associated with LC3 and its inhibition sensitizes malignant glioma cells[J]. Int J Oncol, 2005, 26(5): 1401-10. |
| [19] | Apel A, Herr I, Schwarz H, et al. Blocked autophagy sensitizes resistant carcinoma cells to radiation therapy[J]. Cancer Res, 2008, 68(5): 1485-94. |
 2015, Vol. 42
2015, Vol. 42
