文章信息
- 袁明亮,高志星,任盼盼,郭爱,季万胜.
- YUAN Mingliang, GAO Zhixing, REN Panpan, GUO Ai, JI Wansheng.
- p53β异构体在rmhTNF联合顺铂抑制胃癌细胞增殖中的作用
- Role of p53β Isoform in Inhibitory Effect of rmhTNF Combined with Cisplatin on Human Gastric Cancer Cell Growth
- 肿瘤防治研究, 2015, 42(11): 1075-1080
- Cancer Research on Prevention and Treatment, 2015, 42(11): 1075-1080
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.11.004
-
文章历史
- 收稿日期: 2014-12-26
- 修回日期: 2015-02-06
2. 261000 潍坊,潍坊医学院附属医院消化内科
2.Department of Gastroenterology, The Affiliated Hospital of Weifang Medical University,Weifang 261000, China
全世界每年大约有90万人被诊断为胃癌,约70万人死于胃癌,其中70%来自于发展中国家[1, 2]。手术、放疗以及化疗仍然是现今主要的治疗方法[3]。然而化疗的结果不太令人满意,其原因与胃癌细胞多重耐药有关[4, 5]。p53β是抑癌基因p53选择性表达的异构体之一,细胞中p53β的过表达将抑制其生长同时增加肿瘤细胞对化疗的敏感度[6, 7]。相关研究显示TNF-α联合化疗药有协同抑制肿瘤细胞的作用[8],然而其确切的作用机制仍不清楚。本研究将rmhTNF、顺铂单独或联合作用于人胃癌细胞MKN45和SGC7901,观察其对胃癌细胞的抑制率以及细胞中p53β和bcl-2的表达变化情况,分析p53β与bcl-2的相关性,探讨p53β在rmhTNF联合顺铂抑制肿瘤细胞中的作用。
1 材料与方法 1.1 材料与试剂胃癌细胞株MKN45和SGC7901由第四军医大学馈赠。顺铂购自德州德药制药有限公司(批号131003)。注射用重组改构人肿瘤坏死因子(rmhTNF)购自上海唯科生物制药有限公司(批号20130401)。CCK-8购自日本同仁化学研究所(货号CK04)。RPMI1640培养液及胰蛋白酶购自济南凯晨生物技术有限公司,胎牛血清为浙江天杭生物科技有限公司产品。TRIzol试剂、M-MULV第一链cDNA合成试剂盒及PCR引物购自上海生工生物技术有限公司。PCR扩增试剂(Premix Taq)来自大连宝生物公司。琼脂糖(Regular AGAROSE G-10)来自香港基因有限公司(批号111860)。
1.2 实验方法 1.2.1 细胞培养人胃癌细胞培养于含有10%胎牛血清、青链霉素各100 u/ml的RPMI1640培养液中,置于5% CO2、37℃饱和湿度的培养箱中。每48 h更换一次新鲜培养液并在倒置显微镜下观察细胞生长状况。48~72 h用0.25%的胰蛋白酶消化传代细胞1次,取对数生长期的细胞用于实验。
1.2.2 CCK-8法检测药物对胃癌细胞MKN45和SGC7901增殖抑制率取对数生长期的细胞用无胎牛血清的RPMI1640培养液制成密度为每毫升(2×104)~(4×104)个细胞的细胞悬液,接种到96孔板中(每孔100 μl)。培养箱中培养24 h后弃去旧培养液,加入同体积含如下不同药物浓度的完全培养液。实验分为:对照组:含细胞和不含药物的培养液;顺铂4 μg/ml组;rmhTNF 50 IU/ml组;rmhTNF 100 IU/ml组;rmhTNF 200 IU/ml组;顺铂4 μg/ml + rmhTNF 50 IU/ml组;顺铂4 μg/ml + rmhTNF 100 IU/ml组及空白组:不含细胞和药物的培养液。每组设4个复孔。在培养箱中培养24 h后弃去培养液加入110 μl含10%CCK-8的新鲜完全培养液(避光操作),培养箱孵育2 h在带有450 nm滤光片的酶标仪下测每孔吸光度值,取每组的平均值计算抑制率(IC),IC=(A对照组-A实验组)/(A对照组-A空白组)×100%。实验重复3次。
1.2.3 RT-PCR检测p53β和bcl-2 mRNA的表达将处于对数生长期的胃癌细胞MKN45和SGC7901,均匀接种到6孔板中,对照组药物浓度为0,实验组药物及浓度分别为:顺铂4 μg/ml组、rmhTNF 50 IU/ml组、rmhTNF 100 IU/ml组、rmhTNF 200 IU/ml组、顺铂4 μg/ml+rmhTNF 50 IU/ml组及顺铂4 μg/ml +rmhTNF 100 IU/ml组,培养24 h后按TRIzol试剂盒的说明书步骤提取总RNA。用M-MuLV第一链cDNA合成试剂盒进行cDNA的合成。β-actin为内参照。PCR反应条件为94℃预变性5 min、94℃变性30 s、53℃~58℃退火30 s、72℃延伸50 s,35个循环,72℃延伸7 min为反应条件进行PCR扩增。用2%琼脂糖制成的凝胶、100 V电压电泳25 min,溴乙锭(EB)染色。凝胶成像分析系统观察电泳结果并用自带图像分析软件读取电泳条带光灰度值。目的RNA的相对含量用该目的RNA的灰度值比对应的内参(β-actin)灰度值。引物序列及片段长度见表 1。
用SPSS20.0统计软件分析数据,各计量资料采用(x± s)表示,多组间差异采用单因素方差分析,组间均数进一步两两比较采用SNK(Student-Newman-Keuls)检验,两组间差异采用t检验,两变量间相关性采用Pearson直线相关分析,P<0.05为差异有统计学意义。
2 结果 2.1 rmhTNF和顺铂对人胃癌细胞MKN45和SGC7901增殖的影响细胞的增殖抑制率,见表 2。结果显示 rmhTNF单独(50、100、200 IU/ml)对SGC7901细胞抑制率随浓度增加未见明显改变,差异无统计学意义(P>0.05);而对MKN45细胞的抑制率随rmhTNF药物浓度增加而增加,差异有统计学意义(P<0.01)。相同药物浓度下,MKN45细胞抑制率大于SGC7901细胞,差异有统计学意义(P<0.05)。不同浓度rmhTNF(50、100 IU/ml)分别与顺铂(4 μg/ml)联合作用MKN45细胞,顺铂4 μg/ml + rmhTNF 50 IU/ml组和顺铂4 μg/ml + rmhTNF 100 IU/ml组细胞抑制率明显大于顺铂4 μg/ml组、rmhTNF 50 IU/ml组和rmhTNF 100 IU/ml组,差异有统计学意义(P<0.01),而对于SGC7901细胞,顺铂和rmhTNF联合组抑制率虽有增加,但差异无统计学意义(P>0.05)。综上,顺铂与rmhTNF联合对MKN45细胞有协同抑制作用,而对SGC7901细胞此作用未体现且对顺铂和rmhTNF的敏感度低于MKN45细胞。
 |
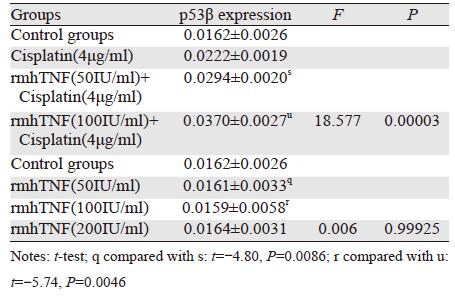
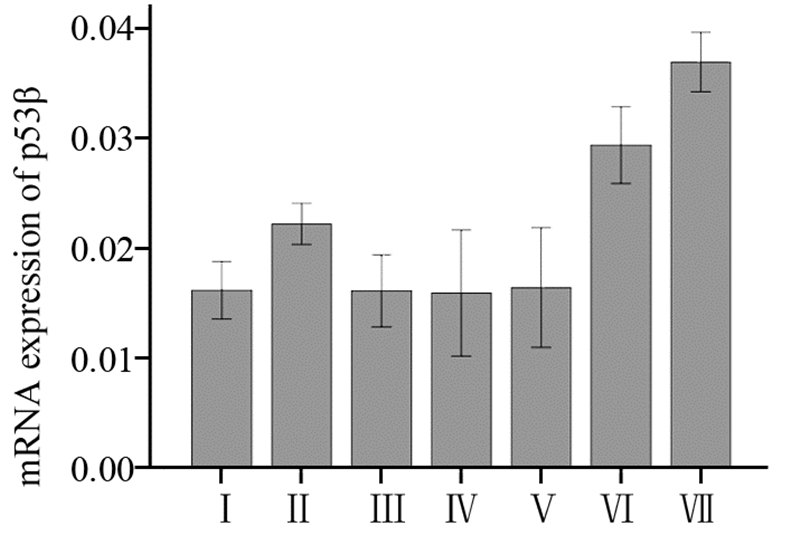
在SGC7901细胞中对照组与实验组都未见p53β表达,而在MKN45细胞中顺铂可增强p53β mRNA表达(本课题前期工作显示p53β的表达随顺铂浓度的增加而增加);顺铂与rmhTNF联合组中p53β mRNA表达均大于顺铂4 μg/ml组、rmhTNF 50 IU/ml组、rmhTNF 100 IU/ml组和rmhTNF 200 IU/ml组并随rmhTNF浓度的增加而增加,差异有统计学意义(P<0.01);3个剂量rmhTNF(50、100、200IU/ml)单独作用均不能增加其表达,差异无统计学意义(P>0.05)。p53β mRNA的表达量见表 3、图 1。
 |
|
| Ⅰ: Control groups;Ⅱ: Cisplatin(4μg/ml) group; Ⅲ: rmhTNF(50 IU/ml) group; Ⅳ: rmhTNF(100IU/ml) group; Ⅴ: rmhTNF(200 IU/ml) group; Ⅵ: rmhTNF(50IU/ml)+Cisplatin(4μg/ml) group; Ⅶ: rmhTNF(100IU/ml) +Cisplatin(4μg/ml) group 图 1 胃癌细胞MKN45中p53β的表达情况 Figure 1 p53β expression in gastric cancer cells MKN45 |
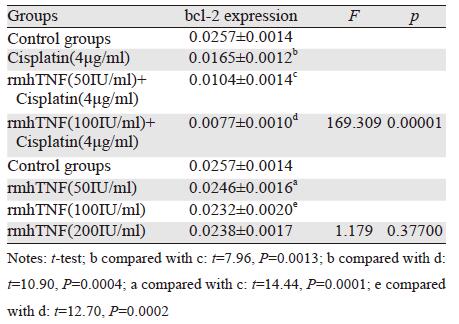
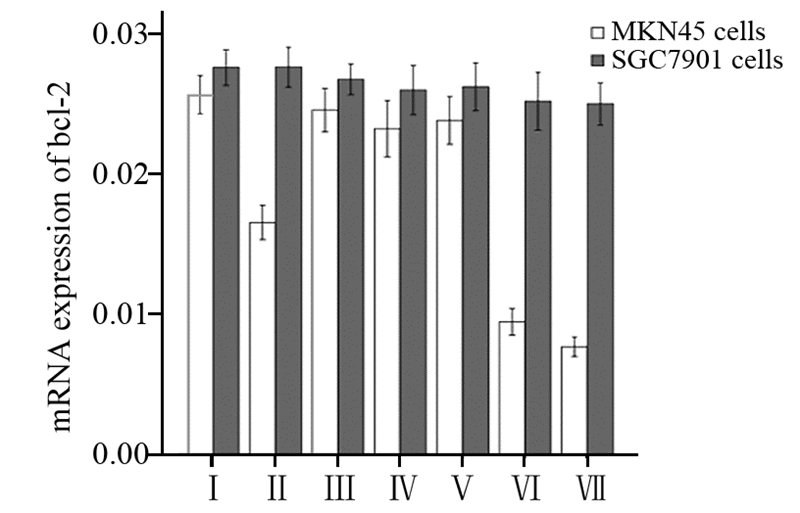
在SGC7901细胞中顺铂和rmhTNF的单独或联合作用均对bcl-2的表达无明显影响,差异无统计学意义(P>0.05)。在MKN45细胞中顺铂单独(4 μg/ml)或联合rmhTNF(50、100 IU/ml)均下调bcl-2的表达,且顺铂联合rmhTN组小于顺铂和rmhTNF单独用药组,差异有统计学意义(P<0.01)。而rmhTNF单独作用时,对bcl-2的表达无影响,差异无统计学意义(P>0.05)。bcl-2 mRNA的表达量见表 4~5、图 2。
 |
 |
|
| Ⅰ: Control groups;Ⅱ: Cisplatin(4μg/ml) group; Ⅲ: rmhTNF(50 IU/ml) group; Ⅳ: rmhTNF(100IU/ml) group; Ⅴ: rmhTNF(200 IU/ml) group; Ⅵ: rmhTNF(50IU/ml)+ Cisplatin(4μg/ml) group; Ⅶ: rmhTNF(100IU/ml)+Cisplatin(4μg/ml) group 图 2 胃癌MKN45和SGC7901细胞中bcl-2的表达情况 Figure 2 bcl-2 expression in gastric cancer cells MKN45 and SGC7901 |
不同药物或药物浓度作用MKN45细胞和SGC7901细胞24 h后β-actin 、p53β、bcl-2 mRNA的琼脂糖凝胶电泳,见图 3。

|
| M: DNA marker; Ⅰ: Control group; Ⅱ: Cisplatin(4μg/ml) group; Ⅲ: rmhTNF(50IU/ml)group; Ⅳ: rmhTNF(100IU/ml) group; Ⅴ: rmhTNF(200IU/ml) group; Ⅵ: rmhTNF(50IU/ml)+Cisplatin(4μg/ml) group; Ⅶ: rmhTNF(100IU/ml)+Cisplatin(4μg/ml)group 图 3 不同药物或药物浓度作用胃癌细胞MKN45和SGC7901 24 h后β-actin、p53β、bcl-2 mRNA的电泳图 Figure 3 Electrophoretogram of β-actin, p53β and bcl-2 mRNA after different drugs and drug concentrations treated gastric cancer cells MKN45 and SGC7901 for 24h |
在胃癌细胞MKN45中bcl-2的表达与p53β成负相关(r=-0.897, P<0.01),见图 4。bcl-2的表达与细胞抑制率成负相关(r=-0.906, P<0.01),见图 5。
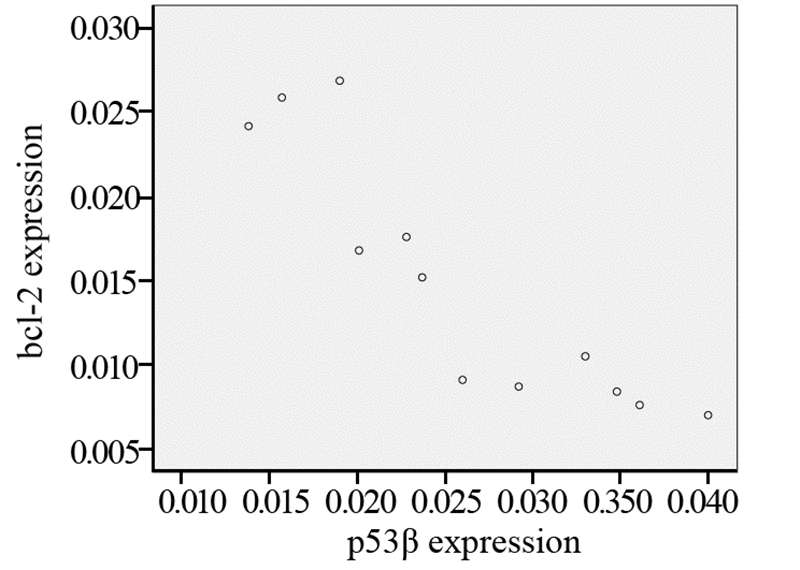
|
| 图 4 胃癌细胞MKN45中p53β和bcl-2 mRNA表达水平的相关性 Figure 4 Correlation of p53β and bcl-2 mRNA expression levels in gastric cancer cells MKN45 |

|
| 图 5 胃癌MKN45细胞中细胞增殖抑制率与bcl-2 mRNA表达水平的相关性 Figure 5 Correlation of inhibition rate with bcl-2 mRNA expression level in gastric cancer cells MKN45 |
在许多情况下,TNF-α并不是理想的抗肿瘤药物,因为TNF-α能够激活NF-κB分子,从而上调抗凋亡分子(bcl-2)表达,同时也激活促凋亡因子[9, 10]。研究发现在乳腺癌细胞中bcl-2普遍高表达且TNF-α可以上调bcl-2表达,表现出对TNF的抵抗[11],表明bcl-2的高表达可以部分抵消促凋亡分子的活动,这可能使癌细胞逃避抗肿瘤药物的杀害。然而TNF在肿瘤细胞中的双向作用以及最终结局,依赖细胞中分子组成及上下联系[10],在本实验中单独使用rmhTNF对p53β表达阳性的胃癌细胞MKN45呈现明显的增殖抑制作用,而对p53β表达阴性的胃癌细胞SGC7901无明显增殖抑制作用。提示p53β可能是rmhTNF发挥抑制肿瘤细胞增殖中的一关键靶分子。
p53作为转录因子以四聚体的形式通关p53敏感元件结合到DNA上调节基因的表达[12, 13],抑制肿瘤的发生、发展。如可以通过固有通路即bcl-2家族蛋白来调节细胞凋亡,然而bcl-2家族蛋白包括促凋亡分子(Bax和Bak)和抗凋亡分子(bcl-2),其两者的平衡决定着细胞对凋亡的敏感度[14]。p53β是野生型p53在转录后经选择性剪接及修饰产生的许多异构体中的一种,研究表明p53β因羧基端缩短当其激活时可以与p53形成复合体来调节p53的转录活性,从而作用于下游分子如bcl-2,抑制肿瘤细胞的生长[15, 16, 17]。然而也不排除p53β可独立于p53优先结合p53下游分子的启动子上,从而发挥抗肿瘤作用[17]。已经证明在p53阴性的H1299细胞中p53β可增强化疗药物敏感度[6]。Avery-Kiejda等[18]发现,在乳腺癌中p53β表达与肿瘤大小呈负相关与无病生存期成正相关。但仍没有直接的证据说明p53β的确切生物学功能[19]。前期工作显示顺铂作用MKN45胃癌细胞后随药物浓度的增加,p53β在胃癌细胞MKN45中的表达量逐渐增加。
本实验发现,在p53β表达阳性胃癌细胞MKN45中,顺铂可增强p53β mRNA表达,而rmhTNF三个剂量组均不能增加其表达,但是rmhTNF能增加顺铂的作用。然而rmhTNF为什么没有引起p53β mRNA的改变有待进一步研究。顺铂可抑制MKN45细胞中bcl-2表达,但对SGC7901细胞中bcl-2表达无影响;rmhTNF对两种细胞bcl-2表达无影响,且Pearson相关分析显示p53β与bcl-2的表达趋势呈负相关,这都提示p53表达状态影响bcl-2表达。从细胞抑制率可以看出rmhTNF和顺铂联合时可表现出协同作用,这协同作用伴随着p53β显著增加和bcl-2的降低。Pearson相关分析发现,bcl-2的表达量与细胞增殖抑制率呈负相关,提示bcl-2的高表达表现出对rmhTNF的抵抗,这与前人研究结果相似[11, 20]。rmhTNF和顺铂联合时,顺铂上调p53β从而下调bcl-2基因的表达,削弱细胞中的抗凋亡作用,然而rmhTNF通过NF-κB分子激活的促凋亡分子活性依旧存在,最终发挥协同抗肿瘤的作用。
综上所述,在胃癌细胞中p53β-bcl-2可能是rmhTNF和顺铂协同作用的靶通道之一,p53β作为重要的中间调节者。然而本实验中顺铂与rmhTNF是如何协同上调p53β,还待进一步研究。
| [1] | Parkin DM, Bray F, Ferlay J, et al. Global cancer statistics, 2002[J].CA Cancer J Clin, 2005, 55(2) :74-108. |
| [2] | Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2): 69-90. |
| [3] | Gill RS, Al-Adra DP, Nagendran J, et al. Treatment of gastric cancer with peritoneal carcinomatosis by cytoreductive surgery and HIPEC: a systematic review of survival, mortality, and morbidity[J]. Surg Oncol, 2011, 104(6): 692-8. |
| [4] | Zhang D, Fan D. Multidrug resistance in gastric cancer: recent research advances and ongoing therapeutic challenges[J]. Expert Rev Anticancer Ther, 2007, 7(10): 1369-78. |
| [5] | Zhang D, Fan D. New insights into the mechanisms of gastric cancer multidrug resistance and future perspectives[J]. Future Oncol, 2010, 6(4): 527-37. |
| [6] | Silden E, Hjelle SM, Wergeland L, et al. Expression of TP53 isoforms p53beta or p53gamma enhances chemosensitivity in TP53(null) cell lines[J]. PLoS One, 2013, 8(2): e56276. |
| [7] | Marcel V, Fernandes K, Terrier O, et al. Modulation of p53β and p53γ expression by regulating the alternative splicing of TP53 gene modifies cellular response[J]. Cell Death Differ, 2014, 21(9): 1377-87. |
| [8] | Li M, Xu T, Zhang Z, et al. Phase Ⅱ multicenter, randomized, double-blind study of recombinant mutated human tumor necrosis factor-α in combination with chemotherapies in cancer patients[J]. Cancer Sci, 2012, 103(2): 288-95. |
| [9] | Mattson MP, Camandola S. NF-kappaB in neuronal plasticity and neurodegenerative disorders[J]. J Clin Invest, 2001, 107(3): 247-54. |
| [10] | Gaur U, Aggarwal BB. Regulation of proliferation, survival and apoptosis by members of the TNF superfamily[J]. Biochem Phramacol, 2003, 66(8): 1403-8. |
| [11] | Wang Y, Wang X, Zhao H, et al. Clusterin confers resistance to TNF-alpha-induced apoptosis in breast cancer cells through NF-kappaB activation and Bcl-2 overexpression[J]. J Chemother, 2012, 24(6): 348-57. |
| [12] | el-Deiry WS, Kern SE, Pietenpol JA, et al. Definition of a consensus binding site for p53[J]. Nat Genet, 1992, 1(1): 45-9. |
| [13] | Bourdon JC, Deguin-Chambon V, Lelong JC, et al. Further characterisation of the p53 responsive element: identification of new candidate genes for trans-activation by p53[J]. Oncogene, 1997, 14(1): 85-94. |
| [14] | Ju WK, Lindsey JD, Angert M, et al. Glutamate receptor activation triggers OPA1 release and induces apoptotic cell death in ischemic rat retina[J]. Mol Vis, 2008, 14: 2629-38. |
| [15] | Lane D, Levine A. p53 research: the past thirty years and the next thirty years[J]. Cold Spring Harb Perspect Biol, 2010, 2(12): a000893. |
| [16] | Bourdon JC, Fernandes K, Murray-Zmijewski F, et al. p53 isoforms can regulate p53 transcriptional activity[J]. Genes Dev, 2005, 19(18): 2122-37. |
| [17] | Khoury MP, Bourdon JC. p53 isoforms: an intracellular microprocessor?[J]. Genes Cancer, 2011, 2(4): 453-65. |
| [18] | Avery-Kiejda KA, Morten B, Wong-Brown MW, et al. The relative mRNA expression of p53 isoforms in breast cancer is associated with clinical features and outcome[J]. Carcinogenesis, 2014, 35(3): 586-96. |
| [19] | Marcel V, Dichtel-Danjoy ML, Sagne C, et al. Biological functions of p53 isoforms through evolution: lessons from animal and cellular models[J] .Cell Death Differ, 2011, 18 (12): 1815-24. |
| [20] | Tanabe K, Kim R, Inoue H, et al. Antisense Bcl-2 and HER-2 oligonucleotide treatment of breast cancer cells enhances their sensitivity to anticancer drugs[J]. Int J Oncol, 2003, 22(4): 875-81. |
 2015, Vol. 42
2015, Vol. 42



