文章信息
- 陈宇,黄欣,刘思初,杨力建,陈少华,罗更新,李扬秋.
- CHEN Yu, HUANG Xin, LIU Sichu, YANG Lijian, CHEN Shaohua, LUO Gengxin, LI Yangqiu.
- 下调PPP2R5C表达对Jurkat细胞GSK-3β、MDM2、pTEN、TP53通路相关调控基因表达谱的影响
- Effects of PPP2R5C Downregulation on Expression Profile of GSK-3β, MDM2, pTEN and TP53 Signal Pathway Regulating Genes in Jurkat Cells
- 肿瘤防治研究, 2015, 42(11): 1067-1070
- Cancer Research on Prevention and Treatment, 2015, 42(11): 1067-1070
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.11.002
-
文章历史
- 收稿日期: 2014-11-14
- 修回日期: 2015-03-19
2. 510632广州,暨南大学血液病研究所;
3. 510632广州,暨南大学再生医学教育部重点实验室
2. Institute of Hematology, Medical College, Ji’nan University, Guangzhou 510632, China;
3. Key Laboratory for Regenerative Medicine, Department of Education, Ji’nan University, Guangzhou 510632, China
PPP2R5C是蛋白磷酸酶2A的一个调节亚单位,在调节细胞增殖、转化和凋亡中起重要作用,其表达模式的改变可能与细胞恶性转化有关[1, 2, 3]。PPP2R5C基因定位于14q32.2,在人体中有五种拼接体表达,分别是B56γ1~B56γ6。我们前期研究发现,PPP2R5C在多种白血病细胞中过表达[4],而下调PPP2R5C可明显抑制白血病细胞K562和Jurkat细胞的增殖[5, 6],同时,我们初步发现其抑制作用与TCR、Wnt、Ca2+和MAPK等信号通路相关[6]。本研究进一步分析PPP2R5C-siRNA下调Jurkat细胞PPP2R5C后,与细胞凋亡密切相关的GSK-3β(glycogen synthase kinase 3 beta)、MDM2(Mdm2 p53 binding protein homolog)、pTEN(phosphatase and tensin homolog)和TP53(tumor protein p53)信号通路相关基因的变化情况,进一步明确PPP2R5C在白血病细胞增殖和凋亡中的相关分子机制。
1 材料与方法 1.1 细胞培养T细胞白血病细胞株Jurkat为本室引进的细胞株,培养条件为:RPMI1640培养液(美国Gibco公司)含有10%胎牛血清(美国HyClone公司),加青霉素(苏州二叶制药有限公司)链霉素(山东鲁抗医药股份有限公司)双抗培养。培养于5%CO2、37℃培养箱(美国Thermo公司),2~3天换液传代一次。
1.2 核转染Jurkat细胞实验分组分为siRNA转染组和空白对照NC组。siRNA转染组:收集2.5×106个处于对数生长期的Jurkat细胞,1 100 r/min离心10 min,完全去除上清液;采用核转染试剂盒Suspension cell lines NucleofectorTM Kit L(德国Amaxa公司)中100 μl预热至室温的NucleofectorTM溶液和Supplement混合液(9:2,即配即用)悬浮细胞;加入1 μl PPP2R5C-siRNA799(美国Invitrogen公司化学合成,发明专利:ZL201110340411.1),核转染专用的移液管混匀后加入核转杯,启动NucleofectorTM核酸转染仪(德国Amaxa公司)特异性程序X-001,转染完成后立刻用核转染试剂盒里配套的移液管将转染后的细胞液,接种于含培养液的培养瓶中继续培养48 h。NC组:Jurkat细胞不做处理培养48 h。
1.3 RNA提取应用TRIzol试剂盒提取siRNA转染组和NC对照组Jurkat细胞的总RNA。提取后的RNA在100 V、体积分数为2%的琼脂糖凝胶中进行电泳并初步分析其质量。
1.4 Affymetrix基因表达谱芯片Affymetrix基因表达谱芯片采用上海伯豪生物技术有限公司Affymetrix GeneChip Scanner 3000扫描仪扫描得到原始图像数据,并应用GeneSpring GX 11.0软件进行差异表达谱分析,最后用SBC分析系统进一步分析其相关信号通路。
2 结果 2.1 RNA质控结果利用核转染技术转导PPP2R5C-siRNA799的Jurkat细胞,经细胞培养后,提取RNA得到siRNA转染组和NC对照组总RNA。所提取的各组样本RNA经Agilent 2100 Bioanalyzer生物分析仪分析,显示RNA A260/A280均在1.8~2.0之间,RNA分子完整数(RNA integrity number, RIN)值分别为8.9和8.1,且28S/18S分别为1.5和1.2,符合表达谱芯片试验要求(表达谱芯片样本质控要求为RIN≥7.0且28S/18S>0.7)。
2.2 芯片分析结果Affymetrix基因表达谱芯片分析显示:经过PPP2R5C-siRNA799处理的Jurkat细胞有963个明显上调(439个)和下调(524个)的基因[6]。所涉及的信号通路较多,我们前期研究已探讨了下调PPP2R5C后涉及T细胞活化信号通路TCR(T-cell receptor signaling pathway)、Wnt(Wnt/β-catenin signaling pathway)、Ca2+(calcium signaling pathway)和MAPK(mitogen-activated protein kinase signaling pathway)信号通路改变情况[6]。然而,这些变化仍不能完全了解下调PPP2R5C后Jurkat细胞的变化特点。
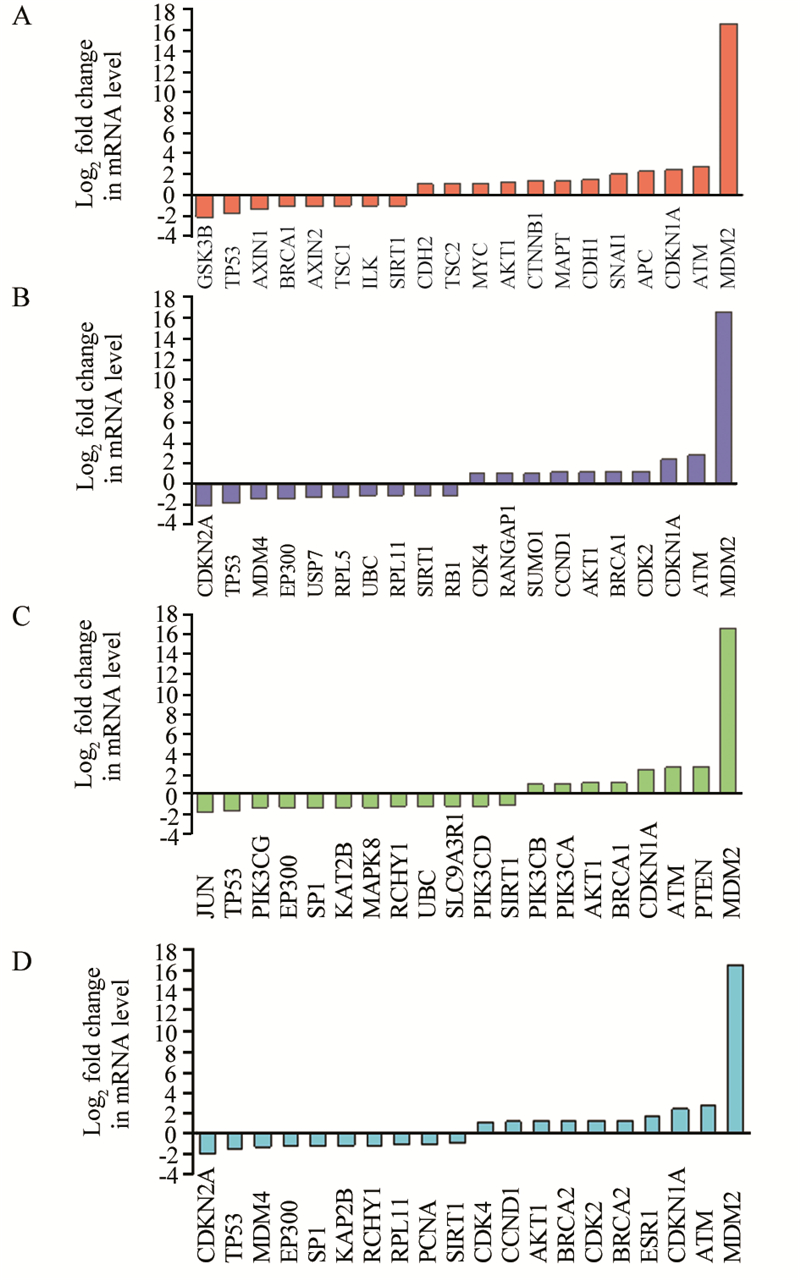
本研究进一步分析下调PPP2R5对Jurkat细胞中涉及细胞增殖和凋亡GSK-3β、MDM2、pTEN、TP53信号通路相关的47个基因的影响情况。我们发现这4个信号通路中,上调基因有22个,下调基因有25个,其中基因上调、下调倍数小于2倍的分别有16个和24个,大于2倍的分别有6个和1个。上调倍数大于2倍的基因有SNAI1、APC、CDKN1A、ATM、MDM2和pTEN,下调倍数大于2倍的基因只有GSK-3β。MDM2和pTEN基因自身分别上调了16.5倍和2.76倍,GSK-3β和TP53下调2.19倍和1.69倍、其余基因上调、下调倍数均为1倍左右,见图 1。将这些基因的芯片扫描数据均一化后,再经SBC系统分析后得到热图,见图 2。
|
| A: GSK-3β signaling pathway; B: MDM2 signaling pathway; C: pTEN signaling pathway; D: TP53 signaling pathway 图 1 下调PPP2R5C后Jurkat细胞中GSK-3β、MDM2、pTEN、TP53信号通路相关基因表达倍数图 Figure 1 Expression of genes related to GSK-3β, MDM2, pTEN and TP53 signaling pathways after PPP2R5C knockdown in Jurkat cells |

|
| Notes: 0, 1, 2, 3, -1, -2, -3: The Log values of upregulated or downregulated multiples with genes which corresponds to the color represented; NC: Normal Control 图 2 下调PPP2R5C后Jurkat细胞中GSK-3β、MDM2、pTEN、TP53信号通路相关基因改变热图 Figure 2 Expression of genes related to GSK-3β, MDM2, pTEN and TP53 signaling pathway after ppp2r5c knockdown in Jurkat cells analyzed by microarray technology |
GSK-3β(glycogen synthase kinase 3 beta)是一种多功能的丝氨酸/苏氨酸蛋白激酶,具有多种活性调节方式,并参与众多信号转导通路,调节细胞的生长、分化、增殖和凋亡。在肿瘤细胞中,已经证实其主要在癌细胞转录、加速细胞周期、参与肿瘤细胞侵袭与转移及凋亡过程中起到调控作用。TP53(tumor protein p53)又称为p53,作为一个肿瘤抑制基因而广为所知,其介导的细胞信号转导途径在调节细胞正常生命活动中起重要作用,活化的p53蛋白通过调控下游基因,诱导细胞周期停滞、细胞凋亡、DNA修复和衰老来抑制肿瘤细胞的恶化[7]。细胞正常生长情况下p53处于一个低表达水平,它的激活会受到MDM2的活化抑制[8]。MDM2(murine double minute 2)最初是在转化的成纤维细胞中发现的,编码一种锌指蛋白,可与p53蛋白结合,抑制p53介导的转录活性和阻止p53诱导凋亡的作用,引起肿瘤发生。除此之外,MDM2还可以与p21蛋白结合参与调节细胞增殖和凋亡。下调MDM2表达,p21蛋白表达就相应增加,导致细胞周期阻滞,并提高肿瘤细胞的化学敏感度[9]。pTEN(phosphatase and tensin homolog deleted on chromosome ten)是一种抑癌基因,在细胞生长、凋亡、黏附、迁移、浸润等方面具有重要作用[10]。据以往文献报道[8, 9, 10, 11, 12],与GSK-3β、MDM2、pTEN和TP53相关的基因众多,其中MDM2、CDKN1A、TP53和ATM与4个通路均相关,基于上述几个信号通路在细胞增殖和凋亡中的作用,本研究进一步从下调PPP2R5C表达后Jurkat细胞表达谱基因芯片结果中分析GSK-3β、MDM2、pTEN和TP53相关基因表达谱特点,非常明显的变化是下调PPP2R5C表达后,Jurkat细胞中涉及GSK-3β、MDM2、pTEN和TP53相关的全部47基因表达水平均发现变化,超过2倍上、下调基因有SNAI1、APC、CDKN1A、ATM、MDM2、pTEN和GSK-3β等7个基因。提示在下调PPP2R5C时,对Jurkat细胞中上述通路基因的影响存在一定的选择性,同时也提示这些基因的上调、下调参与了与调控PPP2R5C相关的细胞增殖抑制。下调PPP2R5C后,MDM2明显上调(16.5倍),而P53下调(1.69倍)处于一个低表达水平,细胞增殖得到抑制,这反向验证了MDM2抑制剂可以有效的提高P53活化水平和细胞凋亡率[11],同时也一定程度验证了PPP2R5C主要是通 过介导P53蛋白上的变化而发挥作用的[2, 12]。本结果初步提示下调PPP2R5C基因可能通过MDM2和P53基因来调控影响肿瘤细胞相应的信号通路,从而起到抑制细胞增殖和凋亡的作用,使细胞回到正常的生长状态,还有待进一步的验证。下调PPP2R5C后,ATM明显上调(2.74倍),TP53下调(1.69倍),这一定程度上反向验证了DNA损伤后,ATM磷酸化可以定向调节PPP2R5C表达,而PPP2R5C磷酸化又可以激活P53的肿瘤抑制功能[13]。SNAI1是一个转录调节因子,上调了2.0 7倍;CDKN1A是细胞周期抑制因子,上调了2.41倍,而CDKN1A基因又是SNAI1蛋白的抑制靶点[14],提示下调PPP2R5C基因可能主要在转录水平促进一些细胞周期抑制基因的转录、表达来抑制细胞的增殖。CDKN1A基因编码P21蛋白[12],P53下调,CDKN1A(P21)上调,细胞增殖受到抑制,这结果正好与文献报道的P53蛋白Thr55发生去磷酸化会促进P21的表达,从而抑制细胞增殖和转化相一致[15]。综上所述,下调Jurkat细胞PPP2R5C基因可以一定程度抑制TP53基因的功能,并同时促进其相关的CDKN1A和MDM2这些基因的协同作用,可能是发挥抑制Jurkat细胞增殖的效应所在。本研究结果主要在于首先提供了在白血病T细胞中PPP2R5C与GSK-3β、MDM2、pTEN和TP53信号通路之间的相关性,后续研究将挑选其他细胞株对这一结论做进一步的论证工作,也为发现协同靶向抑制T细胞肿瘤提供更系统资料。
| [1] | Li YQ, Zhou YB, Yang LJ. Structural feature and biological function of PPP2R5C gene[J]. Zhongguo Shi Yan Xue Ye Xue Za Zhi, 2009, 17(5): 1127-9. [李扬秋, 周羽竝, 杨力建. PPP2R5C基因结构特点和生物学功能[J]. 中国实验血液学杂志, 2009, 17(5): 1127-9. |
| [2] | Li HH, Cai X, Shouse GP, et al. A specific PP2A regulatory subunit, B56gamma, mediates DNA damage-induced dephosphorylation of p53 at Thr55[J]. EMBO J, 2007, 26(2): 402-11. |
| [3] | Chen Y, Zheng HT, Chen SH, et al. Distribution of the transcripts of PPP2R5C gene in healthy individuals and hematological malignance patients[J]. Ji’nan Da Xue Xue Bao(Yi Xue Ban), 2010, 31(6): 550-4. [陈宇, 郑海涛, 陈少华, 等. PPP2R5C转录本在正常人和血液肿瘤病人中的分布情况[J]. 暨南大学学报(医学版), 2010, 31(6): 550-4. |
| [4] | Zheng H, Chen Y, Chen S, et al. Expression and distribution of the PPP2R5C gene in leukemia[J]. J Hematol Oncol, 2011, 4: 21. |
| [5] | Shen Q, Liu S, Chen Y, et al. Proliferation inhibition and apoptosis induction of imatinib-resistant chronic myeloid leukemia cells via PPP2R5C down-regulation[J]. J Hematol Oncol, 2013, 6: 64. |
| [6] | Chen Y, Liu S, Shen Q, et al. Differential gene expression profiles of PPP2R5C-siRNA- treated malignant T cells [J]. DNA Cell Biol, 2013, 32(10): 573-81. |
| [7] | Tanikawa C, Nakagawa H, Furukawa Y, et al. CLCA2 as a p53-Inducible Senescence Mediator[J]. Neoplasia, 2012, 14(2): 141-9. |
| [8] | Vigneron A, Vousden KH. p53 and Mdm2: an auld alliance[J]. Cell Cycle, 2010, 9(5): 865-6. |
| [9] | Zhang Z, Li M, Wang H, et al. Antisense therapy targeting MDM2 oncogene in prostate cancer: effects on proliferation, apoptosis, multiple gene expression, and chemotherapy[J]. Proc Natl Acad Sci U S A, 2003,100(20): 11636-41. |
| [10] | Hou X, Qin SK, Ou YR, et al. Expressions and relevance of MDM2 and PTEN in bile duct carcinoma[J]. Zhong Liu Fang Zhi Yan Jiu, 2014, 41(6): 610-3. [侯鑫, 秦叔逵, 欧玉荣, 等. 胆管癌中MDM2和PTEN的表达及其相关性[J]. 肿瘤防治研究, 2014, 41(6): 610-3. |
| [11] | Zhang L, Huang NJ, Chen C, et al. Ubiquitylation of p53 by the APC/C inhibitor Trim39[J]. Proc Natl Acad Sci U S A, 2012, 109(51): 20931-6. |
| [12] | Shouse GP, Cai X, Liu X. Serine 15 phosphorylation of p53 directs its interaction with B56gamma and the tumor suppressor activity of B56gamma-specific protein phosphatase 2A[J]. Mol Cell Biol, 2008, 28(1): 448-56. |
| [13] | Shouse GP, Nobumori Y, Panowicz MJ, et al. ATM-mediated phosphorylation activates the tumor-suppressive function of B56γ-PP2A[J]. Oncogene, 2011, 30(35): 3755-65. |
| [14] | Chen Y, Gridley T. Compensatory regulation of the Snai1 and Snai2 genes during chondrogenesis[J]. J Bone Miner Res, 2013, 28(6): 1412-21. |
| [15] | Nobumori Y, Shouse GP, Wu Y, et al. B56γ tumor-associated mutations provide new mechanisms for B56γ-PP2A tumor suppressor activity[J]. Mol Cancer Res, 2013, 11(9): 995-1003. |
 2015, Vol. 42
2015, Vol. 42