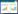文章信息
- 张丽静, 王园园, 翟丛劼, 杜志坚, 韩晓东, 赵增仁.
- ZHANG Lijing, WANG Yuanyuan, ZHAI Congjie, DU Zhijian, HAN Xiaodong, ZHAO Zengren.
- 结直肠癌中miR-31的表达及预测靶基因的生物信息学分析
- MicroRNA-31 Expression in Colorectal Cancer and Bioinformatic Analysis of Its Predicted Target Genes
- 肿瘤防治研究, 2015, 42(10): 1005-1010
- Cancer Research on Prevention and Treatment, 2015, 42(10): 1005-1010
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.10.012
-
文章历史
- 收稿日期: 2014-10-24
- 修回日期: 2015-04-15
结直肠癌(colorectal cancer,CRC)是消化道最常见的恶性肿瘤之一,其发生发展涉及多因素、多基因的参与。腺瘤是最主要的结直肠癌前病变。微小RNA(microRNA,miRNA)为一类内源性非编码小RNA,通过调控靶基因的表达,在细胞分化、细胞周期及凋亡过程中发挥重要作用[1]。本课题组前期通过高通量筛选方法发现,miR-31在结直肠癌组织和正常黏膜组织中存在差异性表达[2],但未进行大样本验证。本研究选取结直肠腺瘤组织、癌组织及匹配的正常黏膜组织,检测分析结直肠癌发展的不同阶段miR-31的表达差异,同时对其功能进行探讨;并利用生物信息学软件预测miR-31靶基因,分析可能参与的生物学过程,为研究其在结直肠癌发生、发展的作用和相关调控机制奠定基础。
1 材料与方法 1.1 材料 1.1.1 结肠癌细胞株实验所选用8种结肠癌细胞株(Caco-2、DLD-1、HCT116、HT-29、LoVo、SW480、SW620、SW1116)由香港中文大学于君教授转赠。
1.1.2 临床标本收集2011年5月至2012年5月40例来自河北医科大学第一医院结直肠癌手术标本。每例标本分别取自结直肠原发肿瘤组织、上(下)切缘正常黏膜(距离癌组织>5 cm)且术后病理证实无癌组织侵犯。新鲜标本离体后迅速置于液氮中,于-80℃保存。所有患者术前未接受任何化疗和放疗。另取同时期来自河北医科大学第一医院内镜中心行电子结肠镜下切除的33例结直肠腺瘤标本,标本均经组织病理学确诊。
1.1.3 主要试剂TRIzol试剂购自美国Invitrogen公司;All-in-OneTM miRNA qRT-PCR DetectionKit、miR-31及内参U6的引物均购自广州复能基因有限公司。McCoys 5A培养液、DMEM培养液、RPMI1640培养液、胎牛血清、青链霉素均购自美国Gibco公司。脂质体转染试剂Lipo2000购自美国Invitrogen公司;miR-31 mimics、inhibitor及miRControl购自广州锐博生物技术有限公司;PCNA及GAPDH抗体均购自美国Santa Cruz公司。
1.2 方法 1.2.1 细胞培养HCT116、HT-29细胞选用McCoys 5A培养液,SW480、SW620、SW1116细胞选用RPMI1640培养液,DLD-1、LoVo、Caco-2选用DMEM培养液,培养液均加入10%FBS和1%PEST。培养条件为37℃、5%CO2,根据生长情况每2~3 d换液1次,当细胞数达长满培养瓶底部时,收集细胞。
1.2.2 结肠癌组织及细胞株中总RNA的提取向待提标本中加入1 ml TRIzol。室温静置5 min,加入0.2 ml氯仿,振荡混匀后室温静置5 min,4℃12000 r/min离心15 min,取上层无色液相至另一离心管中,加入0.5 ml异丙醇,混匀,室温静置15min,4℃ 12 000 r/min离心15 min,可见RNA沉淀在管底部或侧壁。弃上清液,加入1 ml 75%乙醇振荡,4℃ 7500 r/min离心5 min,弃上清液,室温干燥RNA。用无RNA酶水溶解混匀,分光光度计检测RNA浓度及A260/A280的数值,A260/A280>1.8。
1.2.3 qRT-PCR检测结肠癌细胞株及癌组织中miR-31的表达水平采用实时荧光定量反转录PCR(quantitative reverse transcription PCR,qRTPCR)法检测癌组织中miR-31及U6的表达。取总RNA 2 μg进行反转录反应,反应条件:37℃ 60min,85℃ 5 min。取反转录产物cDNA 2 μl进行实时定量PCR反应,反应条件:95℃预变性10 min,然后按95℃ 10 s,60℃ 30 s,72℃ 10 s,进行40个循环。以上各步骤中,反应体系以及试剂用量均严格按照说明书进行。miR-31的相对表达量用2-ΔCT法计算。其中ΔCt=CtmiR-31-CtU6。
1.2.4 细胞增殖活性的检测(1)转染miR-31mimics组、inhibitor组、miR-Control组及空白对照组结肠癌HCT116细胞株,于转染后24 h消化细胞,分别接种于96孔板。按照MTS细胞增殖检测试剂盒说明,分别于接种96孔板后1、2、3、4 d按每孔20 μl加入MTS检测试剂,在培养箱中继续培养2 h,490 nm测定吸光度(A)值,绘制细胞生长曲线。每组设4个复孔,实验重复3次。(2)细胞转染后24 h,收集提取miR-31 mimics组、inhibitor组及空白对照组三组细胞中总蛋白,行Westernblot检测三组细胞中PCNA蛋白的表达。
1.2.5 靶基因预测及生物信息学分析采用TargetScan、DIANA、miRanda、PicTar等软件预测miR-31的靶基因。采用DAVID数据库对潜在的靶基因作富集分析。用Gene Ontology(GO)进行功能富集分类和KEGG信号通路分析。通过FisherExact Test计算基因功能的显著性水平(显著性筛选标准为P<0.01)。
1.3 统计学方法应用SPSS16.0 软件对实时荧光定量PCR检测结果进行分析,计量数据以均数±标准差表示,组间比较采用t检验;多组数据之间的差异采用单因素方差分析;结直肠癌患者临床特征与miRNA表达水平之间的关系分析采用卡方检验。以P<0.05为差异有统计学意义。
2 结果 2.1 miRNA array筛选结果课题组前期进行了miRNA芯片筛选,收集3例大肠癌患者癌组织及远端正常黏膜组织,抽提总RNA,进行miRNA芯片分析,结果显示大肠癌组织miRNA表达谱与正常黏膜有明显差异。 其中miR-101,miR-451等在癌组织中表达降低,而miR-31、miR-92及miR-93表达增加,其中miR-31平均上调5.35倍,见图 1。
|
| miR-31 was up-regulated in colorectal cancer(CRC) tissues, compared with normal mucosa. T1-T3: CRC tissues; N1-N3: normal mucosa tissues; 1: miR-10a; 2: miR-10b; 3: miR-101; 4: miR-494; 5: miR-451; 6: miR-31; 7: miR-92a; 8: miR-92b; 9: miR-93 图 1 3例大肠癌患者癌组织及远端正常黏膜芯片筛选结果 Figure 1 miRNA array results of cancer and normal mucosa tissues in three CRC patients |
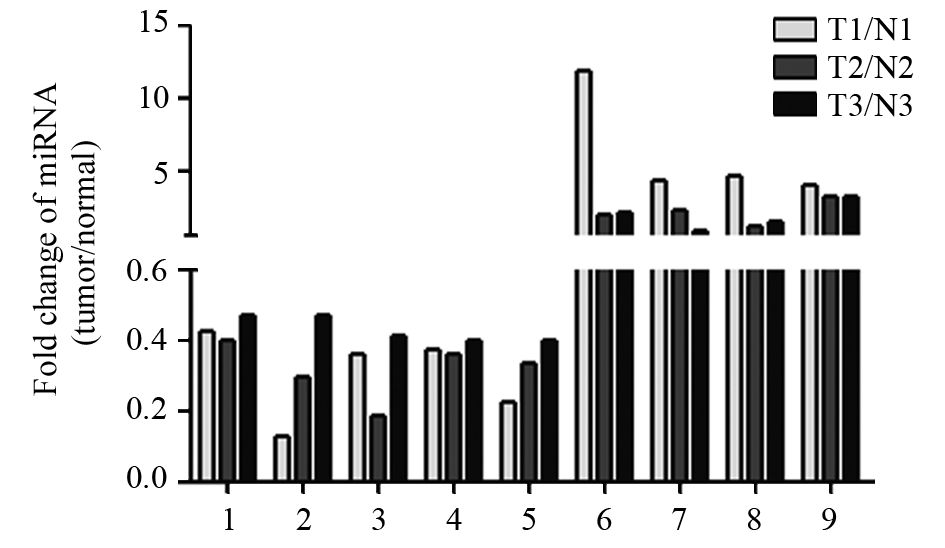
检测8种结肠癌细胞株和9例正常直肠黏膜组织中miR-31的表达(以-ΔCT表示)。相对表达量分别为Caco-2(-0.582±0.004)、DLD-1(1.219±0.536)、HCT116(-2.927±0.841)、HT-29(0.774±0.509)、LoVo(1.962±0.248)、SW480(-0.814±0.407)、SW620(1.279±0.328)、SW1116(0.576±0.551)、正常直肠黏膜(-5.781±1.929)。miR-31在结肠癌细胞株中表达均明显高于正常直肠组织,见图 2。
|
| 图 2 8种结肠癌细胞株中miR-31的表达 Figure 2 miR-31 expression in 8 colon cancer cell lines |
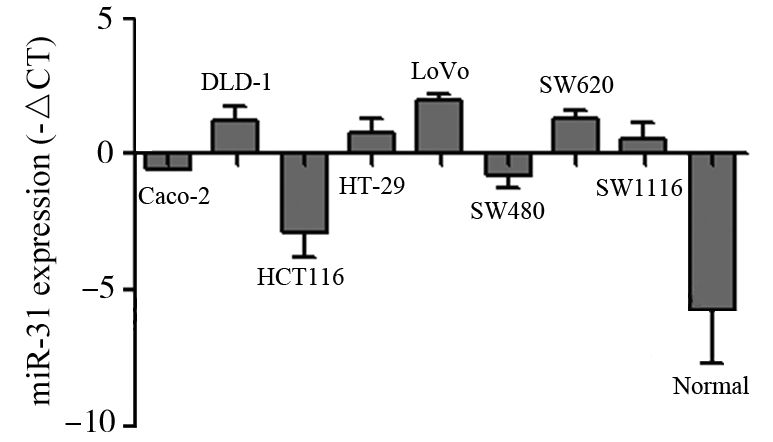
检测40例结直肠癌组织及配对远端正常黏膜组织及33例腺瘤组织中miR-31的表达水平,miR-31的表达以- ΔCT表示,分析三组标本间miR-31的差异。癌组织中miR-31的表达水平(-ΔCT=-4.33±2.63)明显高于正常黏膜组织(-ΔCT=-5.25±2.56)和腺瘤组织(-ΔCT=-5.32±2.51)。而腺瘤组织和正常黏膜组织相比,差异无统计学意义(t=0.122,P=0.904)。结直肠癌组织和匹配的正常黏膜组织相比,差异有统计学意义(t=2.185,P=0.035),见图 3。
|
|
A: miR-31 expression in colorectal adenoma, CRC and normal tissues; B: miR-31 expression in CRC and the matched normal mucosa tissues 图 3 结直肠癌及腺瘤组织中miR-31的表达 Figure 3 miR-31 expression in CRC and adenoma tissues |
分析结直肠癌组织中miR-31的表达与临床病理资料,发现伴有淋巴结转移的患者中miR-31的表达水平高于无淋巴结转移患者,但差异无统计学意义(P=0.131)。与其他临床病理特征(包括患者性别、年龄、肿瘤部位、浸润深度、远处转移及TNM分期)均无关(P>0.05),表略。
2.5 miR-31对结肠癌细胞HCT116增殖活性的影响将HCT116细胞分别转染miR-31 mimics、miR-31 inhibitor和阴性对照(miR-Control),检测miR-31的表达,结果证实,miR-31在转染miR-31mimics组的表达水平明显升高,而在转染miR-31 inhibitor组显著降低,见图 4A。随后使用MTS法检测不同组别HCT116细胞在不同时间点的细胞生长情况,发现转染miR-31 mimics组与阴性对照组及空白对照组相比,细胞生长活力增加;而转染miR-31 inhibitor组细胞生长活力显著降低( P<0.01),见图 4B。同时证实,转染miR-31mimics组PCNA蛋白表达较空白对照组明显增强,而转染miR-31 inhibitor组PCNA蛋白表达较空白对照组和mimics组显著降低,见图 4C。
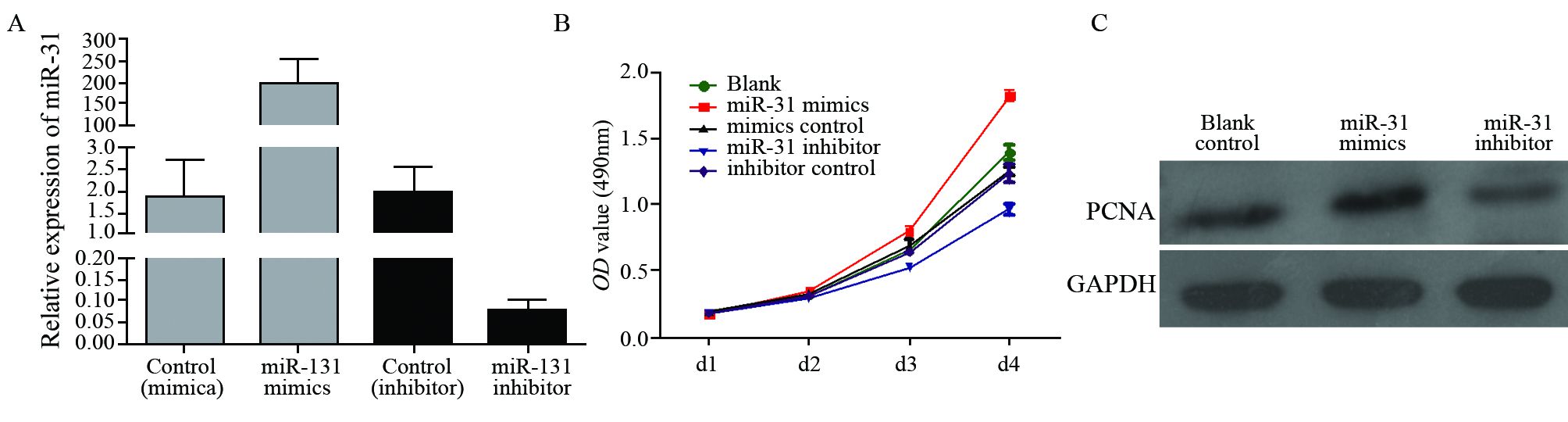
|
| miR-31 mimics and the negative control were transfected into HCT116 cells. After 24h, miR-31 level was detected by quantitative real-time RT-PCR. miR-31 level in miR-31 mimics was remarkably increased compared with miR-Control, while decreased in miR-31 inhibitor group. Effect of miR-31 on cell growth of human CRC cells HCT116 was detected by MTS(n=4). Meanwhile, the proliferation cell nuclear antigen(PCNA) protein level was detected. miR-31 overexpression effectively increased PCNA protein expression, while PCNA expression was decreased in miR-31 inhibitor group. A: miR-31 expression after transfection with miR-31 mimics, inhibitor and respective miR-Controls; B: MTS results; C: PCNA protein expression 图 4 miR-31对结肠癌细胞HCT116增殖活性的影响 Figure 4 Effect of miR-31 on proliferation of CRC cells HCT116 |
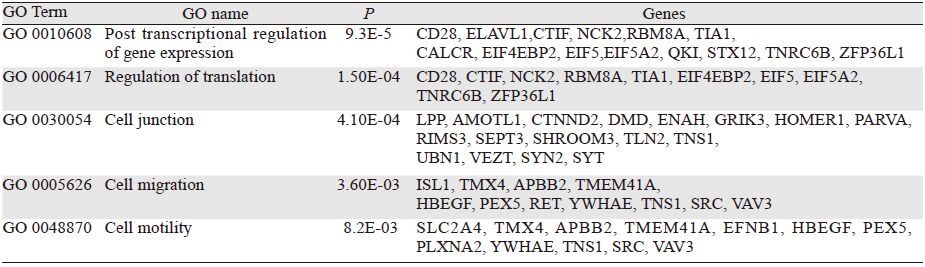
检索TargetScan、DIANA、miRanda、PicTar等数据库,将miR-31预测的靶基因进行GO分析和KEGG通路分析。生物信息学分析结果显示miR-31靶基因功能集中于转录后水平及翻译水平的调节、细胞代谢、细胞连接、迁移及细胞运动等生物学过程。信号通路主要富集于内吞作用、轴突导向、T细胞受体信号通路、Wnt及MAPK信号通路,见表 1、2。
 |
 |
MicroRNA是一种高度保守的单链非编码RNA,主要在转录后水平调控靶基因的表达。miRNA通过特异性识别并结合靶mRNA的3’-UTR区,促进靶mRNA降解和(或)阻碍翻译过程而发挥作用[3]。人类蛋白质编码基因约1/3受miRNA的调控[4]。目前研究发现,许多恶性肿瘤中均有特异的miRNAs的表达异常。MicroRNA参与肿瘤发生、进展和转移的多个环节。如miR-21在胃癌组织中高表达并且和淋巴结转移有关[5];miR-9在乳腺癌组织中表达下调,而增高其表达后可抑制细胞增殖及侵袭[6]。结直肠癌中miR-139-5p低表达,且与肿瘤细胞增殖、浸润与转移有关[7]。
课题组前期采用miRNA芯片筛选发现,直肠癌和正常直肠黏膜相比有其特异的miRNA表达谱,如miR-1、miR-101、miR-10a、miR-10b、miR-139-5p、miR-150、miR-214等低表达,而miR-18a、miR-31、miR-224、miR-93等高表达[2]。miR-31定位于染色体9p21.3,人miR-31首先在HeLa细胞中被发现。研究表明miR-31在多种恶性肿瘤中均有异常表达,但在不同肿瘤中miR-31的表达情况却不尽相同,具有一定的肿瘤特异性。有学者发现miR-31在结直肠癌中表达上调,且与肿瘤TNM分期和预后有关[8, 9];而在乳腺癌[10]、胃癌[11]、胰腺癌[12]中表达下调。
课题组前期芯片筛选的结果发现,miR-31在癌组织中的表达信号是正常黏膜组织的5.42倍。随后在8例结肠癌细胞株和40例结直肠癌患者组织标本中进行验证,结果和芯片筛选结果一致。不管是结肠癌细胞株还是结直肠癌组织中miR-31的表达水平均明显上调,这与之前的一些学者的研究结果一致[13, 14, 15]。
miR-31在结直肠癌组织中高表达,提示miR-31可能参与了结直肠癌的发展进程。 结直肠癌的发生发展是一个多步骤、多阶段的过程,1996年Kinzle[16]提出“正常黏膜─腺瘤─腺癌”的发生顺序。为了探讨miR-31在结直肠癌发展过程中的作用,课题组同时检测了33例腺瘤组织中miR-31的表达情况。结果腺瘤中miR-31的表达低于癌组织,但腺瘤和正常黏膜相比差异无统计学意义,随后分析miR-31表达和结直肠癌临床病理特征间的关系,发现伴有淋巴结转移的患者miR-31的表达水平高于无淋巴结转移者,虽然未达到统计学差异,考虑和样本量小有关。Chen等研究发现,miR-31参与了结直肠癌的发展进程[17],miR-31高表达和结直肠癌的侵袭和不良预后有关,TNM分期越晚、miR-31表达越高[18]。结合本实验结果,推测miR-31可能在结直肠癌早期进程中不发挥作用,主要与结直肠癌的浸润转移等晚期活动有关。
miRNA可通过抑制转录后水平的蛋白翻译调节多种生物学信号通路,参与调控肿瘤的发生和发展过程。为明确miR-31在结直肠癌发展进程中的作用及调控机制,本研究初步探讨了miR-31对结肠癌细胞增殖的影响。选用化学合成的miR-31模拟物和抑制剂转染结肠癌HCT116细胞,上调/下调结肠癌HCT116细胞中miR-31的表达,采用MTS方法检测细胞生长情况,发现miR-31 mimics转染结肠癌细胞后,细胞生长明显加快,细胞数目增多;而应用miR-31抑制剂后,随着miR-31表达降低,细胞生长减缓,细胞增殖受到抑制,PCNA蛋白表达也明显下降。这一结果初步表明了,miR-31可能作为一个癌基因,促进结肠癌细胞的生长及增殖。
随后对其靶基因进行生物信息学分析,采用TargetScan、miRanda等数据库对其靶基因进行预测,GO分析和KEGG通路分析结果提示:miR-31靶基因功能集中于转录后水平及翻译水平的调节,参与细胞连接、迁移及运动等生物学过程。信号通路主要富集于内吞作用、轴突导向、T细胞受体信号通路、Wnt及MAPK信号通路。了解这些将为我们后期继续研究miR-31的具体作用机制提供一定的方向和理论基础。
| [1] | Ambros V. The functions of animal microRNAs[J]. Nature, 2004,4 31(7006): 350-5. |
| [2] | Zhang LJ, Zhao ZR, Zhang ZY, et al. Differential expressions ofm icroRNAs in rectal adenocarcinoma tissues[J]. Zhong Liu FangZ hi Yan Jiu, 2014, 41(6): 602-5. [张丽静, 赵增仁, 张志勇, 等. 直肠 腺癌组织中microRNA差异表达谱分析[J]. 肿瘤防治研究,2 014, 41(6): 602-5.] |
| [3] | Rosenfeld N, Aharonov R, Meiri E, et al. MicroRNAs accuratelyi dentify cancer tissue origin[J]. Nat Biotechnol, 2008, 26(4):4 62-9. |
| [4] | Lim LP, Lau NC, Garrett-Engele P, et al. Microarray analysiss hows that some microRNAs downregulate large numbers oft arget mRNAs[J]. Nature, 2005, 433(7027): 769-73. |
| [5] | Xu Y, Sun J, Xu J, et al. miR-21 is a promising novel biomarkerf or lymph node metastasis in patients with gastric cancer[J].G astroenterol Res Pract, 2012, 2012: 640168. |
| [6] | Selcuklu SD, Donoghue MT, Rehmet K, et al. MicroRNA-9i nhibition of cell proliferation and identification of novel miR-9t argets by transcriptome profiling in breast cancer cells[J]. J BiolC hem, 2012, 287(35): 29516-28. |
| [7] | Zhang L, Dong Y, Zhu N, et al. microRNA-139-5p exertst umor suppressor function by targeting NOTCH1 in colorectalc ancer[J]. Mol Cancer, 2014, 13: 124. |
| [8] | Wang CJ, Zhou ZG, Wang L, et al. Clinicopathological significanceo f microRNA-31, -143 and -45 expression in colorectal cancer[J].D is Markers, 2009, 26(1): 27-34. |
| [9] | Bandrés E1, Cubedo E, Agirre X, et al. Identification by RealtimeP CR of 13 mature microRNAs differentially expressed inc olorectal cancer and non-tumoral tissues[J]. Mol Cancer, 2006, 5:2 9. |
| [10] | Valastyan S, Reinhardt F, Benaich N, et al. A pleiotropically actingm icroRNA, miR-31, inhibits breast cancer metastasis[J]. Cell,2 009, 137(6): 1032-46. |
| [11] | Guo J, Miao Y, Xiao B, et al. Differential expression of microRNAs pecies in human gastric cancer versus non-tumorous tissues[J]. JG astroenterol Hepatol, 2009, 24(4): 652-7. |
| [12] | Papaconstantinou IG, Manta A, Gazouli M, et al. Expressiono f microRNAs in patients with pancreatic cancer and itsp rognostic[J]. Pancreas, 2013, 42(1): 67-71. |
| [13] | Motoyama K, Inoue H, Takatsuno Y, et al. Over- and underexpressedm icroRNAs in human colorectal cancer[J]. Int J Oncol,2 009, 34(4): 1069-75. |
| [14] | Lei SL, Zhao H, Yao HL, et al. Regulatory roles of microRNA-708a nd microRNA-31 in proliferation, apoptosis and invasion ofc olorectal cancer cells[J]. Oncol Lett, 2014, 8(4): 1768-74. |
| [15] | Manceau G, Imbeaud S, Thiébaut R, et al. Hsa-miR-31-3pe xpression is linked to progression-free survival in patients withK RAS wild-type metastatic colorectal cancer treated with anti-E GFR therapy[J]. Clin Cancer Res, 2014, 20(12): 3338-47. |
| [16] | Kinzler KW, Vogelstein B. Lessons from hereditar colorectalc ancer[J]. Cell, 1996, 87(2): 159-70. |
| [17] | Chen T, Yao LQ, Shi Q, et al. MicroRNA-31 contributes toc olorectal cancer development by targeting factor inhibiting HIF-1α( FIH-1)[J]. Cancer Biol Ther, 2014, 15(5): 516-23. |
| [18] | Yang MH, Yu J, Chen N, et al. Elevated microRNA-31 expressionr egulates colorectal cancer progression by repressing its targetg ene SATB2[J]. PLoS One, 2013, 8(12): e85353. |
 2015, Vol. 42
2015, Vol. 42