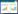文章信息
- 李英华, 刘学东, 郭秀芬, 刘晓, 罗建民, 李志赏, 张永晓.
- LI Yinghua, LIU Xuedong, GUO Xiufen, LIU Xiao, LUO Jianmin, LI Zhishang, ZHANG Yongxiao.
- 过表达SHP-1对人慢性髓系白血病急变细胞系K562生物学特征的影响
- Effects of SHP-1 Overexpression on Biological Characteristics of K562 Cells
- 肿瘤防治研究, 2015, 42(10): 988-992
- Cancer Research on Prevention and Treatment, 2015, 42(10): 988-992
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.10.008
-
文章历史
- 收稿日期: 2014-11-10
- 修回日期: 2015-01-05
2. 050000 石家庄,河北医科大学第二医院血液科(*:现单位:053000 衡水,衡水市中心血站)
2. Department of Hematology, The Second Hospital of Hebei Medical University, Shijiazhuang 050000, China (*: Present: Hengshui Blood Center, Hengshui 053000, China)
人类SHP-1基因定位于12p12~p13,主要在造血组织表达,SHP-1蛋白为68 KDa的含src同源结构域2(SH2)的胞质非受体酪氨酸磷酸酶,通过对下游信号蛋白分子磷酸酪氨酸脱磷酸化而负调控受体酪氨酸激酶(RTKs)、JAK-STAT、抗原受体复合物(TCR / BCR)三大信号通路[1, 2, 3]。SHP-1在人慢性髓系白血病急变(AML-M6)细胞系K562细胞中表达缺如,多种诱导分化剂可促进K562细胞SHP-1蛋白的重新表达[4];同时有研究表明外源性SHP1/ABL融合蛋白中ABL激酶活性降低,说明SHP-1可能抑制p210BCR-ABL1融合蛋白激酶活性[5]。以上研究均提示SHP-1在慢性髓系白血病(CML)中有着重要的作用,为进一步探讨SHP-1在CML中的作用,我们应用携带SHP-1基因开放阅读框的慢病毒载体转染到K562细胞,检测SHP-1基因对K562细胞增殖、细胞周期、凋亡、细胞形态和集落形成的影响,为探讨SHP-1在CML发生、发展中的作用及机制和开拓新的靶向治疗策略提供理论依据。
1 材料与方法 1.1 材料 1.1.1 试剂小鼠抗人SHP-1、GAPDH单克隆抗体、辣根过氧化物酶标记山羊抗鼠IgG(美国Santa Cruz公司),EX-EGFP-Lv105及EX-SHP1-Lv105表达质粒的构建、鉴定及慢病毒包装(广州复能基因公司),Annexin V-PI凋亡试剂盒(杭州联科生物公司),CCK-8细胞增殖试剂盒(日本Dojindo公司),TUNEL试剂盒(德国罗氏公司),SYBR Green荧光定量PCR试剂盒(广州复能基因公司),TRIzol(美国Invitrogen公司),反转录试剂盒(美国Promega公司)。
1.1.2 K562细胞为本实验室保存K562细胞用含10%胎牛血清的RPMI 1640培养液复苏培养,置5%CO2、37℃培养箱中进行传代培养,每2~3天传代1次,传3~ 4代时进行实验。
1.2 实验方法1.2.1 慢病毒包装表达质粒转染K562细胞
转染前12 h准备细胞,取对数生长期K562细胞,用无血清、无抗生素RPMI 1640培养液洗涤细胞2次,接种于6孔板中,终密度为50×104/ml。转染后置于细胞培养箱中培养2 h,每隔30 min轻轻晃动一次,将病毒液摇匀。之后等体积加入含20%胎牛血清的RPMI 1640培养液,再孵育24~96 h,倒置荧光显微镜下观察绿色荧光蛋白计算转染效率。实验分转染慢病毒载体的SHP-1表达质粒EX-SHP1-Lv105的K562SHP-1组,和转染EGFP表达质粒EXEGFP-Lv105的K562EGFP对照组。
1.2.2 CCK-8及细胞计数测定细胞增殖取对数生长期的各组细胞,调整密度为5×104/ml,接种于96孔板中,每孔200 μl,设3个复孔,置于37℃5%CO2培养箱培养,于不同培养时间用CCK-8法检测细胞增殖活性,酶标仪测定各个孔在450 nm处的吸光度(optical density,OD)值。
1.2.3 细胞形态学观察收集细胞悬液,稀释至5×103/ml甩片,瑞特-姬姆萨染色,光学显微镜下观察细胞形态变化。透射电子显微镜观察细胞的超微结构变化,收集细胞,4%戊二醛固定过夜,1%锇酸固定1 h,PBS充分清洗。梯度乙醇脱水,丙酮浸透,包埋,超薄切片,醋酸双氧铀-柠檬双染,透射电子显微镜(Hitachi 1200ES型)观察。
1.2.4 TUNEL(末端脱氧核苷酸转移酶介导的dUTP缺口末端标记法)检测细胞凋亡细胞应用悬浮细胞甩片,4%多聚甲醛固定过夜,按TUNEL试剂盒操作步骤检测,细胞中有棕黄色颗粒者为阳性细胞,即凋亡细胞。每张甩片计数200个细胞计算凋亡率。
1.2.5 流式细胞仪检测细胞周期和凋亡收集各组不同培养天数的细胞3×105个。Annexin V-碘化丙锭(PI)双染法检测细胞凋亡,按说明书操作。70%乙醇4℃固定过夜;加入PI,室温下避光孵育30min,流式细胞仪检测细胞周期分布和凋亡率。
1.2.6 Western blot检测收集细胞,加入100~200μl的SDS裂解液中,100℃孵育样品,5~20 min,1 500r/min离心30 s,收集上清液,Super-Bradford蛋白定量试剂盒进行蛋白定量。每组取等量蛋白质经SDS-PAGE电泳后转移至PVDF膜,滴加1:1 000稀释的一抗,5%的BSA封闭,4℃过夜。TBST液洗膜,每次5 min,共6次。1:4 000稀释的二抗封闭PDVF膜,30 min。TBST液洗膜,每次8 min,共4次。ECL发光法显影。以GAPDH为内对照。
1.2.7 SYBR Green荧光定量PCR检测mRNA表达采用TRIzol试剂进行细胞总RNA抽提。SYBRGreen 荧光定量PCR检测SHP-1 mRNA的表达,按照反转录试剂盒说明书操作合成cDNA,引物由北京赛百盛公司设计合成,SHP-1基因:上游引物5'-AACAGCCGTGTCATCGTCAT-CGA-3',下游引物为5'-ATCAGGTCTCCATTGTCCAGC-3';β-actin基因:上游引物5'-GAGCTACGAGCTGCCTGAC-3',下游引物为5'- GGTAGTTTCGTGGATGCCACAG-3'。PCR扩增参数为:95℃预变性5 min;95℃变性30 s,60℃退火45 s,30个循环。目的基因的mRNA相对表达水平以2-ΔΔCt表示。ΔCt=SHP-1的Ct值-管家基因β-actin Ct值,ΔΔCt=待测标本ΔCt-对照标本的ΔCt。
1.2.8 细胞集落培养将不同转染组各1×104个K562细胞加入到25 cm2的培养瓶中,加满含10% FBS的RPMI 1640培养液,培养10天后在倒置显微镜下计数所形成的细胞集落,以超过50个细胞为一个集落。
1.3 统计学方法SPSS19.0软件进行统计学分析。计量资料用(x±s)表示,计数资料表示为百分数。计量资料先进行正态性及方差齐性检验,两个独立样本均数比较采用t检验,率的比较采用χ2检验或Fish精确检验。P<0.05为差异有统计学意义。
2 结果2.1 转染后K562细胞SHP-1 mRNA和蛋白的表达情况
倒置荧光显微镜下观察慢病毒转染K562细胞的效率,在不同转染复数(MOI)条件下,转染效率分别为:MOI=0转染效率=0;MOI=50转染效率=(22.5±3.3)%;MOI=100转染效率=(50.9±4.4)%;MOI=200转染效率=(76.2±5.8)%。我们选用MOI=200进行转染。SYBR Green荧光定量PCR法检测K562细胞SHP-1 mRNA水平,结果显示转染EX-EGFP-Lv105的K562EGFP细胞和转染EXSHP1-Lv105的K562SHP-1细胞SHP-1 mRNA相对水平为分别为(0.03±0.01)和(1.23±0.53),两组差异有统计学意义(P=0.005)。Western blot检测结果显示K562EGFP细胞中未检测到SHP-1蛋白,而K562SHP-1细胞中检测到SHP-1蛋白,见图 1。
|
| A: expression of SHP-1 mRNA; B: expression of SHP-1 protein 图 1 转染后K562细胞SHP-1 mRNA和蛋白的检测 Figure 1 Expression of SHP-1 mRNA and protein in K562EGFP and K562SHP-1 cells after transfection |
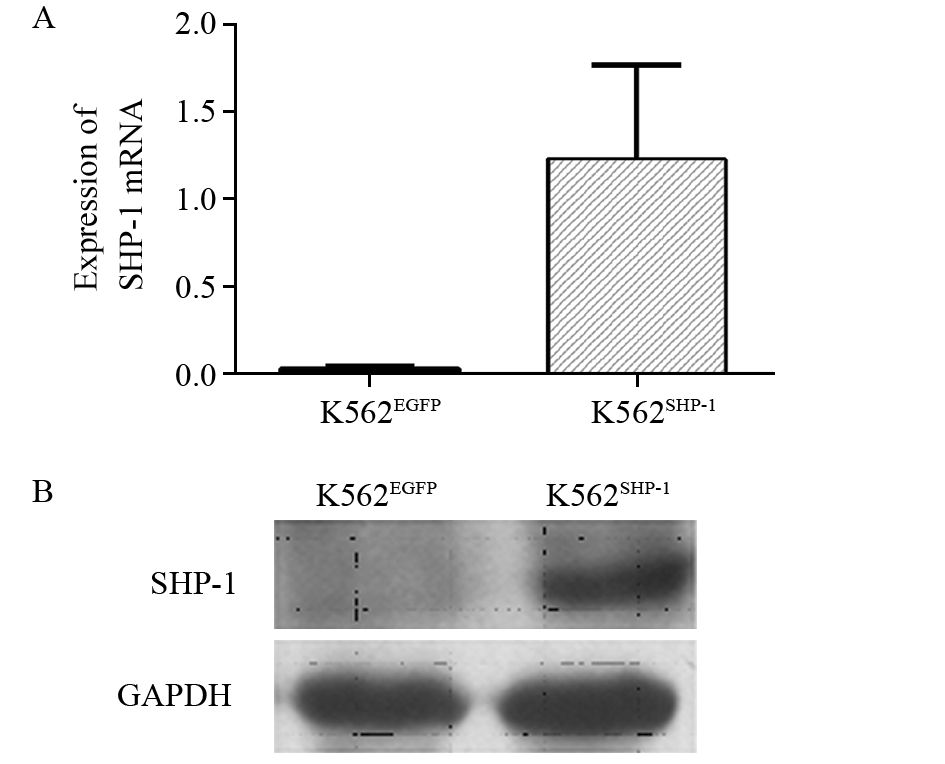
CCK-8检测结果证明,转染后0~6天K562EGFP细胞的OD值分别为:(0.23±0.01)、(0.26±0.04)、(0.35±0.02)、(0.47±0.05)、(0.73±0.09)、(1.08±0.22)、1.13±0.13),较K562SHP-1细胞高[(0.23±0.01)、(0.25±0.02)、(0.29±0.04)、(0.35±0.02)、(0.44±0.03)、(0.58±0.02、(0.63±0.09)]。两组细胞的自转染后3天开始差异出现统计学意义(P值分别为1.000、0.101、0.101、0.011、0.000、0.001、0.001),见图 2。
|
| A: Cell density of K562EGFP (left) and K562SHP-1 (right) cells on the fifth day of culture observed by inverted light microscope (×100); B: Cell viability determined by CCK-8 assays 图 2 过表达SHP-1抑制K562细胞增殖 Figure 2 Anti-proliferative effect of SHP-1 overexpression on K562 cells |
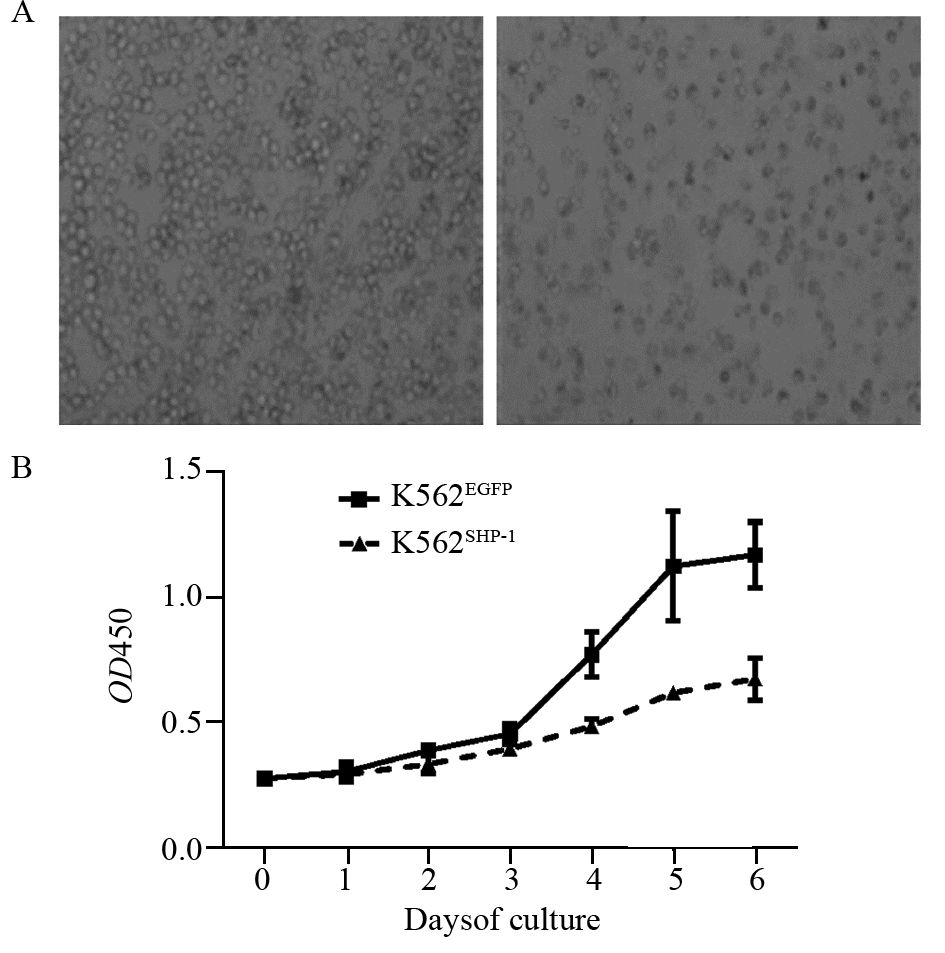
分别于转染后第1、3、5天收集各组细胞,流式细胞仪检测细胞周期发现过表达SHP-1后,K562细胞增殖指数下降,K562SHP-1细胞较K562EGFP 细胞G0/G1期细胞比例逐渐增加,而G2/M+S期细胞比例逐渐减少,第1天两组细胞比较差异无统计学意义(P=1.000),第3、5天两组细胞比较差异有统计学意义(P值分别为0.004、0.001),见图 3、表 1。TUNEL法检测转染后第5天细胞凋亡结果显示,K562SHP-1细胞凋亡率为(37.8±4.3)%,明显高于K562EGFP细胞(5.7±1.4)%,两组比较,差异有统计学意义(P=0.000)。细胞中棕黄色颗粒为凋亡细胞,见图 4。
|
| A: K562EGFP cells; B: K562SHP-1 cells 图 3 过表达SHP-1对K562细胞细胞周期分布的影响 Figure 3 Effect of SHP-1 overexpression on K562 cells cycle distribution |
 |

|
| A: K562EGFP cells;B: K562SHP-1 cells 图 4 TUNEL法检测过表达SHP-1对K562细胞凋亡的影响 (×400) Figure 4 Effect of SHP-1 overexpression on apoptosis of K562 cells detected by TUNEL assay (×400) |
K562细胞为半贴壁生长细胞,在普通培养条件下细胞可有集落形成。倒置显微镜下计数10个视野内所形成的细胞集落数目,K562SHP-1细胞形成的集落小而少[(26.3±5.2)个],并且荧光较弱,K562EGFP细胞形成的集落大而多[(54.7±8.6)个],两者比较差异有统计学意义(P=0.000),见图 5。
|
| A: K562EGFP cells; B: K562SHP-1 cells 图 5 过表达SHP-1对K562细胞集落形成的影响 (×100) Figure 5 Effect of SHP-1 overexpression on colony formulation of K562 cells (×100) |
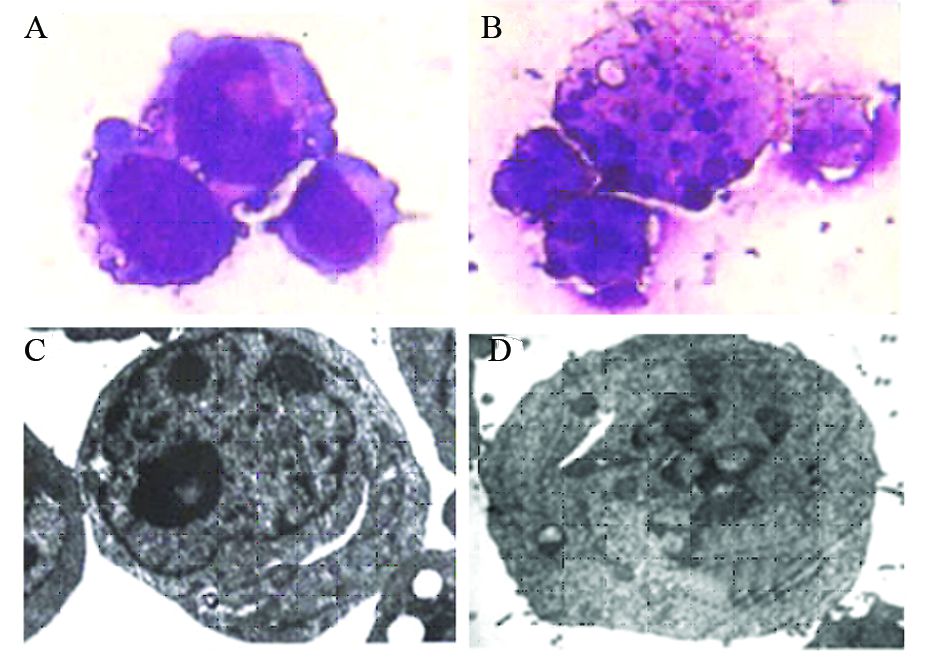
转染后第5天,观察K562EGFP细胞和K562SHP-1细胞形态,K562EGFP细胞呈圆形或椭圆形,体积较大,染色质疏松;K562SHP-1细胞体积缩小,染色质高度浓缩边集,核碎裂,核溶解、核空泡变性等细胞凋亡改变。电子显微镜观察:转染后第5天,K562EGFP细胞未见明显凋亡形态;K562SHP-1细胞出现核碎裂凋亡改变,见图 6。
|
| A,C: K562EGFP cells; B,D: K562SHP-1 cells; A,B: reiter Giemsa staining (×1 000);C,D: electron microscope (×10 000) 图 6 过表达SHP-1后K562细胞形态学变化 Figure 6 Morphologic changes of K562 cells transfected with SHP-1 |
K562SHP-1与K562EGFP细胞BCR-ABL1 mRNA的相对表达水平分别为(1.32±0.24)、(1.18±0.20),差异无统计学意义(P=0.644)。Western blot检测结果发现K562SHP-1细胞BCR-ABL1蛋白的表达水平(0.78±0.15)低于K562EGFP细胞(1.27±0.24)(P=0.040)。
3 讨论SHP-1是近年来发现的候选抑癌基因,天然纯合子或杂合子SHP-1基因失活突变motheaten(me/me)和viable motheaten(mev/mev)小鼠表现为髓/单核细胞系的过度增殖,其骨髓细胞对多种造血生长因子高度敏感[6, 7],K562细胞系SHP-1基因表达缺如[4, 8, 9]。我们及其他学者最近研究结果表明CML急性转化过程中SHP-1表达水平降低,为明确SHP-1在CML中的抑癌作用[10, 11]。本研究以慢病毒为载体将携带SHP-1蛋白开放阅读框的表达质粒转染到K562细胞系使其过表达SHP-1,研究SHP-1基因对K562细胞生物学特性的影响。
结果发现K562SHP-1细胞较K562EGFP细胞增殖受到抑制,且呈时间依赖性,CCK-8检测细胞增殖活性显示K562细胞转染SHP-1后K562SHP-1细胞增殖活性较K562EGFP细胞降低,自转染后第3天开始两种细胞的OD值出现统计学差异,随着培养时间的延长差异越来越大。K562SHP-1细胞较K562EGFP细胞的凋亡率增加,呈时间依赖性,转染SHP-1后第5天时K562SHP-1细胞的凋亡率为(26.13±1.16)%,而K562EGFP细胞的凋亡率为(9.00±1.22)%,两组差异有统计学意义;本研究还通过形态学观察到过表达SHP-1后K562细胞出现凋亡的特征性改变,可见大量的凋亡细胞和凋亡小体;流式细胞术分析显示,过表达SHP-1后K562细胞形成亚二倍体凋亡峰。细胞周期分析结果显示,K562细胞过表达SHP-1后G0/G1期的细胞比例逐渐增加,而G2/M+S期的细胞比例逐渐减少,过表达SHP-1后细胞周期阻滞在G0/G1期。细胞集落培养显示,K562SHP-1细胞形成的集落小而少,并且荧光较弱,表明SHP-1抑制K562细胞集落形成,支持SHP-1抑制白血病血病细胞的增殖及集落形成的作用。
综上所述,过表达SHP-1基因对K562细胞具有 增殖和集落形成抑制、诱导凋亡和改变细胞周期、 降低BCR-ABL1蛋白水平的作用,本实验从细胞生物 学水平初步探索了SHP-1基因对CML细胞肿瘤特性 的抑制作用,以往有文献报道SHP-1基因促进K562分 化[4],本研究结果及文献均提示白血病中SHP-1基因 在CML中具有抑癌基因的特征,为开发新的靶向治 疗提高了理论依据,但SHP-1对K562细胞在分子生 物学水平的影响机制,还有待于进一步的研究。
| [1] | Wu C, Sun M, Liu L, et al. The function of the protein tyrosinep hosphatase SHP-1 in cancer[J]. Gene, 2003, 306: 1-12. |
| [2] | Zhang J, Somani AK, Siminovitch KA. Roles of the SHP-1 tyrosinep hosphatase in the negative regulation of cell signalling[J]. SeminI mmunol, 2000, 12(4): 361-78. |
| [3] | Lorenz U. SHP-1 and SHP-2 in T cells: two phosphatasesf unctioning at many levels[J]. Immunol Rev, 2009, 228(1):3 42-59. |
| [4] | Bruecher-Encke B, Griffin JD, Neel BG, et al. Role of the tyrosinep hosphatase SHP-1 in K562 cell differentiation[J]. Leukemia,2 001, 15(9): 1424-32. |
| [5] | Lim YM, Wong S, Lau G, et al. BCR/ABL inhibition by an escort/p hosphatase fusion protein[J]. PNAS, 2000, 97(22): 12233-8. |
| [6] | Tapley P, Shevde N, Schweitzer P, et al. Increased G-CSFr esponsiveness of bone marrow cells from hematopoietic cellp hosphatase deficient viable motheaten mice[J]. Exp Hematol,1 997, 25(2): 122-31. |
| [7] | Dong Q, Siminovitch KA, Fialkow L, et al. Negative Regulationo f Myeloid Cell Proliferation and Function by the SH2 Domain-C ontaining Tyrosine Phosphatase-1[J]. J Immunol, 1999, 162(6):3 220-30. |
| [8] | Amin HM, Hoshino K, Yang H, et al. Decreased expression levelo f SH2 domain-containing protein tyrosine phosphatase-1 (Shp1)i s associated with progression of chronic myeloid leukaemia[J]. JP athol, 2007, 212(4): 402-10. |
| [9] | Chim CS, Liang R, Leung MH, et al. Aberrant gene methylationi mplicated in the progression of monoclonal gammopathy ofu ndetermined significance to multiple myeloma[J]. J Clin Pathol,2 007, 60(1): 104-6. |
| [10] | Kaeda JS, Oberender C, Neuman D, et al. Differential Expressiono f SHP-1 Levels in Chronic Phase and Advanced Disease CMLa nd in AML Patients[J]. Blood, 2012, 120(21): 1449-50. |
| [11] | Li Y, Yang L, Pan Y, et al. Methylation and decreased expressiono f SHP-1 are related to disease progression in chronicm yelogenous leukemia[J]. Oncol Rep, 2014, 31(5): 2438-46. |
 2015, Vol. 42
2015, Vol. 42