文章信息
- 袁岱岳, 邵伟斌, 郝清亚, 严栋梁, 朱建伟.
- YUAN Daiyue, SHAO Weibin, HAO Qingya, YAN Dongliang, ZHU Jianwei.
- 靶向cortactin基因的shRNA重组质粒的构建和筛选
- Construction and Screening of shRNA Expression Plasmids Targeting at cortactin Gene
- 肿瘤防治研究, 2015, 42(10): 984-987
- Cancer Research on Prevention and Treatment, 2015, 42(10): 984-987
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.10.007
-
文章历史
- 收稿日期: 2014-10-30
- 修回日期: 2015-03-19
2. 226311 南通,南通大学附属医院普外科
2. Department of General Surgery, Affiliated Hospital of Nantong University, Nantong 226311, China
Cortactin蛋白(cortical actin binding protein)最初作为致癌的酪氨酸蛋白激酶v-src的底物被发现[1]。它在肝癌、胃癌、食管癌、结直肠癌、肺癌等许多恶性肿瘤中过表达;通过参与肌动蛋白细胞骨架的调控,促进恶性肿瘤的发生发展和侵袭转移[2]。为观察沉默cortactin基因对肝癌细胞生物学行为的影响,本实验构建了靶向cortactin基因的短发夹状RNA(short hairpin RNA,shRNA)重组质粒,将其转染至人肝癌HepG2细胞,观察转染后HepG2细胞内cortactin mRNA表达的变化,并筛选出抑制效能最高的重组质粒。
1 材料和方法 1.1 材料人肝癌HepG2细胞、大肠杆菌DH5a由南通大学中心实验室提供;胎牛血清、DMEM培养液(杭州四季青公司);SacⅠ、BSAⅠ、Eco31Ⅰ、DL2000、T4 DNA Ligase、Ex TaqTM(大连Takara公司),普通质粒小提质粒盒(北京美科美生物技术开发有限公司);TRIzol(美国Invitrogen公司);cDNA第一链合成试剂盒、SYBR Green/FlouresceinqPCR Master Mix(2X)(美国Fermentas公司);LipofectamineTM2000(美国Invitrogen公司)。
1.2 方法 1.2.1 cortactin基因shRNA靶序列的设计及合成依据GenBank中人cortactin基因序列,根据shRNA设计原则,采用clotech网页提供的设计程序,设计了3段靶序列Homo cortactin-1:G G A A C A A G A C C G A AT G G AT ,H o m ocortactin-2:GGCAAATACGGTATCGACA和Homocortactin-3:CCAGAAAGACTACTCCAGT。经过BLASTN比对分析,与人类其他基因的编码序列无同源性。按引物结构:Eco31Ⅰ+Sense+Loop+Antisense complement+终止信号+SacⅠ+Eco31Ⅰ设计引物。cortactin特异性shRNA干扰片段由武汉巴菲尔生物技术服务有限公司合成。
1.2.2 cortactin基因shRNA重组质粒的构建分别将3对正义与反义寡核苷酸单链稀释,等浓度混合,加入退火缓冲液混匀,使其终浓度为100 nmol/L,在PCR仪上进行退火反应。取空质粒pBSilence1.1用BSAⅠ酶切,1%琼脂糖凝胶回收大片段,电泳鉴定后,将退火后的双链shRNA模板与pBSilence1.1线性化载体按浓度比10:1,22℃水浴反应过夜。次日各取5 μl连接产物转化感受态细胞DH5α,分别涂布于含Kanar抗性(终浓度为30 μg/ml)的LB平板上,37℃恒温培养箱培养过夜。从每个培养皿上各挑取数个单克隆菌落接种于5 ml含Kanr抗性(终浓度为30 μg/ml)的LB培养液中,37℃恒温摇床培养过夜。用试剂盒小量提取质粒,并分别用SacⅠ做酶切鉴定。将酶切鉴定正确的质粒送由武汉巴菲尔生物技术服务有限公司测序。测序正确的重组真核质粒分别命名为pBSilence1.1-cortactin-s hRNA1、pBSilence1.1-cortactin-shRNA2和pBSilence1.1-cortactin-shRNA3。通用阴性对照质粒为武汉巴菲尔生物技术服务有限公司产品,其编码的靶序列为GACTTCATAAGGCGCATGC,该序列经过BLAST比较,与人类其他基因的编码序列无同源性。
1.2.3 细胞培养及质粒转染HepG2细胞在含10%胎牛血清的DMEM培养液中,置于5%CO2、37℃恒温培养箱,细胞融合度达到80%进行传代。转染前24 h,取传代4次以上并处于对数生长期的HepG-2细胞,以2×105~5×105的密度接种于6孔板中,第二天细胞融合度达到70%~80%,细胞转染前更换无血清无双抗的DMEM培养液培养1~2 h;取4 μg质粒按照脂质体LipofectamineTM 2000转染试剂盒说明书,质粒与脂质体质量比为1:2进行转染;转染后6 h,更换成含10%胎牛血清的DMEM培养液继续培养。以未转染的细胞作阴性对照,转染后24 h,荧光显微镜下观察HepG2细胞转染情况。
1.2.4 RT-PCR检测各组HepG2细胞中cortactinmRNA的表达根据GenBank中的cortactin基因序列,用Premier5.0软件设计PCR引物,序列如下:上游:5’-GAGCAAGCCAGAGCCAAAAC-3’,下游:5’-AAGCCGCATCCTCATAGACG-3’,扩增片段长100 bp。内参β-actin基因引物序列如下:上游:5’-CACGATGGAGGGGCCGGACTCATC-3’,下游:5’-TAAAGACCTCTATGCCAACACA-GT-3,扩增片段长240 bp。质粒转染24 h后用TRIzol试剂按说明书方法抽提各组HepG2细胞中总RNA,分光光度计测定RNA浓度。以稀释10倍后的反转录产物cDNA为模板进行Real-time PCR反应,反应条件:50℃ 2 min,95℃ 10 min;95℃ 30 s,60℃ 30 s,40个循环。反应后,以β-actin作为内参,分析ABI via7系统导出数据。cortactin基因mRNA相对表达值(relative expression,RQ)采用ΔΔCt方法计算,即RQ=2ΔΔCt。ΔΔCt以空白对照组为标准,如ΔΔCt阴性对照组=ΔCt阴性对照组-ΔCt空白对照组。ΔCt=CtHomo cortactin-CtHomo β-actin。空白对照组RQ=20=1。每组实验重复3次。
1.3 统计学方法实验数据以(x±s)表示,采用SPSS20.0软件分析数据,组间比较采用多组单因素方差分析(ANOVA),P<0.05为差异有统计学意义。
2 结果2.1 重组质粒的酶切鉴定
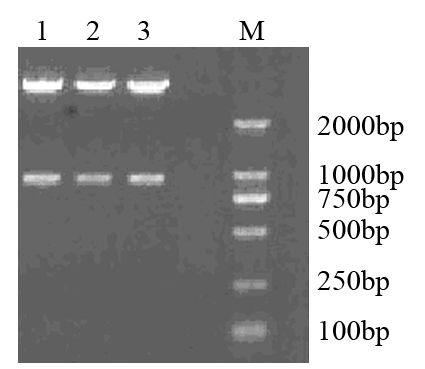
酶切分析:在质粒载体pBSilence1.1里原只有一个SacⅠ的酶切位点,本实验在插入shRNA片段中又设计了一个SacⅠ的酶切位点,pBSilence1.1-cortactin-shRNA1、pBSilence1.1-cortactin-shRNA2和pBSilence1.1-cortactin-shRNA3重组质粒均能够被SacⅠ酶切出一条约900 bp的DNA条带,说明目的基因片段已经成功插入到pBSilence1.1载体里,见图 1。
|
| M: DL2000; 1: pBSilence1.1-cortactin-shRNA1; 2: pBSilence1.1-cortactin-shRNA2; 3: pBSilence1.1-cortactin-shRNA3 图 1 重组质粒的酶切电泳图 Figure 1 Restriction map of recombinant plasmid |
测序结果证实重组质粒中插入shRNA片段的碱基序列与设计序列完全一致。重组质粒构建成 功。
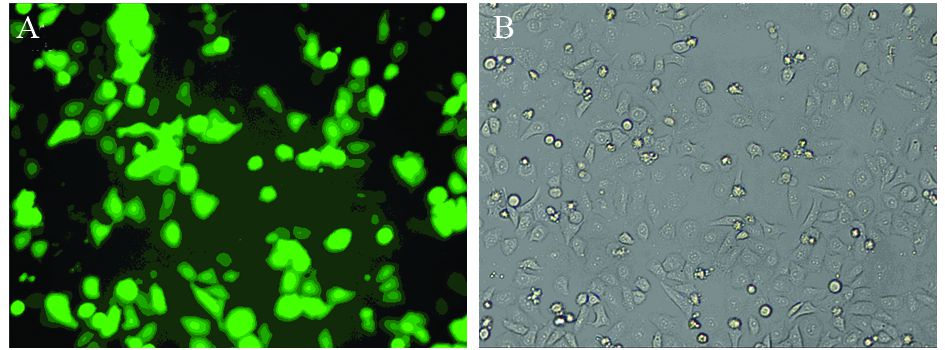
2.3 荧光显微镜观察HepG2细胞转染情况HepG2细胞转染24 h后,在荧光显微镜下,各转染阳性的细胞均可观察到绿色荧光蛋白表达,提示转染成功,见图 2。
|
| A: Image under fluorescent microscope; B: Same image under ordinary microscope 图 2 重组质粒的转染情况(×100) Figure 2 Transfection efficiency of recombinant plasmid (×100) |
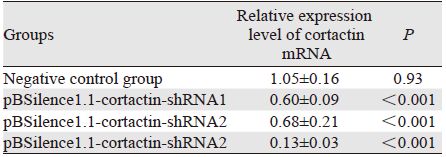
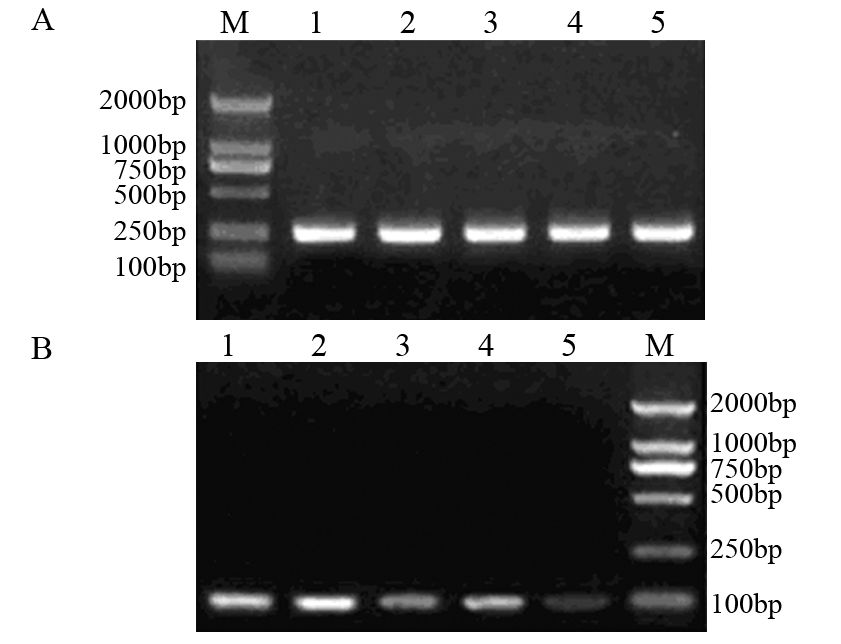
转染2 4 h 后,RT- PCR测各组He pG2 细胞cortactin基因mRNA的表达,结果显示:与阴性对照组及空白对照组相比,3组重组质粒组cortactin基因mRNA的表达均明显降低(P﹤0.05);与pBSilence1.1-cortactin-shRNA1和pBSilence1.1-cortactin-shRNA2两组相比,pBSilence1.1-cortactinshRNA3组cortactin基因mRNA的表达降低更加显著(P﹤0.05),见表 1、图 3。
 |
|
| A: β-actin; B: cortactin mRNA; M: marker DL2000 ; 1: blank control group; 2: negative control group; 3: pBSilence1.1-cortactin-shRNA1 group; 4: pBSilence1.1-cortactin-shRNA2 group; 5: pBSilence1.1- cortactin-shRNA3 group 图 3 各实验组HepG2细胞cortactin基因mRNA的表达情况 Figure 3 mRNA expression of cortactin in HepG2 cells of each experimental group |
原发性肝癌(HCC)等恶性肿瘤的侵袭和转移是一个复杂的多步骤的过程,包括癌细胞的局部增殖和扩展、分离和脱落,以及肿瘤组织新生血管的形成,癌细胞进入循环,癌细胞降解脉管基膜逸出循环及随后的定位生长等。整个过程都离不开癌细胞自身的运动。现已证明细胞皮层下机动蛋白的聚合在癌细胞的运动中有着非常重要的作用。Cortactin蛋白是肌动蛋白相关蛋白复合体(actin-related protein complex 2/3、Arp2/3复合体)的激活因子,通过加强Arp2/3复合体和肌动蛋白的母链结合而促进皮层下机动蛋白的聚合[2, 3]。编码Cortactin蛋白基因位于染色体11q13区域,此区域在很多肿瘤包括肝癌、胃癌、食管癌、肺癌、膀胱癌、宫颈癌等存在扩增[4, 5, 6]。实验证实cor-tactin基因在低转移性肝癌细胞中过分表达能使癌细胞转移能力提高,促进转移灶的形成;反之抑制cortactin基因的表达,可有效减弱癌细胞的侵袭和转移能力[2, 7]。以上提示cortactin或可作为一个有效的HCC基因治疗的靶点。
RNA干扰技术是近年来发展起来的一种的抑制基因表达的新技术,它通过导入细胞的小分子干扰RNA(small interference RNA,siRNA),降解同源mRNA,从而阻断目的基因的表达[8, 9, 10]。shRNA是在设计导入细胞的RNA单链上,在编码siRNA正、反义链序列之间添加一段不相互补的碱基序列,这样使RNA自身折叠成发卡状双链后形成一个loop环,在导入细胞后可以在细胞内RNA酶的作用下被切割成与体外合成的siRNA相同的序列与结构,诱导RNAi效应,可以使RNAi下调特定基因的表达作用时间更长、更稳定[8]。本实验依据GenBank中的人cortactin基因序列,根据shRNA设计原则,设计并合成3对针对人cortactin基因的shRNA,体外将其退火后连接到载体pBSilence1.1,经酶切和测序结果证实无误后,采用脂质体转染的方法将其转染入人肝癌HepG2细胞。RT-PCR检测转染后各组HepG2细胞cortactin基因mRNA表达情况,结果显示与阴性对照组和空白对照组相比,3组重组质粒组的cortacti基因mRNA表达水平均明显下降,说明所构建的重组质粒均能特异性的抑制HepG2细胞内cortactin基因mRNA的表达。但本研究所构建的3个重组质粒对cortactin基因mRNA表达的干扰效果并不一致,其中以pBSilence1.1-cortactin-shRNA3质粒的抑制效果最为明显。这种针对同一基因不同靶点设计shRNA对基因表达干扰效果的差异显著是因为siRNA起作用的关键是双链RNA能否与靶mRNA相互结合,而靶mRNA有很多复杂的二级结构,并非所有设计出来的siRNA都能够有效地与模板结合并起作用。因此在使用shRNA干扰技术进行相关实验研究前,需首先对所设计的shRNA进行筛选。
本实验成功的构建了靶向cor tact in基因的s hRNA重组质粒,筛选出了沉默效果最好的pBSilence1.1-cortactin-shRNA3重组质粒,为深入研究沉默cortactin基因对肝癌细胞生物学行为的影响奠定了实验基础。
| [1] | Sung BH, Zhu X, Kaverina I, et al. Cortactin controls cell motilitya nd lamellipodial dynamics by regulating ECM secretion[J]. CurrB iol, 2011, 21(17): 1460-9. |
| [2] | Kirkbride KC, Sung BH, Sinha S, et al. Cortactin: am ultifunctional regulator of cellular invasiveness[J]. Cell AdhM igr, 2011, 5(2): 187-98. |
| [3] | Evans JV, Kelley LC, Hayes KE, et al. Further insights intoc ortactin conformational regulation[J]. Bioarchitecture, 2011,1 (1): 21-3. |
| [4] | Nazari H, Khaleghian A, Takahashi A, et al. Cortactin, an actinb inding protein, regulates GLUT4 translocation via actin filamentr emodeling[J]. Biochemistry(Mosc), 2011, 76(11): 1262-9. |
| [5] | Wei J, Zhao ZX, Li Y, et al. Cortactin expression confers a morem alignant phenotype to gastric cancer SGC-7901 cells[J]. World JG astroenterol, 2014, 20(12): 3287-300. |
| [6] | Zhu JW, Ma LL, Huang BY, et al. A pivotal role of cortactin, aC TTN encoding protein, in endocytosis of human colon cancer[J].Z honghua Yi Xue Za Zhi, 2011, 91(6): 385-90. [朱建伟, 马利林,黄 宝玉, 等. 癌基因CTTN编码蛋白Cortactin与大肠癌细胞内吞作 用的关系[J]. 中华医学杂志, 2011, 91(6): 385-90.] |
| [7] | MacGrath SM, Koleske AJ. Cortactin in cell migration and cancera t a glance[J]. J Cell Sci, 2012, 125(Pt 7): 1621-6. |
| [8] | Xiong Y, Wang AM, Guo W. Biological behavior of colorectalc arcinoma Lovo cells after stable transfection survivin targeteds hRNA plasmid expression vector[J].中华实用诊断与治疗杂志,2 009, 23(8): 741-3. [熊英, 王爱民, 郭文. 导入靶向survivin基因的 shRNA质粒表达载体对大肠癌细胞生物学行为的影响[J]. 中华实用诊断与治疗杂志, 2009, 23(8): 741-3.] |
| [9] | Shi J, Zhang QL, Ding YQ. Application of RNAi technologyi n respiratory tumour study[J]. Shi Yong Yi Xue Za Zhi, 2010,2 6(16): 3058-60. [石见, 张庆玲, 丁彦青. RNAi技术在呼吸系统肿 瘤研究中的应用[J]. 实用医学杂志, 2010, 26(16): 3058-60. ] |
| [10] | Li XJ, Chen BH, Yao B, et al. Down-regulating UHRF1 expressionc ould inhibit progression of hepatocellular carcinoma[J]. ZhongL iu Fang Zhi Yan Jiu, 2015, 42(7): 666-70. [ 李新建, 陈保华, 姚斌 , 毛英. 下调UHRF1的表达在抑制肝癌进展中的作用[J]. 肿瘤 防治研究, 2015, 42(7): 666-70.] |
 2015, Vol. 42
2015, Vol. 42


