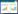文章信息
- 高原, 陈奇, 刘春英, 王哲, 李庆昌.
- GAO Yuan, CHEN Qi, LIU Chunying, WANG Zhe, LI Qingchang.
- GSK-3β及β-catenin的表达定位与肺腺癌顺铂耐药作用机制研究
- Mechanism of GSK-3β and β-catenin Expression Localization Mediating Cisplatinresistance of Lung Adenocarcinoma
- 肿瘤防治研究, 2015, 42(10): 960-964
- Cancer Research on Prevention and Treatment, 2015, 42(10): 960-964
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.10.002
-
文章历史
- 收稿日期: 2015-01-05
- 修回日期: 2015-02-02
2. 110179 沈阳,辽宁省体育科学研究所生理研究室;
3. 110001 沈阳,中国医科大学病理教研室
2. Institute of Physiology, Liaoning Sports Science Institute, Shenyang 110179, China;
3. Department of Pathology, China Medical University, Shenyang 110001, China
糖原合成激酶3(glycogen synthesis kinase,GSK-3)是一种丝/苏氨酸类激酶,广泛分布在真核生物中,是糖原代谢过程中的重要限速酶,可以在胰岛素调控下磷酸化肝糖原合成酶(glycogensynthesis)使之失活。在哺乳动物中,GSK-3包括两个亚型,即GSK-3α和GSK-3β,其中GSK-3α主要参与糖原代谢过程;而GSK-3β则主要参与早期胚胎发育中决定细胞命运过程的基因调控等,还与肿瘤、糖尿病、脂肪增多症、炎症、情感障碍以及阿尔茨海默病等多种疾病的发生发展有关[1]。GSK-3β影响多种细胞功能活动,其中较重要的包括影响β-catenin等参与信号调节和代谢的蛋白、结构蛋白和各种转录因子[2]。众多研究结果显示GSK-3β参与了肿瘤细胞对化疗敏感度的调节。例如,在卵巢癌、肝癌、乳腺癌和结肠癌中,GSK-3β发挥肿瘤抑制剂的作用,它的抑制增强了肿瘤细胞对化疗药物的耐药性[3, 4, 5, 6]。而另一方面,在结肠癌中,GSK-3β起到了肿瘤促发剂的作用,它的抑制可以加强结肠癌细胞对化疗药物的敏感度[7]。因此,GSK-3β的调节作用到底是增强对化疗的敏感度还是对化疗产生耐药取决于肿瘤细胞的类型。在不同肿瘤细胞中,GSK-3β对化疗药物产生不同的反应,同时GSK-3β对肿瘤化疗药物敏感度的潜在调节机制可能也有所不同。
本实验通过观察顺铂处理前后G S K - 3 β 及β-catenin在A549、A549/DDP细胞中的细胞核和细胞质分布的变化,探讨GSK-3β及β-catenin表达定位与A549/DDP细胞对顺铂产生耐药的机制。
1 材料与方法 1.1 细胞株与细胞培养A549细胞株由中国医科大学病理教研室提供,A549/DDP细胞株购自中国医学科学院肿瘤研究所。取处于对数生长期细胞,弃去培养液,加入0.25%胰酶1 ml,消化约2~5 min(肉眼观察瓶壁半透明的细胞层出现细针孔空隙,或倒置显微镜下细胞变钝圆,细胞间隙增大),即可终止消化。加入含10%胎牛血清培养液5 ml(A549细胞在DMEM培养液中培养,A549/DDP细胞在RPMI1640培养液中培养),无菌吸管轻轻吹打,使之均匀悬浮。分装入两个培养瓶,传代继续培养。
1.2 实验试剂及抗体DMEM培养液、RPMI1640培养液和胎牛血清购自美国HyClone公司。胰蛋白酶、DMSO购自韩国Biosharp公司。顺铂购自德国Calbiochem公司(批号D00117683,规格50 mg)。MTT检测试剂盒购自上海碧云天公司。鼠抗β-catenin多克隆抗体购自美国BD公司,兔抗GSK-3β多克隆抗体购自英国Abcam公司,鼠抗LRP多克隆抗体购自英国Abcam公司。
1.3 MTT法检测细胞对顺铂半数抑制浓度用0.25%胰蛋白酶消化贴壁的肿瘤细胞,制成细胞悬液,用含10%胎牛血清的培养液调整细胞浓度至105/ml,向96孔板中每孔加100 μl,培养24 h后用2、4、8、16、32、64、128 μmol/L顺铂进行处理。37℃、5%CO2继续培养48 h,实验终止前,每孔加入MTT溶液(5 mg/ml)20 微升/孔,孵育4 h,弃去培养液,加入150 μl DMSO,振荡10 min后,置于酶标自动分析仪上,在570 nm波长处测定光吸收值(A值)。用SSPS分析法计算出IC50值,并按以下公式计算耐药指数:耐药指数=A549/DDP细胞IC50值/ A549细胞IC50值。
1.4 免疫细胞荧光法检测GSK-3β和β-catenin在细胞中的定位用0.25%胰蛋白酶消化贴壁的肿瘤细胞,制成细胞悬液,用含10%胎牛血清的培养液调整细胞浓度为104/ml,于激光共聚焦培养皿中加入500 μl,加入20 μmol/L顺铂后继续培养48 h后进行如下处理:用4%多聚甲醛PBS室温固定15 min;用PBS漂洗三次,每次10 min;用含0.2% Triton-X-100的PBS室温通透化处理20 min;用PBS漂洗三次,每次10min;室温下,用含5%羊血清的PBS封闭1 h;滴加一抗工作液(Polyclonal Anti-Total GSK-3β 1: 100;Polyclonal Anti-β-catenin 1:100),4℃孵育过夜;去除一抗,用PBS漂洗三次,每次10 min。
以下避光操作:滴加二抗工作液(1:100),于湿盒中37℃孵育1 h;去除二抗,用PBS漂洗三次,每次10 min;加入DAPI染色液,于湿盒中室温作用15 min以上;用PBS漂洗三次,每次10min;在激光共聚焦显微镜(日本Olympus公司)下观察,用合适波段激发,采集图像。
1.5 Western blot法检测细胞中肺耐药蛋白表达分别收集A549和A549/DDP细胞株,提取总蛋白,制10%SDS-聚丙烯酰胺凝胶,常规电泳、转膜,封闭一抗(1:1 000),4℃孵育过夜,室温孵育二抗(1:3 000)2 h,在PVDF膜上滴加ECL发光液,使用Bio-Rad分子成像仪激发和采集目的条带,借助Image J分析软件定量目的条带的强度,采用所测的LRP条带与β-actin吸光度值的比值表示该蛋白的表达强度。
1.6 统计学方法各结果至少重复3次求平均值后,采用SPSS13.0软件对数据进行处理,计量资料用(x±s)表示,若数据呈正态分布采用Independent Samlpe t检验,若数据呈非正态分布采用非参数检验分析数据。检验水准a=0.05。
2 结果 2.1 A549和A549/DDP细胞顺铂耐药性的检测MTT检测显示顺铂对A549和A549/DDP细胞株的增殖均有抑制作用,但顺铂对A549/DDP的抑制率明显低于A549细胞。顺铂对A549和A549/DDP细胞的IC50值分别为(5.888±0.338)μmol/L和(28.984±1.404)μmol/L(t=27.696,P<0.001),耐药指数为4.92。
Western blot法检测A549/DDP细胞株中肺耐药蛋白的表达(1.517±0.0473)较A549细胞株(0.647±0.0451)增强(P<0.01),见图 1。

|
| 图 1 A549、A549/DDP细胞中肺耐药蛋白的表达 Figure 1 Expression of total Lung resistance proteins in A549 and A549/DDP cells |
在A549细胞中,GSK-3β主要定位于胞质中,胞核中只有少量表达;在A549/DDP细胞中,同A549细胞相似,GSK-3β也主要定位于胞质中,胞核中只有少量表达,见图 2。提示在无顺铂刺激时A549、A549/DDP细胞间耐药性的差异与GSK-3β的表达定位关系不大。

|
| 图 2 A549、A549/DDP细胞中GSK-3β的定 位表达的变化(×400) Figure 2 Alteration of location expression of GSK-3β in A549 and A549/DDP cells (× 400) |
一定剂量顺铂(20 μmol/L)作用于细胞后,A549/DDP细胞中GSK-3β的定位表达却发生了明显的变化。顺铂处理前,GSK-3β主要定位于胞质中,胞核中只有少量表达;而顺铂处理后,GSK-3β的定位除了在胞质外,胞核中也有较多的表达。A549细胞中GSK-3β的定位表达变化不大,无论是顺铂处理前还是处理后,GSK-3β主要还是分布在胞质中,胞核中分布极少,见图 3。该实验结果提示,顺铂处理后GSK-3β表达部位的不同可能是导致A549、A549/DDP细胞耐药性差异的重要原因之一。
|
| 图 3 顺铂处理后A549、A549/DDP细胞中GSK-3β的定位表达的变化 (×400) Figure 3 Alteration of location expression of GSK-3β in A549 and A549/DDP cells treated with cisplatin (×400) |
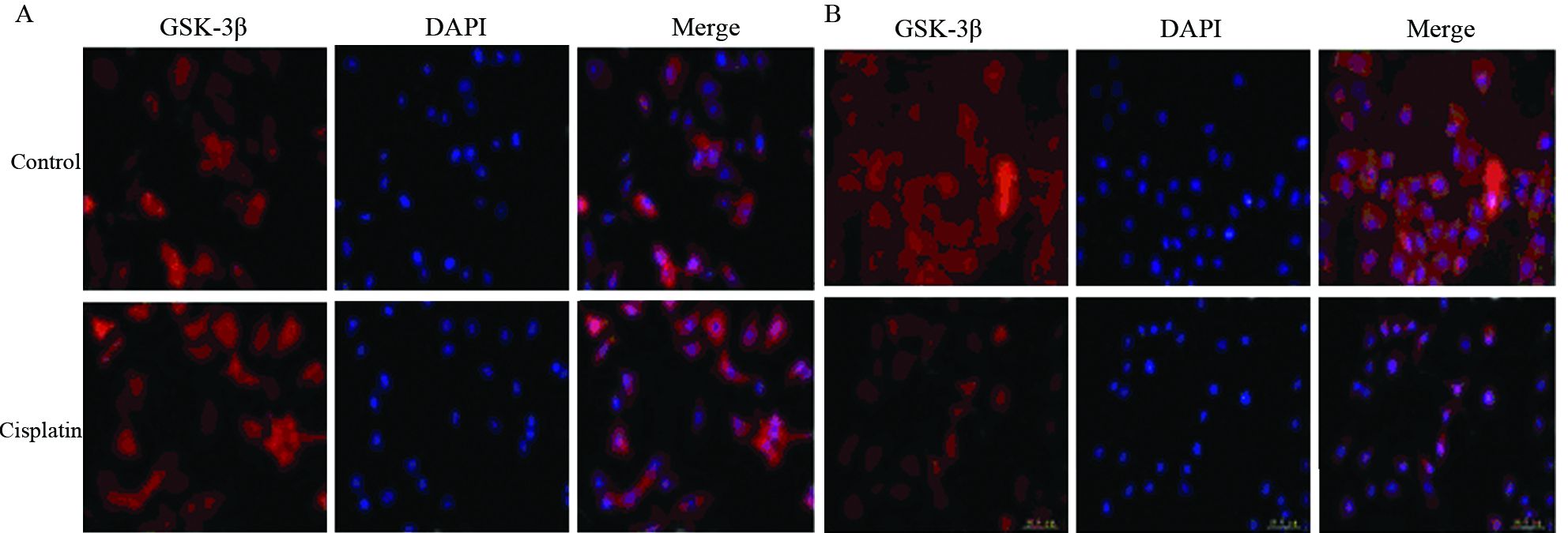
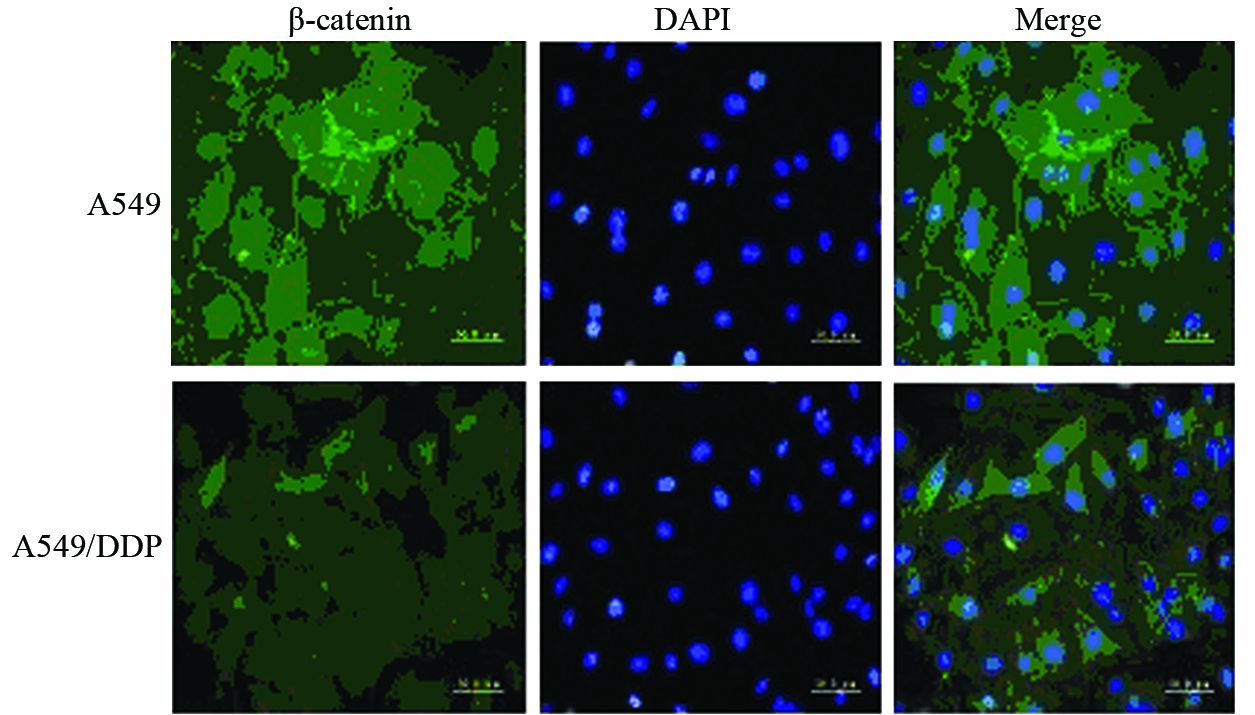
由于β-catenin在细胞中的定位能直接影响Wnt/β-catenin信号转导通路下游靶基因的表达。因此,利用免疫荧光的方法对比检测了A549、A549/DDP细胞中β-catenin的表达定位情况。结果显示,在A549细胞中,β-catenin在胞膜、胞质和胞核中均有表达,以胞膜、胞质表达更为明显;而在A549/DDP细胞中,β-catenin的表达则主要集中在胞质和胞核中,胞膜表达明显减弱,见图 4。
|
| 图 4 A549、A549/DDP细胞中β-catenin定位 表达的变化 (×400) Figure 4 Alteration of location expression of β-catenin in A549 and A549/DDP cells (×400) |
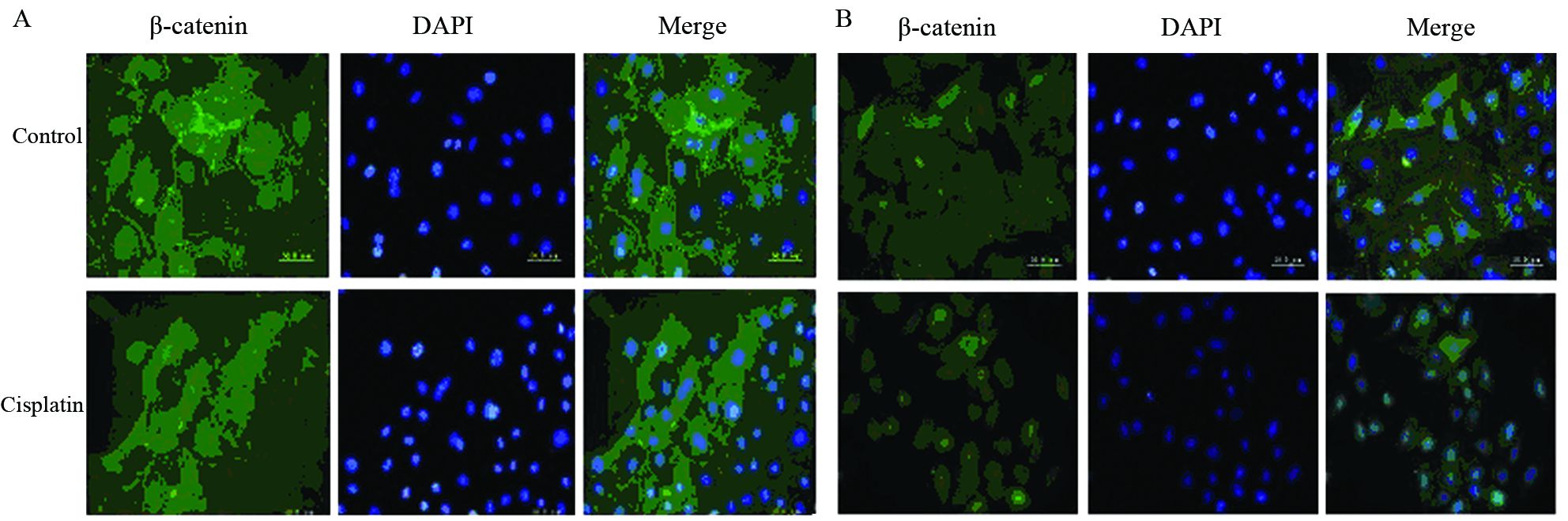
顺铂处理后,A549细胞中β-catenin主要分布在胞膜和胞质中,胞核中分布很少,其定位与顺铂处理前无明显变化;然而,A549/DDP细胞中β-catenin较顺铂处理前出现明显的核移位,见图 5。
|
| A: A549; B: A549/DDP 图 5 顺铂处理后A549、A549/DDP细胞中β-catenin的定位表达的变化 (×400) Fig. 5 Alteration of location expression of β-catenin in A549 and A549/DDP cells treated with cisplatin (×400) |
目前报道的非小细胞肺癌(non-small cell lungcancer,NSCLC)细胞系有十余种,其中绝大部分细胞系经过短期耐药筛选后都可获得耐药株,但获得的耐药株的耐药性不稳定,培养液中需加入药物持续筛选,药物一旦撤除则耐药性可能减低或消失,且获得的耐药性不恒定,每批次获得的细胞的耐药性可能不同;另外一些细胞系虽本身具有很强的耐药性,但缺乏与其遗传背景相似的对照细胞系。因此,本实验选取了目前研究NSCLC耐药机制的标准细胞系——A549(顺铂敏感细胞株)和A549/DDP(顺铂耐药细胞株)。本实验结果显示A549/DDP细胞顺铂耐药性显著强于A549细胞,前者顺铂耐药性是后者的4.92倍,且A549/DDP细胞肺耐药蛋白(lung resistanceprotein,LRP)表达显著高于A549细胞。
GSK-3β是一种多功能的丝氨酸/苏氨酸激酶,是公认的Wnt/β-catenin信号通路中的信号分子,可以直接通过磷酸化作用调节β-catenin的稳定性[8]。在Wnt信号不存在时,细胞质中的β-catenin被GSK-3β等组成的蛋白复合体降解,其过程为β-catenin被GSK-3β磷酸化,启动了胞质中β-catenin聚泛素化而被降解。而Wnt信号的活化抑制了GSK-3β领衔的蛋白复合体的形成,使得GSK-3β对β-catenin的磷酸化作用减弱,结果胞质中大量稳定的低磷酸化β-catenin堆积,并转移到细胞核中与TCF/LEF家族的转录因子结合启动靶基因的转录,如survivin等。即只有胞质中的GSK-3β才会在Wnt/β-catenin信号通路中发挥作用,GSK-3β的胞质定位保证了胞质中的β-catenin不会转入胞核。同时,Wnt/β-catenin信号通路失活时,β-catenin的定位主要在胞质中;Wnt/β-catenin信号通路激活时,β-catenin的定位由胞质转为胞核。
前期实验[9, 10]已经证实在无顺铂刺激时两种细胞之间GSK-3β和β-catenin的表达数量存在差异,即A549/DDP细胞中GSK-3β和β-catenin的表达均高于A549细胞。由于GSK-3β的生物学作用不仅与其活性状态及表达数量相关,更与其胞内定位密切相关。为了验证GSK-3β定位的变化对β-catenin定位的变化及Wnt/β-catenin信号通路活化的影响,本实验继续利用免疫荧光技术对比了A549、A549/DDP细胞中β-catenin的表达定位情况。实验结果验证了我们的猜测:顺铂处理前,两种细胞中的β-catenin主要在胞膜、胞质中表达,仅少量表达于胞核中;顺铂处理后,A549细胞中β-catenin定位表达未发生明显改变,而A549/DDP细胞中的β-catenin表达出现了明显的核转移。说明经顺铂处理后,A549细胞中Wnt/β-catenin信号通路仍处于失活状态,而A549/DDP细胞中Wnt/β-catenin信号通路被激活。
在后续实验中,我们对A549、A549/DDP细胞胞质和胞核中GSK-3β及β-catenin进行了定量分析。结果显示[11],顺铂处理后,A549/DDP细胞质中GSK-3β蛋白的表达下调,细胞核中其表达上调,而A549细胞质中GSK-3β蛋白的表达上调,细胞核中其表达下调;A549细胞核中β-catenin表达显著下调,而A549/DDP细胞核中β-catenin表达显著上调,进一步证实上面所述顺铂可以促进耐药细胞株发生由GSK-3β定位变化引发的胞质β-catenin的核转位。
综上所述,A549和A549/DDP细胞对顺铂耐药性的差异可能由它们中GSK-3β及β-catenin的定位表达差异引起的。肺腺癌顺铂耐药的分子机制可能与GSK-3β胞质和胞核共同定位、β-catenin核转移定位相关。
| [1] | Rayasam GV, Tulasi VK, Sodhi R, et al. Glycogen synthase kinase: more than a namesake[J]. Br J Pharnlacol, 2009, 156(6): 885-98. |
| [2] | Benoit YD, Guezguez B, Boyd AL, et al. Molecular Pathways:pigenetic Modulation of Wnt/Glycogen Synthase Kinase-3ignaling to Target Human Cancer Stem Cells[J]. Clin Canceres, 2014, 20(21): 5372-8. |
| [3] | Cai G, Wang J, Xin X, et al. Phosphorylation of glycogen synthaseinase-3 beta at serine 9 confers cisplatin resistance in ovarianancer cells[J]. Int J Oncol, 2007, 31(3): 657-62. |
| [4] | Beurel E, Kornprobst M, Blivet-Van Eggelpo?l JM, et al. GSK-beta inhibition by lithium confers resistance to chemotherapyinducedpoptosis through the repression of CD95 (Fas/APO-1)xpression[J]. Exp Cell Res, 2004, 300(2): 354-64. |
| [5] | Ding Q, He X, Hsu JM, et al. Degradation of Mcl-1 by beta-TrCPediates glycogen synthase kinase 3-induced tumor suppressionnd chemosensitization[J]. Mol Cell Biol, 2007, 27(11): 4006-17. |
| [6] | Yang L, Li JJ, Zhang YL, et al. Role of GSK-3β activationn responses of colorectal cancer cell to EGFR and IGFR-1nhibiton[J].Zhong Liu Fang Zhi Yan Jiu, 2010, 37(8): 882-5. [杨, 李建军, 张艳玲, 等. 结肠癌细胞中GSK-3β活性对EGFR和GFR-1抑制剂反应性的作用[J]. 肿瘤防治研究, 2010, 37(8):82-5.] |
| [7] | Tan J, Zhuang L, Leong HS, et al. Pharmacologic modulationf glycogen synthase kinase-3beta promotes p53-dependentpoptosis through a direct Bax-mediated mitochondrial pathwayn colorectal cancer cells[J]. Cancer Res, 2005, 65(19): 9012-20. |
| [8] | Polakis P. Wnt signaling in cancer[J]. Cold Spring Harb Perspectiol, 2012, 4 (5). |
| [9] | Xie CY, Gao Y, Zhang XW, et al. Difference of GSK-3βhosphorylation in lung adenocarcinoma cell A549 and itsisplatin resistance subclone A549/DDP[J].Zhonghua Lin Chuangi Shi Za Zhi(Dian Zi Ban), 2013, 7(20): 9194-8. [谢成耀, 高原,秀伟, 等. 肺腺癌细胞A549及其顺铂耐药细胞株A549/DDPGSK-3β蛋白磷酸化水平的差异[J]. 中华临床医师杂志(电子), 2013, 7(20): 9194-8.] |
| [10] | Gao Y, Liu Z, Zhang XW, et al. Mechanism of Wnt/β-cateninignal transduction pathway mediating drug resistance in lungdenocarcinoma[J].Zhonghua Zhong Liu Fang Zhi Za Zhi, 2014,1(11): 805-10. [高原, 刘赞, 张秀伟, 等. Wnt/β-catenin信号转导路与肺腺癌顺铂耐药作用机制研究[J]. 中华肿瘤防治杂志,014,21(11): 805-10.] |
| [11] | Gao Y, Liu Z, Zhang X, et al. Inhibition of cytoplasmic GSK-3βncreases cisplatin resistance through activation of Wnt/β-cateninignaling in A549/DDP cells[J]. Cancer Letters, 2013, 336(1):31-9. |
 2015, Vol. 42
2015, Vol. 42