文章信息
- 胡威, 华胜妮, 肖芦山, 吴德华.
- HU Wei, HUA Shengni, XIAO Lushan, WU Dehua.
- 高迁移率族蛋白1对人鼻咽癌细胞株C666-1体外迁移及侵袭能力的影响
- Effects of High Mobility Group Box-1 Protein on Migration and Invasion Ability of Nasopharyngeal Carcinoma Cell Line C666-1 in vitro
- 肿瘤防治研究, 2015, 42(10): 955-959
- Cancer Research on Prevention and Treatment, 2015, 42(10): 955-959
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.10.001
-
文章历史
- 收稿日期: 2015-02-02
- 修回日期: 2015-07-20
2. 563003 遵义,遵义医学院附属医院胸部肿瘤科;
3. 510515 广州,南方医科大学南方医院感染内科
2. Department of Thoracic Oncology, Affiliated Hospital of Zunyi Medical College, Zunyi 563003, China;
3. Department of Infectious Disease, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China
鼻咽癌(nasopharyngeal carcinoma,NPC)的临床治疗以放射治疗为主,虽疗效显著[1],但仍有部分患者会出现治疗失败,造成这部分患者治疗失败主要原因之一即远处转移[2, 3],因此寻找NPC转移的预测因子和治疗分子靶标显的尤为重要。高迁移率族蛋白1(high mobility group box-1protein,HMGB1)是一类真核细胞核内含量丰富的非组蛋白染色体结合蛋白,多种肿瘤组织中存在HMGB1高表达,提示HMGB1可能参与肿瘤的发生、发展[4, 5, 6],进一步研究证实HMGB1调节多种癌基因的转录,参与调控多种重要的细胞生命活动[7]。本课题组前期的研究表明HMGB1与NPC患者的预后及侵袭、转移等临床特征相关[8],但HMGB1是否直接驱动NPC的侵袭及转移尚不明确,本研究拟初步探讨HMGB1对体外NPC细胞株C666-1迁移及侵袭能力的影响和可能的机制,为能否将HMGB1作为NPC转移预测分子和分子靶标提供一定的思路。
1 材料和方法 1.1 材料及试剂人鼻咽癌细胞株C666-1来源于南方医科大学肿瘤研究所,细胞培养用胎牛血清购自BD公司,RPMI 1640培养液购自美国Gibco公司;瞬时转染试剂Lipofectamine RNAiMAX购自美国LifeTechnologies公司;siHMGB1及siNC由上海吉玛公司合成(siHMGB1 RNA Oligo:正义链5’-3’CCCGUUAUGAAAGAGAAAUTT和反义链5’-3’AUUUCUCUUUCAUAACGGGTT;siNC RNAOligo:正义链5’-3’UUCUCCGAACGUGUCACGUTT和反义链5’-3’ACGUGACACGUUCGGAGAATT);Transwell小室购于美国Corning公司,Matrigel胶购于美国BD公司;PVDF膜、发光液、Western blot电泳系统为美国Bio-Rad公司产品;BCA蛋白浓度测定试剂盒及蛋白Marker、loadingbuffer购自美国Thermo Fisher Scientific公司,封闭用脱脂奶粉购自广州威佳科技有限公司,MMP2及MMP2、β-actin单克隆抗体购自美国Bio-world公司;HMGB1单克隆抗体及羊抗兔、抗鼠二抗购自美国Abcam公司。
1.2 方法 1.2.1 细胞培养人细胞株C666-1用含10%胎牛血清的RPMI 1640培养液培养,并置于37℃、5%CO2培养箱内,倒置显微镜观察细胞生长状态,间隔1~2天更换培养液,细胞生长至80%左右消化传代。生长状态良好的细胞用于实验。
1.2.2 siRNA瞬时转染取状态良好的细胞,转染前一天晚铺6孔板,细胞密度约为30%~40%,并确保细胞均匀铺于板底;第二天待细胞贴壁后即进行siRNA转染,先将各5 μl siRNA和iMAX分别稀释于250 μl Opti-MEN中,冰上孵育5 min,然后将两者混匀,静置20 min,加至残留有1.5 ml培养液的6孔板中,置入培养箱中培养待后续实验。转染siHMGB1 48 h Western blot验证干扰效率,取干扰成功并状态良好的细胞用于后续实验。
1.2.3 细胞划痕试验取生长良好、空白对照(Blank)、干扰HMGB1(siHMGB1)及阴性对照(siNC)的C666-1细胞,调整细胞浓度为每毫升1×105,按照每孔100 μl接种细胞于6孔板中培养,待细胞长满培养皿,用200 μl微量移液头在6孔板上纵轴直线划痕,PBS轻柔洗涤细胞以去除漂浮细胞。沿划痕边缘作5处等距离标记为数据测定点。分别于0和24 h倒置显微镜下测量。相差显微镜测量各组细胞划痕宽度,并比较划痕宽度。实验重复三次。
1.2.4 Transwell实验预先将Matrigel胶(1:8)铺于Transwell小室上室底部滤膜上以模拟基底膜和细胞外基质,取成功干扰HMGB1对数期、生长良好的C666-1细胞,调整细胞浓度为每毫升1×105,Transwell上室每孔加入200 μl的细胞悬液,150 μl含10%血清的RPMI 1640培养液加入Transwell下室作趋化因子,37℃、5%CO2培养箱培养24 h,吸去上、下室培养液,棉签小心拭去滤膜上室面的Matrigel胶及细胞,将侵袭并黏附到滤膜下室面上的细胞用4%甲醇固定。0.1%的结晶紫染色、中性树脂封片,倒置显微镜(×200)观察穿膜细胞数。每张膜取5个视野,取均值作为评价细胞侵袭能力的指标。实验重复3次。
1.2.5 Western blot实验取瞬时转染48 h之后的细胞,PBS洗3遍,加入配置好的RIPA细胞裂解液充分裂解(含RIPA:100×CK:100×磷酸酶抑制剂为100:1:1)。裂解液置于EP管中,漩涡振荡器三次,每次15 s,间隔10 min,12 000g,4℃离心15 min,上清液转移至新的EP管中。BCA蛋白定量试剂盒测定蛋白浓度,按照蛋白样品的浓度计算出30 μg样品的上样体积,用裂解液将样品体积配齐,按照蛋白样品与5×SDS loading buffer体积比为4:1制备上样缓冲液,95℃水浴锅煮8 min变性。 配置10%的聚丙烯酰胺凝胶,按计算体积上样,依次80 V,30min及100 V,90 min恒压电泳,250 mA,120 min恒流转膜,5%脱脂奶粉封闭1 h,加入相应一抗,稀释比例:HMGB1(1:1 000),MMP2(1:1 000),MMP9(1:500),β-actin(1:4 000),4℃过夜,TBST洗10 min×3遍,加入适当比例稀释的二抗,室温孵育1 h,TBST洗10 min×3遍,暗室曝光,洗片。实验重复三次。
1.3 统计学方法采用SPSS16.0软件进行统计分析,多组间比较采用方差分析,所有数值变量用(x±s)表示,两两比较采用LSD方法进行,P<0.05为差异有统计学意义。
2 结果 2.1 干扰HMGB1对NPC细胞株C666-1迁移的影响C666-1细胞转染siHMGB1和siNC后48 h Westernblot验证siHMGB1组干扰效率较好,同期行划痕实验,结果显示Blank及siNC组差异无统计学意义,相比siNC组,8及20 h siHMGB1组细胞迁移能力明显下降(P均=0.000),见图 1。
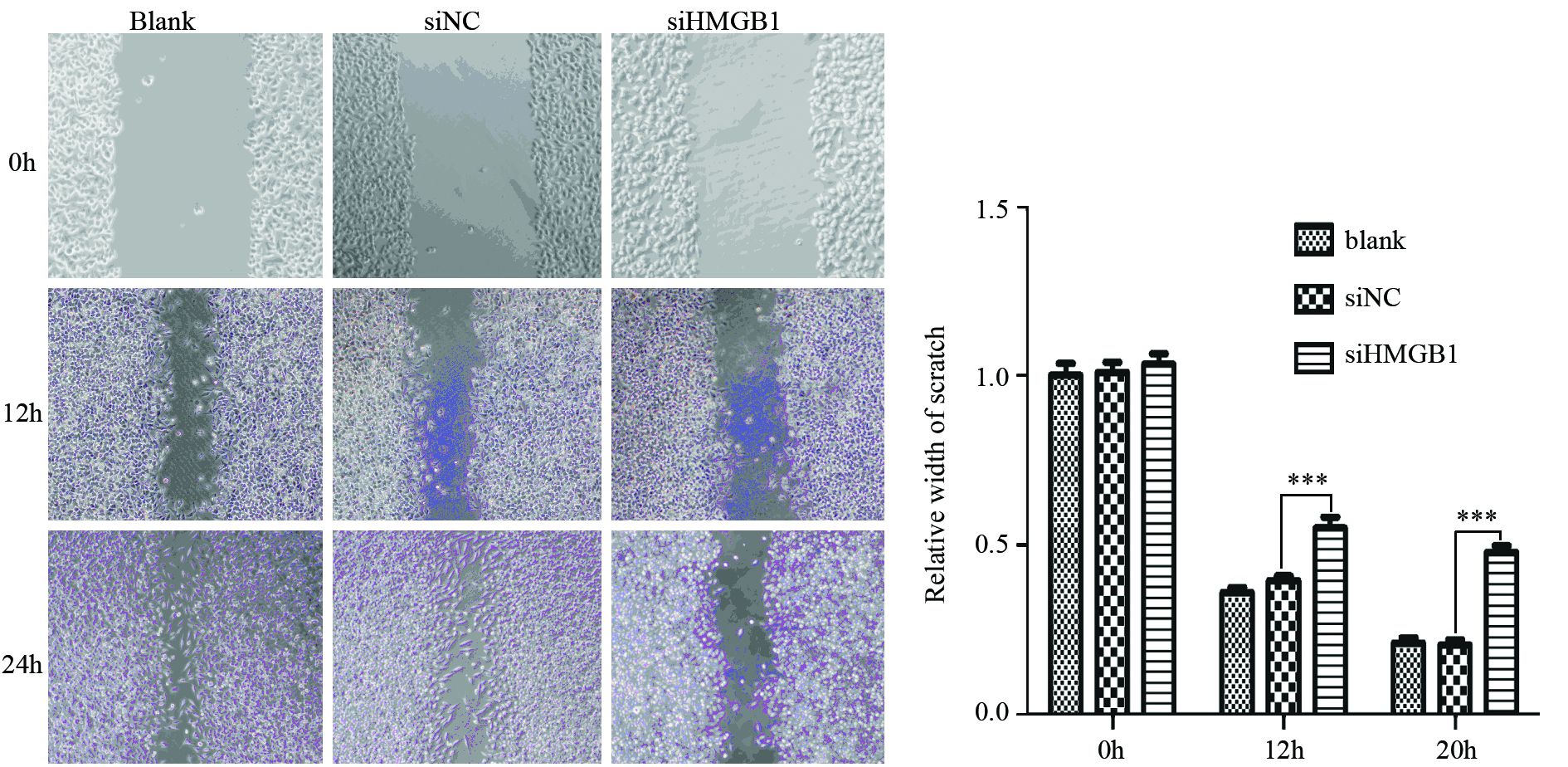
|
| ***: P all=0.000, compared with the siNC group 图 1 siHMGB1抑制NPC细胞株C666-1的迁移 Figure 1 siHMGB1 inhibited migration of nasopharyngeal carcinoma(NPC) cell line C666-1 |
Transwell的结果显示:Blank组及siNC组差异无统计学意义(P=0.871),相比siNC,siHMGB1明显抑制C666-1细胞的侵袭(P=0.000),见图 2。

|
| 1: blank group; 2: siNC group; 3: siHMGB1 group; ***: P=0.000, compared with the siNC group 图 2 siHMGB1抑制NPC细胞株C666-1的侵袭 Figure 2 siHMGB1 inhibited invasion of NPC cell line C666-1 |
Western blot对侵袭转移相关蛋白MMP2、MMP9检测结果:干扰HMGB1后侵袭转移相关蛋白MMP2水平明显下降(P=0.000),但MMP9水平未见明显变化,见图 3。
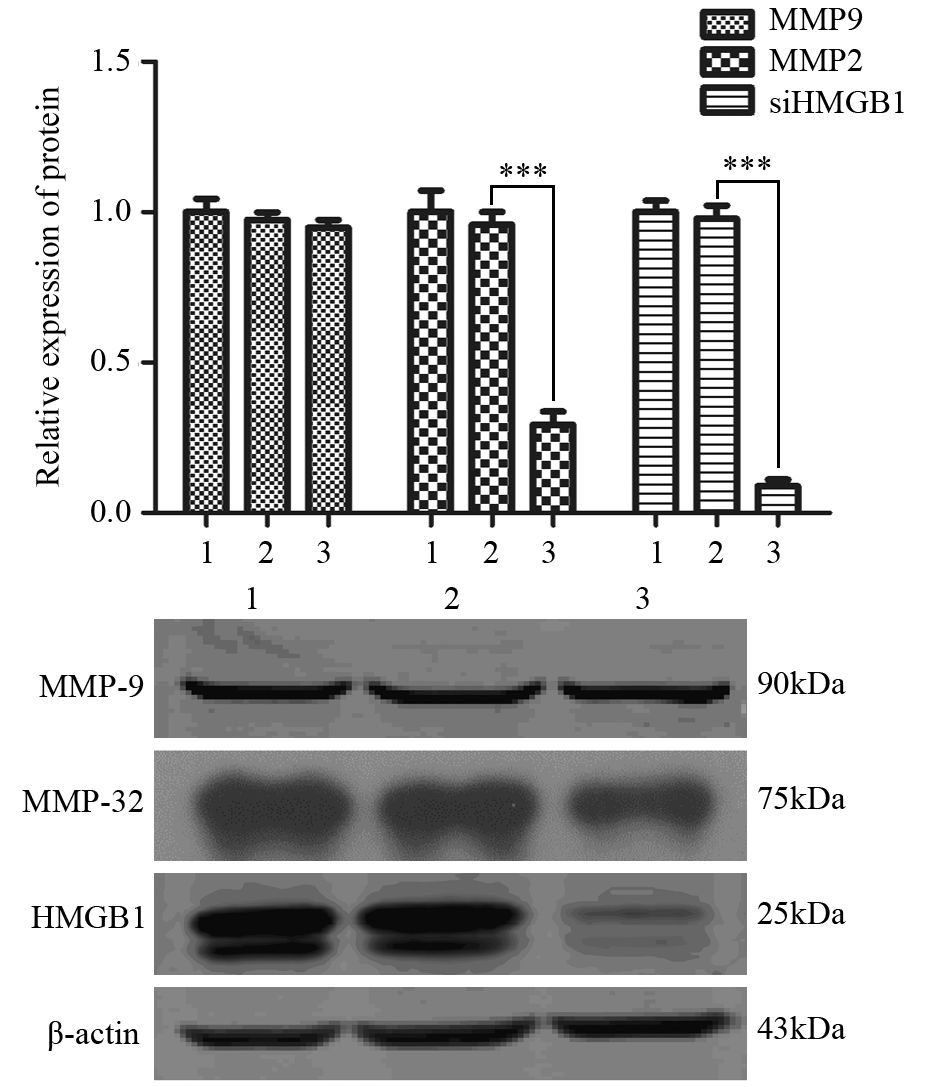
|
| 1: blank group; 2: siNC group; 3: siHMGB1 group; ***: P all=0.000 图 3 siHMGB1抑制NPC C666-1细胞株侵袭转移相关蛋白 MMP2的表达 Figure 3 siHMGB1 inhibited invasion-related protein MMP2 expression in NPC cell line C666-1 |
NPC发病与遗传、EB病毒感染、环境等多种因素相关,好发于我国南方沿海,是我国肿瘤学专家关注的热点[1, 2]。近年来随着精确放射治疗技术的不断提高,其治疗水平稳步提升,5年生存率达74%[1],尽管如此,仍有部分患者会出现治疗的失败,治疗后早期内出现远处转移是造成这部分患者治疗失败的主要原因之一[2],因此转移相关分子标志物及分子靶标的开发和利用成为了研究的焦点,如nm23、c-MYC等[8, 9]。但目前这些指标仍有限,本研究目的即探寻该类分子标志物,并探讨他们在NPC侵袭、转移中的作用,为临床个体化治疗提供更多的抉择思路和选择。
HMGB1作为一种非组蛋白染色质结合蛋白,能够调节多种基因的转录,参与炎性反应,增殖等重要的细胞生命活动[7],在多种肿瘤,如结肠癌、肝癌、胃癌、脑胶质瘤,喉癌中高表达[4, 5, 6],本课题组前期研究也表明[8]:HMGB1高表达组NPC患者预后明显差于低表达组,且HMGB1高表达与患者鼻咽癌侵袭及转移密切相关[8]。这提示HMGB1可能参与肿瘤的发生、发展。进一步研究证实:肿瘤细胞内高表达的HMGB1或肿瘤细胞坏死所释放HMGB1以及被激活的免疫细胞主动分泌的HMGB1可同肿瘤细胞RAGE结合,促进自身及周围肿瘤细胞的增殖及转移,甚至介导肿瘤细胞的放疗抵抗[7, 10]。此外,分泌型HMGB1还可以刺激肿瘤微环境中其他细胞产生复杂的生物学效应,介导炎性反应及肿瘤血管生成等,促进肿瘤的发生及发展[11]。本研究结果显示:干扰HMGB1后NPC C666-1细胞株迁移及侵袭能力明显下降,表明HMGB1在NPC的侵袭、转移中亦扮演着重要的角色,这与之前的结论相似。
基质金属蛋白酶(matrix metalloproteinases,MMP)家族蛋白MMP2及MMP9由肿瘤细胞分泌,直接作用并降解基底膜,促进肿瘤转移,是肿瘤细胞侵袭能力的重要标记分子[12],其受ERK、JAK/STAT、NF-κB等多条信号转导通路调控[13, 14, 15]。当前研究表明:HMGB1可活化JAK/STAT通路,过度活化的STAT3转录调控细胞凋亡及细胞周期,促进肿瘤细胞增殖、转移[16, 17];另外HMGB1与RAGE结合后,可以直接激活ERK1/2,NF-κB,JNK,Rac等多条介导肿瘤细胞发生上皮间质化和侵袭转移的重要信号通路[18, 19]。此外,HMGB1还可以与Toll样受体TLR2和TLR4结合,间接活化NF-κB,从而促进肿瘤的转移[20, 21]。但HMGB1是否直接通过MMP2及MMP9影响NPC侵袭、转移能力的变化未见报道。本实验研究的结果表明干扰HMGB1后肿瘤侵袭相关蛋白MMP2表达明显下降,而MMP9水平未见变化,这提示HMGB1可驱动NPC C666-1细胞迁移及侵袭可能部分通过MMP2介导。当然具体的信号转导途径还有待更深入探讨。
综合上述结论,有理由认为: 需要围绕HMGB1进行更为深入、系统的基础及临床研究,为将HMGB1作为NPC早期转移的重要的分子标志物及靶向治疗靶标奠定坚实的理论及实践基础,造福我国广大的鼻咽癌患者。
| [1] | Wei WI, Sham JS T. Nasopharyngeal carcinoma[J]. Lancet, 2005, 365(94): 2041-54. |
| [2] | Tang LL, Sun Y, Mao YP, et al. Prognostic value of parapharyngeal extension in nasopharyngeal carcinoma treated with intensity modulated radiotherapy[J]. Radiother Oncol, 2014, 110(3): 404-8. |
| [3] | Mao YP, Zhou GQ, Liu LZ, et al. Comparison of radiological and clinical features of temporal lobe necrosis in nasopharyngeal carcinoma patients treated with 2D radiotherapy or intensitymodulated radiotherapy[J]. Br J Cancer, 2014, 110 (11): 2633-9. |
| [4] | Zhao CB, Bao JM, Lu YJ, et al. Co-expression of RAGE and HMGB1 is associated with cancer progression and poor patient outcome of prostate cancer[J]. Am J Cancer Res, 2014, 4(4): 369-77. |
| [5] | Yang GL, Zhang LH, Bo JJ, et al Increased expression of HMGB1 is associated with poor prognosis in human bladder cancer[J]. J Surg Oncol, 2012, 106(1): 57-61. |
| [6] | Qiu G, Li Y, Liu Z, et al. Clinical value of serum HMGB1 in diagnosis and prognosis of laryngeal squamous cell carcinoma[J]. Med Oncol, 2014, 31(12): 316. |
| [7] | Bald T, Quast T, Landsberg J, et al. Ultraviolet-radiationinduced inflammation promotes angiotropism and metastasis in melanoma[J]. Nature, 2014, 507 (7490): 109-13. |
| [8] | Wu D, Ding Y, Wang S, et al. Increased expression of high mobility group box 1 (HMGB1) is associated with progression and poor prognosis in human nasopharyngeal carcinoma[J]. J Pathol, 2008, 216(2): 167-75. |
| [9] | Yang J, Zhou M, Zhao R, et al. Identification of candidate biomarkers for the early detection of nasopharyngeal carcinoma by quantitative proteomic analysis[J]. J Proteomics, 2014, 109: 162-75. |
| [10] | Kostova N, Zlateva S, Ugrinova I, et al. The expression of HMGB1 protein and its receptor RAGE in human malignant tumors[J]. Mol Cell Biochem, 2010, 337(1-2): 251-8. |
| [11] | Pusterla T, Nèmeth J, Stein I, et al. Receptor for advanced glycation endproducts (RAGE) is a key regulator of oval cell activation and inflammation-associated liver carcinogenesis in mice[J]. Hepatology, 2013, 58(1): 363-73. |
| [12] | Sun W, Liu DB, Li WW, et al. Interleukin-6 promotes the migration and invasion of nasopharyngeal carcinoma cell lines and upregulates the expression of MMP-2 and MMP-9[J]. Int J Oncol, 2014, 44(5): 1551-60. |
| [13] | Chien SY, Hsieh MJ, Chen CJ, et al. Nobiletin inhibits invasion and migration of human nasopharyngeal carcinoma cell lines by involving ERK1/2 and transcriptional inhibition of MMP-2[J]. Expert Opin Ther Targets, 2015, 19(3): 307-20. |
| [14] | Jeong YJ, Shin JM, Bae YS, et al. Melittin has a chondroprotective effect by inhibiting MMP-1 and MMP-8 expressions via blocking NF-κB and AP-1 signaling pathway in chondrocytes[J]. Int Immunopharmacol, 2015, 25(2): 400-5. |
| [15] | Hu A, Huang JJ, Jin XJ, et al. Curcumin suppresses invasiveness and vasculogenic mimicry of squamous cell carcinoma of the larynx through the inhibition of JAK-2/STAT-3 signaling pathway[J]. Am J Cancer Res, 2014, 5(1): 278-88. |
| [16] | Wagner KU, Schmidt JW. The two faces of Janus kinases and their respective STATs in mammary gland development and cancer[J]. Carcinog, 2011, 10: 32. |
| [17] | Slattery ML, Lundgreen A, Kadlubar SA, et al. JAK/STAT/SOCSsignaling pathway and colon and rectal cancer[J]. Mol Carcinog, 2013, 52(2):155-66. |
| [18] | Liu H, Yao YM, Yu Y, et al. Role of Janus kinase/signal transducer and activator of transcription pathway in regulation of expression and inflammation-promoting activity of high mobility group box protein 1 in rat peritoneal macrophages[J]. Shock, 2007, 27 (1): 55-60. |
| [19] | Feng XJ, Liu SX, Wu C, et al. The PTEN/PI3K/Akt signaling pathway mediates HMGB1-induced cell proliferation by regulating the NF-kappaB/cyclin D1 pathway in mouse mesangial cells[J]. Am J Physiol Cell Physiol, 2014, 306(12): C1119-28. |
| [20] | Xu X, Zhu H, Wang T, et al. Exogenous high-mobility group box 1 inhibits apoptosis and promotes the proliferation of lewis cells via RAGE/TLR4-dependent signal pathways[J]. Scand J Immunol, 2014, 79(6): 386-94. |
| [21] | Agalave NM, Larsson M, Abdelmoaty S, et al. Spinal HMGB1 induces TLR4-mediated long-lasting hypersensitivity and glial activation and regulates pain-like behavior in experimental arthritis[J]. Pain, 2014, 155 (9): 1802-13. |
 2015, Vol. 42
2015, Vol. 42


