文章信息
- 陈海霞,王维娜,赵峰,王翠翠. 2015.
- 原发性子宫内膜小细胞癌伴腺鳞癌1例并文献复习
- 肿瘤防治研究, 2015, 42(01): 93-95
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.01.023
-
文章历史
- 收稿日期:2013-12-26
- 修回日期:2014-07-22
女性生殖系统小细胞癌少见,占所有妇科 恶性肿瘤比例不足2%,多见于宫颈,也可发生 于卵巢、输卵管、阴道和外阴等部位[1]。而原发 于子宫内膜的小细胞癌(small cell carcincma of endometrium,SCCE)罕见,占所有子宫内膜癌的 1%以下,属于子宫内膜癌的特殊类型。该肿瘤恶 性程度高,侵袭性强,易发生局部浸润和远处转 移,预后差,大多数患者在诊断后1年内死亡[2]。 本文回顾性分析了1例原发性子宫内膜小细胞癌伴 腺鳞癌并进行了相关文献复习。 1 资料与方法 1.1 病例资料
患者女性,58岁,维吾尔族,绝经10年后不 规则阴道流血1月就诊。既往月经规律:4~5天/30 天,孕3产2。妇科检查:子宫中位,稍大。外院 行宫内容物诊刮术,病理结果示:高分化鳞状细 胞癌。2012年11月6日到新疆医科大学附属肿瘤医 院会诊(宫腔内容物):高分化鳞状细胞癌,部 分肿瘤分化较差,低分化癌或肉瘤不能除外。临 床检查肿瘤标志物CA125、CA199、CEA及AFP均 正常。胸部X线检查未见异常。B型超声示子宫内 膜增厚(提示子宫内膜癌)。盆腔核磁共振成像 (magnatic resonance imaging,MRI):子宫内膜 癌,累及子宫壁全层,盆腔及腹膜后淋巴结无肿 大,见图 1。2012年11月19日行全子宫+双侧附件 切除术+盆腔及腹主动脉旁淋巴结清扫术,术中见 子宫稍大,表面光滑,双侧附件萎缩,外观未见 明显异常,大网膜、肝脾、结肠旁沟及腹腔表面 光滑,盆腔及腹主动脉未见肿大淋巴结。

|
| 图 1 盆腔MRI显示:子宫内膜癌,肿瘤侵及子宫壁全层 Figure 1 Pelvic MRI showed the carcinoma of endometrium and tumor cells extended to the whole layer of the uterine |
标本经10%中性福尔马林固定,常规脱水,石 蜡包埋,4 μm厚切片,苏木精-伊红(HE)染色。免疫组织化学染色采用EnVision两步法。所有抗体包 括AE1/AE3、CK7、CK5/6、p63、CD56、Syn、 CgA、p53、Ki67指数、ER、PR、Vimentin、 CD10、S-100蛋白和LCA等均购自北京中杉金桥生 物有限公司。 2 结果 2.1 大体检查
子宫大小9.8 cm×7.0 cm×5.0 cm,宫腔内见2.5 cm× 1.5 cm息肉状肿块,表面光滑,切面实性,灰白, 质地细腻,与子宫肌层界限不清;周围宫内膜略 粗糙,呈细乳头状,宫颈、双侧输卵管及卵巢未 见异常。 2.2 光学显微镜检查
大部分肿瘤细胞体积小至中等大,胞质少, 呈实性片状、巢状和条索状分布,部分小细胞围 绕血管排列,见图 2A,细胞核呈短梭形,染色质 粗,核仁不明显,核分裂相>10个/HPF,伴有灶 状坏死,肿瘤侵及子宫深肌层和浆膜层,脉管内可 见癌栓;黏膜层见部分肿瘤细胞呈腺管状排列, 腺体拥挤呈筛状,背靠背,间质消失,细胞核大, 核不规则,泡状核,可见核仁,部分肿瘤细胞呈实 性巢状分布,细胞核大,异型明显,可见细胞间桥 和角化珠形成;肿瘤细胞由三种成分组成,黏膜层 内小细胞癌和宫内膜样腺癌及鳞状细胞癌三种成 分混合存在,三者之间有移行过程,见图 2B~C。

|
| A: the vessel was surrounded by small cells; B: small cell carcinoma of endometrium with endometrioid adenocarcinoma; C: small cell carcinoma of endometrium with squamous cell carcinoma 图 2 子宫内膜小细胞癌的形态学特征(HE ×200) Figure 2 Morphological features of small cell carcinoma of endometrium(HE ×200) |
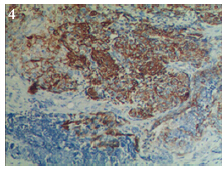
小细胞癌成分CD56、Syn弥漫阳性,见图 3, CgA、AE1/AE3灶阳性,p53阳性,Ki67阳性指数 >95%;子宫内膜样腺癌成分AE1/AE3、CK7、p53、Vimentin、ER、PR阳性,Ki67阳性指数> 95%;鳞状细胞癌成分AE1/AE3、CK7、p63、 p53、CK5/6阳性,见图 4,Ki67阳性指数为30%, 见表 1。

|
| 图 3 SCCE中Syn弥漫阳性表达(EnVision两步法 ×200) Figure 3 Diffuse and positive expression of synaptophysin in small cell carcinoma of endometrium (EnVision two-step method ×200) |
|
| 图 4 鳞状细胞癌CK5/6阳性表达(EnVision两步法 ×200) Figure 4 Positive expression of high molecular weight cytokeratin (CK5/6) in squamous cell carcinoma (EnVision two-step method ×200) |
 |
子宫内膜小细胞癌伴腺鳞癌,小细胞癌成分侵 及宫体深肌层和浆膜层,脉管内可见癌栓;子宫腺 肌症;慢性宫颈炎;双附件未见肿瘤侵犯;腹主动 脉旁、双侧腹股沟及盆腔各组淋巴结未见癌转移。 2.5 转归
临床病理分期ⅢA期,行静脉化疗三周期后,再 行体外盆腔调强放疗二周期,一般情况良好,无瘤生 存12月。 3 讨论
小细胞癌是分化很差的神经内分泌癌,好 发于肺,而肺外小细胞癌少见,占小细胞癌的 2.5%~5%,可发生于胃肠、生殖系统、食管及乳 腺等[3]。目前被广泛认可的观点是小细胞癌起源 于多能干细胞,之后发展为具有神经内分泌特征 的肿瘤,而不是来源于摄取胺前体与脱羧(amine precursor uptake and decarboxylation,APUD)的细 胞[4]。Olson等[5]在1982年首次报道SCCE,迄今为 止,国内外文献共报道了80余例,且多为个案报 道,缺乏大样本的研究。 3.1 临床特点
SCCE发病年龄为23~78岁,平均年龄60岁[1]。 大部分患者为已产两次或两次以上者,仅有1例 SCCE患者是未产妇[2]。多数患者临床表现为绝 经后不规则阴道出血[1]、腹痛、腹部包块等[6] 。 Chuang等[7]报道1例绝经后SCCE患者,临床表现以 盆腔炎为首发症状,有时盆腔炎症和肿瘤的症状 相互掩盖,需要通过全面的妇科检查、影像诊断和 肿瘤标志物检查来加以证实。Ju等[8]报道子宫内膜 小细胞癌伴有副肿瘤综合征,由于肿瘤细胞产生的 激素或血清抗体增加导致的神经内分泌紊乱,引 起眼视觉障碍。Huntsman等[9]报道SCCE恶性程度 高、疾病进展迅速,易转移至阴道、肾上腺、淋巴 结、骨、肺和脑等部位。本组患者仅表现为绝经后 阴道流血,未出现副肿瘤综合征和远处转移。 3.2 病理特点
大体检查宫腔内见息肉样肿块,切面实性, 灰白、质脆,肿瘤与肌层界限不清。若合并其他 成分的子宫内膜恶性肿瘤,两者分界清楚或穿插 生长。光学显微镜检查肿瘤细胞体积较小至中 等大,胞质少,呈实性片状、巢状或条索状分 布,细胞核短梭形、卵圆形或不规则形,核染色 质粗,核仁不明显,核分裂相多见,并见灶状坏 死。Huntsman等[9]报道16例SCCE患者中有10例核 分裂相>10个/HPF。研究发现SCCE易合并其他类 型子宫内膜恶性肿瘤,单纯SCCE占子宫恶性肿瘤 的35.9%(14/39),而合并宫内膜样腺癌和腺鳞 癌者占53.8%(21/39)[6]。van等[10]报道SCCE合并 的其他恶性肿瘤成分多位于子宫内膜浅层,而浸 润性肿瘤成分为小细胞癌。Meirmanov等[6]发现小 细胞癌易浸润子宫深肌层和侵犯脉管。本例报道SCCE合并宫内膜样腺癌和鳞状细胞癌,其中以小 细胞癌成分为主,三种肿瘤成分有移行过程,提 示小细胞癌的发生与其组织起源于多能干细胞或 子宫内膜癌细胞向神经内分泌分化有关。从肿瘤 浸润深度和范围来看,小细胞癌成分比宫内膜样 腺癌和鳞状细胞癌成分更深、更广泛,因此SCCE 的生物学行为比宫内膜样腺癌和鳞状细胞癌的恶 性程度高。 3.3 免疫组织化学检测特点
免疫组织化学方法检测具有神经内分泌特征 的标志物如NSE,Syn、CgA、CD56等,至少有 一种或两种以上的标志物阳性,是诊断SCCE的重 要依据。Huntsman等[9]报道SCCE中NSE、CgA阳 性,Syn阴性;van等[10]报道SCCE中NSE、 CgA、 Syn均阳性。本组病例中CD56、Syn呈弥漫强阳 性,CgA局灶阳性,提示肿瘤细胞具有神经内分 泌的特征,与文献报道一致。 3.4 诊断及鉴别诊断
van等[10]提出子宫内膜小细胞癌的诊断标准: (1)必须有明确的原发子宫内膜的证据,排除其 他部位小细胞癌的侵犯或转移;(2)可见小至中 等大小肿瘤细胞的实性、片状生长,合并或不合 并其他肿瘤亚型成分;(3)免疫组织化学检测肿 瘤细胞至少有1种神经内分泌标志物阳性。当与以 下几种肿瘤进行鉴别诊断:(1)子宫内膜间质 肉瘤:好发于中年女性,平均年龄39~58岁。大 体宫腔内可见结节状病变,切面黄色或黄褐色, 部分区域可见坏死及囊性变,质软。镜下肿瘤细 胞均匀一致,短梭形,胞质稀少,核分裂相≥10 个/10HPF,其间可见较多均匀分布的小血管,瘤细 胞围绕小血管弥漫密集排列。部分病例可出现性 索样结构,子宫内膜样腺体及平滑肌分化等。网 状纤维染色及免疫组织化学标志CD10阳性,而 CD56、Syn、CgA均阴性,有助于鉴别。(2) 恶性中胚叶混合瘤:好发于绝经后老年女性,中 位年龄65岁,表现为阴道流血,腹部肿物及腹痛 等。大体宫腔内可见息肉样包块,表面见出血及 坏死,肿瘤易侵犯子宫肌层,有时见软骨及骨样 成分,质硬。镜下肿瘤细胞由上皮和间叶两种成 分组成,上皮成分多见于腺癌、鳞癌或未分化 癌,间叶成分可以是同源性如平滑肌,也可为异 源性如横纹肌、软骨组织或骨组织,免疫组织化 学标记AE1/AE3、Vimentin、S-100蛋白均阳性, 而CD56、Syn、CgA均阴性,有助于鉴别。(3) 非霍奇金淋巴瘤: 肿瘤细胞体积小,成分单一, 细胞核圆形或卵圆形,呈弥漫分布时易误诊为非 霍奇金淋巴瘤,免疫组织化学小细胞癌CD56、 Syn、CgA均阳性,而LCA阴性,有助于鉴别。 3.5 治疗与预后
关于SCCE治疗,目前主要采用广泛手术切除 术,辅以放疗、化疗及内分泌治疗。Verschraegen等[11]报道生长抑素对于SCCE化疗耐药、放疗无效 的复发病例治疗效果较好,为SCCE的治疗提供了 新的思路。SCCE恶性程度高、易发生远处转移, 而国内外文献关于预后报道结果不尽相同,最短 1例仅存活了8天,最长1例无瘤生存9年,大多数 病例报道生存期在1年左右。综合文献报道82例, Ⅰ~Ⅱ期共30例,Ⅲ~Ⅳ期共40例,未分期的为12 例,其中Ⅰ~Ⅱ期生存期为2~113月,Ⅲ~Ⅳ期生存 期3~72月。4例无病生存期为102、108、108、113 月者均为Ⅰ期患者,其中2例行手术+化疗,2例 行手术+化疗+放疗,提示肿瘤的分期和治疗方案 与疾病预后有关,因此早期诊断可改善患者的预 后。Albores等[12]报道了2例SCCE,大体表现为息 肉状肿块,临床分期ⅠA期,术后无瘤生存48月, 认为息肉状肿块预后良好。本组病例大体表现为 息肉状肿块,临床分期为ⅢA期,术后辅助化疗和 放疗等联合治疗后,一般情况良好。随访12月, 无复发和转移,有待进一步观察。
| [1] | Crowder S, Tuller E. Small cell carcinoma of the female genital tract[J]. Semin Oncol, 2007, 34(1): 57-63 . |
| [2] | Katahira A, Akahira J, Niikura H, et al. Small cell carcinoma of endometrium: report of three cases and literature review[J] . Int J Gynecol Cancer, 2004, 14(5): 1018-23. |
| [3] | Wong YN, Jack RH, Mak V, et al. The epidemiology and survival of extrapulmonary small cell carcinoma in South East England 1970–2004[J]. BMC Cancer, 2009, 9: 209. |
| [4] | Lee SS, Ha HK, Min YI, et al. Primary extrapulmonary small cell carcinoma involving the stomach or duodenum or both: findings on CT and barium studies[J]. Am J Roentgenol, 2003, 180(5): 1325-9. |
| [5] | Olson N, Twiggs L, Sibley R, et al. Small cell carcinoma of endometrium: light microscopic and ultrastructural study of a case[J]. Cancer, 1982, 50(4): 760-5. |
| [6] | Meirmanov S, Nakashima M, Rogounovitch T, et al. Small cell carcinoma of the endometrium: report of a case with analysis of Wnt/beta catenin pathway[J]. Pathol Res Pract, 2003, 199 (8): 551-8. |
| [7] | Chuang J, Chu CC, Hwang JL, et al. Small cell carcinoma of the endometrium with concomitant pelvic inflammatory disease[J]. Arch Gynecol Obstet, 2002, 266(3): 178-80. |
| [8] | Ju W, Park IA, Kim SH, et al. Small cell carcinoma of the uterine corpus manifesting with visual dysfunction[J]. Gynecol Oncol, 2005, 99(2): 504-6. |
| [9] | Huntsman DG, Clement PB, Gilks CB, et al. Small-cell carcinoma of the endometrium. A clinicolpathological study of sixteen cases[J]. Am J Surg Pathol, 1994, 18(4): 364-75. |
| [10] | van Hoeven KH, Hudock JA, Woodruff JM, et a1. Small cell neuroendocrine carcinoma of the endometrium[J]. Int J Gynecol Pathol, 1995, 14(1): 21-9. |
| [11] | Verschraegen CF, Matei C, Loyer E, et al. Octreotide induced remission of the refractory small cell carcinoma of the endometrium[J]. Int J Gynecol Cancer, 1999, 9(1): 80-5. |
| [12] | Albores-Saavedra J, Martinez-Benitez B, Luevano E. Small cell carcinoma and large cell neuroendocrine carcinoma of the endometrium and cervix: polypoid tumors and those arising in polys may have a favorable prognosis[J]. Int J Gynecol Pathol, 2008, 27(3): 333-9. |
 2015, Vol. 42
2015, Vol. 42