文章信息
- 石新丽,张硕,丁娜娜,李明远. 2015.
- SHI Xinli, ZHANG Shuo, DING Nana, LI Mingyuan. 2015.
- 肿瘤治疗中Clostridium novyi-NT的研究
- Clostridium novyi-NT in Cancer Therapy
- 肿瘤防治研究, 2015, 42(01): 74-77
- Cancer Research on Prevention and Treatment, 2015, 42(01): 74-77
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.01.018
-
文章历史
- 收稿日期:2014-05-05
- 修回日期:2014-09-09
2. 050200 石家庄,河北中医学院;
3. 050017 石家 庄,河北医科大学 河北省重大疾病的免疫机制及干预重 点实验室
2. Hebei University of Chinese Medicine, Shijiazhuang 050200, China;
3. Key Laboratory of Immune Mechanism and Intervention on Serious Disease in Hebei Province, Hebei Medical University, Shijiazhuang 050017, China
肿瘤位列致人类死亡因素的第二位,肿瘤的治疗是医学界当今面临的巨大挑战。手术、放疗和化疗等传统疗法常伴有耐药、放射抗拒,最终导致肿瘤复发、转移,甚至患者死亡,因而制约了肿瘤的临床治疗效果。细菌或经基因改造后的工程菌能抑制肿瘤生长,一方面可发挥直接溶瘤作用;另一方面,也可作为肿瘤基因治疗载体而递呈肿瘤杀伤分子,即细菌介导的肿瘤基因治疗(bacteria-mediatedcancergenetherapy)。由于肿瘤发病机制复杂,只采用某一种疗法很难完全消除肿瘤。现有研究证明,在传统的化疗或放疗的治疗过程中,辅之以活菌治疗可减少放化疗剂量、减轻对正常组织的损伤、增强疗效。双歧杆菌属(Bifodobacterium)、沙门菌属(Salmonella)和梭状芽胞菌属(Clostridium)的细菌均可在实体瘤中复制。本文就梭状芽胞菌属在抗肿瘤治疗方面作如下综述。 1 梭状芽胞菌治疗肿瘤的历史性回顾梭状芽胞菌是广泛存在土壤和动物及人肠道中的G+细菌。1947年,Parker等[1]首次发现了梭状芽胞菌的溶瘤作用,当时称之为液化作用,但难以将致病菌株应用于人类肿瘤治疗。首先成功分离到的梭菌是非致病性的C. butyricum M-55,它对多种肿瘤动物模型的实验表明注射C. butyricum M-55芽胞菌可对实体瘤发生溶瘤作用。但是,将其用于治疗49位患者后却并未延长患者生存期。后来,又尝试将注射C. butyricum M-55芽胞菌联合使用射频使肿瘤升温(42℃~44℃),局部放疗或降低带瘤动物呼吸空气中的氧浓度等方法,但临床上这些策略仍未产生预期效果。因此,在20世纪90年代以前很少见到细菌用于肿瘤治疗方面的报道。直到2001年,Vogelstein研究组[2]由C. novyi(ATCC19402)得到减毒活菌株C. novyiNT,并提出了联合细菌的溶瘤治疗(combinedbacteriolytictherapy,COBALT)策略,细菌的溶瘤治疗方兴未艾。
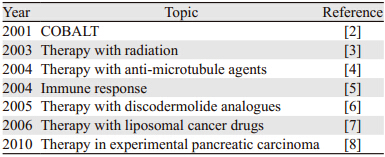
本研究小组以“Clostridium novyi”为检索词在PubMed检索到了153篇文章。2000年以前,未检索到C. novyi(ATCC19402)溶瘤作用的报道,大部分研究关注此菌的生物学特征,尤其是以α-毒素的研究多见;2001~2010年,共有7篇C. novyi溶瘤效果的文章,尤其是在2003~2005年,三年的时间就有4篇,见图 1,并且这些文章的主题从化疗药、放疗、抗微管类药、天然海洋药物联合应用等方面,进一步深入研究C. novyi溶瘤的免疫机制,见表 1。涉及的肿瘤种类[www.clinicaltrials.gov/ct]有肺肿瘤、胃肠间质瘤、胰腺肿瘤、软组织肉瘤、胃癌和膀胱肿瘤等。
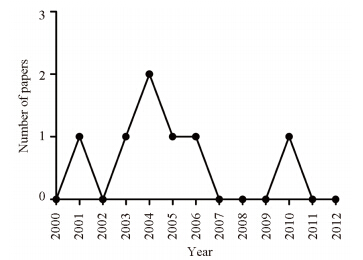 |
| 图 1 研究Clostridium novyi-NT芽胞有溶瘤作用的文章数量 Figure 1 The number of papers about tumor regression of Clostridium novyi-NTspor |
 |
2010年,Forbes[9]提出,细菌是肿瘤治疗的最适“自动化工厂”(optimalrobotfactory),并认为细菌可通过直接溶瘤或充当杀瘤分子的基因载体等方式发挥抗肿瘤作用。结合For bes的观点[9 - 1 0],我们提出理想的抗肿瘤细菌应具有以下六个标准(简称SESCNI):(1)安全性(safety):对宿主无毒性;并可被宿主缓慢的完全清除或对抗生素敏感,无耐药性;(2)有效性(effectivity):能导致肿瘤细胞溶解;(3)选择性(selectivity):只能在肿瘤细胞内增殖;(4)趋化性(chemotaxy):能运动或均匀扩散到肿瘤的低氧区和坏死区;(5)无免疫原性(nonimmunogenic),即不引起强的抗菌免疫;(6)应激性(irritability):能对激活信号反应、感应局部环境信号并产生外在的可觉察信号。 3 C.novyi的代谢产物
培养条件不同可影响C. novyi的毒性及芽胞产生率。可通过加热获得减毒活菌株,同时,延长保存时间会增强芽胞生成率并降低毒性[11];C. novyi为中度厌氧菌,暴露在空气中60~90min仍有活性,当氧气含量为2%~8%时存活并生长[12]。C.novyi在发挥溶瘤作用的过程中可产生以下3种产物,影响溶瘤效果。 3.1 磷脂酶类C
C. novyi产生的磷脂酶类C(phospholipasesC)底物特异性不强,对所有细胞膜及其脂类提取物发生水解作用[13];激活宿主炎性反应并诱导抗癌免疫[14],C. novyi基因组分析说明,此菌产生的蛋白酶和脂肪酶的作用及磷脂酶类C诱导的炎性反应能摧毁肿瘤[15]。 3.2 脂质体酶
脂质体包裹可加强化疗药的靶向性。Cheong等[7]研究发现C. novyi-NT产生的脂质体酶能裂解包裹化疗药的脂质体,当细菌与化疗联合应用时,从而加强微脂粒肿瘤药物的释放和有效性。 3.3 毒素
C.novyi能产生4种主要毒素(α、γ、δ、ε),37℃培养72h毒素产生达峰值[16]。(1)α-毒素通过改变肌动蛋白细胞骨架导致多种功能丧失,如细胞屏障的通透性和胞内连接[17,18];(2)α-毒素是坏死性毒素,能引起豚鼠出现以皮下无色胶状水肿为主要特征的病变;(3)α-毒素可导致中毒性休克和气性坏疽[19];(4)α-毒素对生殖细胞产生影响,可促进光滑爪蟾卵母细胞减数分裂成熟[20]。
噬菌体可对C. novyi毒性产生影响,Schallehn等[21]研究发现噬菌体敏感菌株能产生α-毒素;没有毒性的C. botulinumC型当与噬菌体一起培养时,能发生种间转化,成为有毒性的C. novyi[22]。 4 C.novyi的致病性
C.novyi可感染人和其他动物,报道有羊、母猪、马、猫[23]等。C.novyi造成人的感染罕见,一般是散发的死亡病例。Vleminckx等[24]报道了1例从具有脾脓肿但无气性坏疽的患者血中分离出C.novyi。Majumdar等[25]报道了一例非注射吸毒者手术后伤口感染C.novyi。最引人注意的是,2000年报道的发生在英国注射吸毒者因静脉注射C.novyi污染的毒品而爆发死亡的事件,大多数在局部注射海洛因7~14d后发展为快速的致死性系统性疾病[26],表现为低血压、口渴、肺水肿、心包和胸膜腔积液及白细胞增多。另外,注射吸毒者感染C.novyi还可导致坏死性筋膜炎、软组织感染、炭疽等。2000~2009年,在英格兰和苏格兰共报道了295例注射吸毒者发生的此类感染事件[27]。 5 C. novyi的溶瘤作用
2001年,Dang等[2]研究了来自双歧杆菌属、乳酸菌属和梭菌属的26株厌氧菌在肿瘤中的定植能力,发现只有C. novyi(ATCC19402)和索德里梭菌(C.sordelliiATCC9714)能广泛定植于肿瘤的坏死区,但在注射这两种菌的芽胞16~18h,仍有1/3的实验小鼠死亡。用热休克的方法(70°C,15min)破坏α-毒素,得到减毒活菌株C. novyiNT,但单独注射C. novyi-NT没有明显的肿瘤控制效果。因此,他们提出了联合细菌的溶瘤治疗(COBALT)策略,即将C. novyi-NT与传统化疗药物联合应用,如与Dolastatin-10和丝裂霉素C等,发现这种COBALT治疗策略产生了明显的溶瘤效果,并具有长期免疫效应。但肿瘤大范围溶解也造成了严重的毒血症,而导致实验动物死亡[2],称之为肿瘤溶解综合症,这一问题尚有待深入研究克服。
他们还尝试将C. novyi-NT芽胞与放疗结合[3],由于细菌对肿瘤细胞的攻击而加强了放疗的敏感度,故这种组合治疗方案对多种肿瘤模型的溶瘤作用发挥叠加效应。为进一步降低毒性,他们将C. novyi-NT芽胞与作用于微管的化疗药联用[4],可摧毁有血管区和无血管区肿瘤。并分别比较与微管稳定剂(taxanesdocetaxel和MAC-321)及抑制微管形成的微管稳定消除剂(HTI-286和vinor elbine)这两类药物联合应用效果,发现C. novyi-NT与微管稳定消除剂联合应用效果更好,可能是因为微管稳定消除剂从根本上减少了肿瘤的供血,而扩大了使细菌芽胞萌发的低氧微环境区域引起的。Smith等[6]将从海洋生物中分离出的抗有丝分裂化合物海绵内酯(Discodermolid)及其类似物,与C. novyi-NT芽胞联用治疗大肠癌HCT116细胞异种移植物的荷瘤裸鼠,可引起快速完全的肿瘤消退。
实验性荷瘤小鼠和家兔模型的药代动力学实验[28]发现,C. novyi-NT从循环中经网状内皮系统快速清除。最近,Krick等[29]证实C. novyi-NT芽胞能在狗的肿瘤组织内萌发。值得注意的是,用C.novyi-NT芽胞处理同源的BALB/c小鼠和异基因的新西兰兔,肿瘤治愈率约30%[30],体积大的肿瘤甚至可以完全消退。 6 C. novyi-NT抗肿瘤作用机制
C. novyi-NT的溶瘤机制,一方面是细菌对肿瘤的直接杀伤作用;另一方面是通过细菌的免疫刺激作用而间接杀伤的。 6.1 C. novyi-NT的直接溶瘤作用
所有实体瘤都会经历血管生成,当肿瘤细胞比形成血管的细胞生长快时,会导致肿瘤缺氧并发生生物学和相应的代谢改变,如形成有缺陷的血管、出现凋亡和坏死的肿瘤组织、出现缺氧区和异化的肿瘤细胞群等。因此,这种独特的实体瘤微环境为厌氧菌提供了理想的生长条件。静脉注射的C. novyi-NT芽胞由于厌氧的特性,只能在肿瘤的厌氧区或低氧区萌发成繁殖体。一旦成为繁殖体,细菌就可通过分泌磷脂酶类C等摧毁细菌周围的肿瘤细胞。 6.2 C. novyi-NT的间接免疫刺激作用
Vogelstein小组[5]研究发现,注射的C. novyi-NT发挥类似佐剂的作用,诱发炎性反应,产生IL-6、MIP-2、G-CSF、TIMP-1等细胞因子,诱使炎性中性粒细胞最先在肿瘤周围聚集,然后是单核细胞和淋巴细胞。因此,他们认为CD8+T细胞在C. novyi-NT芽胞治疗的溶瘤过程中引起了有效的抗肿瘤反应。但Maletzki等[8]在研究C. novyi-NT芽胞治疗胰腺癌时,通过流式细胞术未发现T、B细胞的增多,发现主要是活化NK细胞的数目增多,认为发挥抗肿瘤作用的主要是天然免疫反应。关于C. novyi-NT芽胞在肿瘤治疗过程中的免疫机制值得进一步研究。 7 问题及展望
细菌抗肿瘤作用的研究正在兴起,尚有诸多问题有待深入探讨。就细菌方面而言,存在的主要问题是:(1)如何在细菌效力与毒力之间找到平衡点?用减毒的C. novyi-NT芽胞进行的COBALT疗法仍能导致实验荷瘤小鼠约15%~45%的死亡率[2],说明减毒处理细菌可能仍存在一定的安全隐患(如菌血症和内毒素血症)。不过,C. novyi-NT全基因组测序和解码[15]以及C. novyi-NT芽胞外被结构特征的研究[31]为降低C. novyi-NT的毒性提供了重要的资料。(2)如何进一步开发溶瘤细菌,能用于治疗无坏死组织或无肿瘤转移灶的体积小的肿瘤?(3)如何控制细菌可能发生的突变而导致肿瘤治疗的失败或细菌扩散而造成的感染?
在宿主方面,应该考虑的因素包括:(1)如何确定能够使用细菌进行治疗(单独或联合其他疗法)的肿瘤类型的范围?(2)如何有效克服肿瘤细胞溶解以后,大量的肿瘤细胞产物释出所造成的全身毒性,甚至对机体细胞免疫系统所造成的不利影响?
C.novyi-NT芽胞菌已进入临床Ⅰ期试验(NCT00358397和NCT01118819),我们相信它将随着基因技术的不断发展而不断深入。目前,C. novyi-NT芽胞菌介导的肿瘤治疗方面存在的问题将被破解,新的溶瘤细菌将不断被发现,为肿瘤的生物治疗提供了一种新选择。
| [1] | Parker RC, Plummer HC, Siebenmann CO, et al. Effect ofhistolyticus infection and toxin on transplantable mouse tumors[J].Proc Soc Exp Biol Med, 1947, 66(2): 461-7. |
| [2] | Dang LH, Bettegowda C, Huso DL, et al. Combinationbacteriolytic therapy for the treatment of experimental tumors[J].Proc Natl Acad Sci U S A, 2001, 98(26): 15155-60. |
| [3] | Bettegowda C, Dang LH, Abrams R, et al. Overcoming thehypoxic barrier to radiation therapy with anaerobic bacteria[J].Proc Natl Acad Sci U S A, 2003, 100(25): 15083-8. |
| [4] | Dang LH, Bettegowda C, Agrawal N, et al. Targeting vascular andavascular compartments of tumors with C. novyi-NT and antimicrotubuleagents[J]. Cancer Biol Ther, 2004, 3(3): 326-37. |
| [5] | Agrawal N, Bettegowda C, Cheong I, et al. Bacteriolytic therapycan generate a potent immune response against experimentaltumors[J]. Proc Natl Acad Sci U S A, 2004, 101(42): 15172-7. |
| [6] | Smith AB 3rd, Freeze BS, LaMarche MJ, et al. Discodermolideanalogues as the chemical component of combination bacteriolytictherapy[J]. Bioorg Med Chem Lett, 2005, 15(15): 3623-6. |
| [7] | Cheong I, Huang X, Bettegowda C, et al. A bacterial proteinenhances the release and efficacy of liposomal cancer drugs[J].Science, 2006, 314(5803): 1308-11. |
| [8] | Maletzki C, Gock M, Klier U, et al. Bacteriolytic therapy ofexperimental pancreatic carcinoma[J]. World J Gastroenterol,2010,16(28): 3546-52. |
| [9] | Forbes NS. Engineering the perfect (bacterial) cancer therapy[J].Nat Rev Cancer, 2010, 10(11): 785-94. |
| [10] | Jain RK, Forbes NS. Can engineered bacteria help controlcancer?[J]. Proc Natl Acad Sci U S A, 2001, 98(26): 14748-50. |
| [11] | Nishida S, Nakagawara G. Isolation of toxigenic strains ofClostridium novyi from soil[J]. J Bacteriol, 1964, 88: 1636-40. |
| [12] | Loesche WJ. Oxygen sensitivity of various anaerobic bacteria[J].Appl Microbiol, 1969, 18(5): 723-7. |
| [13] | Taguchi R, Ikezawa H. Hydrolytic action of phospholipases onbacterial membranes[J]. J Biochem, 1977, 82(5): 1225-30. |
| [14] | Bentley S, Sebaihia M. Bacterial therapeutics[J]. Nat RevMicrobiol, 2007, 5(3): 170-1. |
| [15] | Bettegowda C, Huang X, Lin J, et al.The genome andtranscriptomes of the anti-tumor agent Clostridium novyi-NT[J].Nat Biotechnol, 2006, 24(12): 1573-80. |
| [16] | Ball DW, Van Tassell RL, Roberts MD, et al. Purification andcharacterization of alpha-toxin produced by Clostridium novyitype A[J]. Infect Immun, 1993, 61(7): 2912-8. |
| [17] | Müller H, von Eichel-Streiber C, Habermann E. Morphologicalchanges of cultured endothelial cells after microinjection oftoxins that act on the cytoskeleton[J]. Infect Immun, 1992, 60(7):3007-10. |
| [18] | Oksche A, Nakov R, Habermann E. Morphological andbiochemical study of cytoskeletal changes in cultured cells afterextracellular application of Clostridium novyi alpha-toxin[J].Infect Immun, 1992, 60(7): 3002-6. |
| [19] | Guttenberg G, Papatheodorou P, Genisyuerek S, et al. Inositolhexakisphosphate-dependent processing of Clostridium sordelliilethal toxin and Clostridium novyi α-toxin[J]. J Biol Chem, 2011,286(17): 14779-86. |
| [20] | Bette P, Mauler F, Mohr C, et al. Microinjection of alpha-toxinfrom Clostridium novyi type A promotes meiotic maturation inXenopus laevis oocytes[J]. Toxicon, 1990, 28(11): 1368-71. |
| [21] | Schallehn G, Eklund M, Brandis H. Phage conversion ofclostridium novyi type A[J]. Zentralbl Bakteriol A, 1980, 247(1):95-100. |
| [22] | Eklund MW, Poysky FT, Meyers JA, et al. Interspecies conversionof Clostridium botulinum type C to Clostridium novyi type A bybacteriophage[J]. Science, 1974, 186(4162):456-8. |
| [23] | Dunn JK, Farrow CS, Doige CE. Disseminated osteomyelitiscaused by Clostridium novyi in a cat[J]. Can Vet J, 1983, 24(10):312-5. |
| [24] | Vleminckx WG, Diltoer MW, Spapen HD, et al. Splenic abscesswith Clostridium novyi bacteraemia and sepsis[J]. Eur JGastroenterol Hepatol, 1997, 9(3): 303-5. |
| [25] | Majumdar S, Woodcock S, Cheesbrough J. Severe sepsis followingwound infection by an unusual organism-Clostridium novyi[J]. IntJ Clin Pract, 2004, 58(9): 892-3. |
| [26] | Finn SP, Leen E, English L, et al. Autopsy findings in an outbreakof severe systemic illness in heroin users following injection siteinflammation: an effect of Clostridium novyi exotoxin?[J]. ArchPathol Lab Med, 2003, 127(11): 1465-70. |
| [27] | Palmateer NE, Hope VD, Roy K, et al. Infections with sporeformingbacteria in persons who inject drugs, 2000-2009[J].Emerg Infect Dis, 2013, 19(1): 29-34. |
| [28] | Diaz LA Jr, Cheong I, Foss CA, et al. Pharmacologic andtoxicologic evaluation of C. novyi-NT spores[J]. Toxicol Sci,2005, 88(2): 562-75. |
| [29] | Krick EL, Sorenmo KU, Rankin SC, et al. Evaluation ofClostridium novyi-NT spores in dogs with naturally occurringtumors[J]. Am J Vet Res, 2012, 73(1):112-8. |
| [30] | Agrawal N, Bettegowda C, Cheong I, et al. Bacteriolytic therapycan generate a potent immune response against experimentaltumors[J]. Proc Natl Acad Sci U S A, 2004, 101(42): 15172-7. |
| [31] | Plomp M, McCaffery JM, Cheong I, et al. Spore coat architectureof Clostridium novyi NT spores[J]. J Bacteriol, 2007, 189(17):6457-68. |
 2015, Vol. 42
2015, Vol. 42


