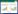文章信息
- 赵勇,王志刚,章必成,饶智国,高建飞,杨波,胡萌. 2015.
- ZHAO Yong, WANG Zhigang, ZHANG Bicheng, RAO Zhiguo, GAO Jianfei, YANG Bo, HU Meng. 2015.
- 瘦素和瘦素受体在结肠癌组织中的表达及瘦素对结肠癌细胞株HT-29增殖及凋亡的影响
- Expression of Leptin and Leptin Receptor in Colon Cancer and Impact of Exogenous Leptin on Proliferation and Apoptosis of Colon Cancer Cell Line HT-29
- 肿瘤防治研究, 2015, 42(01): 48-51
- Cancer Research on Prevention and Treatment, 2015, 42(01): 48-51
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.01.012
-
文章历史
- 收稿日期:2014-06-23
- 修回日期:2014-10-22
大肠癌的发病率居全国恶性肿瘤第4位,其死 亡率居全部恶性肿瘤死亡率的第3位,且其发病率 每年以4.7%逐年递增[1]。流行病学资料发现,肥 胖与结肠癌的发病密切相关。近年来针对肥胖的 研究发现了一种类似细胞因子的蛋白类激素—瘦 素,其与其靶向瘦素受体结合发挥其生理作用。 瘦素及瘦素受体在多种肿瘤组织中均有表达,并且 对肿瘤细胞的增殖和生长具有促进作用[2, 3, 4, 5, 6, 7],但其 在结肠癌发生过程中的表达情况及其作用机制目前 尚未完全阐明。本研究采用流式细胞仪检测结肠癌 细胞中瘦素和瘦素受体的表达情况,采用MTT法 及流式细胞仪检测外源性瘦素对结肠癌细胞增殖、 凋亡及细胞周期的影响,旨在探讨瘦素在结肠癌发 生、发展过程中发挥的生物学效应。 1 资料与方法 1.1 资料与试剂
收集广州军区武汉总医院2010年3月至2013年 6月间手术切除经病理证实、术前均未行放化疗或 免疫等治疗的结肠癌患者94例,其中男52例、女42 例,年龄21~84岁,平均年龄(58.3±14)岁。根据 2004年WHO肿瘤组织学分类:高分化26例、中分化 33例、低分化35例。淋巴结转移者54例,远处转移 者25例。Ⅰ期10例、Ⅱ期28例、Ⅲ期31例、Ⅳ期25 例。将同期获得的20例术后正常肠黏膜组织作为对 照。人结肠癌细胞株HT-29由武汉大学提供,瘦素 羊抗人抗体及瘦素受体羊抗人抗体购自美国Santa Cruce公司,胰蛋白酶、瘦素、EDTA均购自美国 Sigma公司,流式细胞仪为德国Miltenyi公司产品。 1.2 检测瘦素及瘦素受体在结肠癌组织中的表达
术中取出的新鲜结肠癌组织切取癌细胞生长 旺盛的边缘处1.5 cm×1.5 cm组织块,放入含有青、 链霉素双抗液中(青霉素含量为10 000 u/ml,链霉 素含量为10 mg/ml)制成单细胞悬液,取0.5 ml细 胞悬液,PBS洗涤、离心、弃上清液,加入羊抗 人瘦素荧光抗体,对照管中加入PBS液,4℃孵育 30 min后洗涤、离心上机检测。每例标本检测1×106 个细胞。瘦素(瘦素受体)阳性率(%)=(试管中 瘦素阳性细胞数-阴性对照阳性细胞数)/10 000× 100%。每例检测三个复测管,取其均值。 1.3 瘦素结肠癌细胞株HT-29细胞增殖的影响
HT-29细胞复苏后培养于10%RPMI 1640培养 液,37℃、20%CO2环境下常规培养,取生长状态 良好的对数期细胞进行试验。将细胞浓度调至5× 1012/L,以每孔3 000个细胞接种至96孔板,另取一 孔不含细胞的培养液作空白对照。37℃、5%CO2培 养箱中培养24 h后,各孔加入浓度为0、5、50、100 和200 ng/ml的瘦素,对应分为5组(0、5、50、100 和200 ng/ml),每组3个复孔,分别培养24、48和 72 h后,每孔加入0.5%MTT 200 μl后连续培养4 h, 吸尽混合培养液,加入DMSO 200 μl振荡15 min后 用酶标仪于495 nm波长下检测每孔的OD值。细胞 生长率(%)=A实验组平均值/A对照组平均值×100%。 1.4 瘦素对HT-29细胞周期及凋亡的影响
结肠癌细胞株HT-29细胞按接种传代原则接种 到培养瓶稳定传代后,实验组加入终浓度为5、50、 100和200 ng/ml的瘦素,不加药物的空白瓶为对照 组。培养24、48和72 h后加入0.25%的胰消化酶制成 单细胞悬液,1 000 r/min离心,弃上清液后用buffer 重悬,加入PI染色液1.0 ml,30 min后上机检测。应用DNA细胞周期分布软件计算DNA直方图各时相 分布百分比,细胞周期为G0/G1、S和G2/M期,各期 细胞百分率=本期细胞数/细胞总数×100%,细胞增 殖指数=S+G2/M期细胞数/细胞总数×100%。 1.5 统计学方法
所有数据以均数标±准差(x±s)表示,采用 SPSS13.0统计软件对相关数据进行t检验,P<0.05 为差异有统计学意义。 2 结果 2.1 瘦素及瘦素受体在结肠癌组织中的表达
瘦素在结肠癌组织和正常结肠组织中的阳 性表达率分别为:(80.3±1.83)%和(59.83± 1.12)%,差异有统计学意义(P<0.01);瘦素受 体在结肠癌及正常结肠组织中的阳性表达率分别 为(82.14±1.63)%和(65.21±1.45)%,差异有统 计学意义(P<0.05)。 2.2 瘦素和瘦素受体在结肠癌组织中的表达与结肠癌临床病理关系
瘦素和瘦素受体在结肠癌组织中的表达 与结肠癌患者的性别、年龄、分化程度、淋巴 结或远处转移及临床分期无明显相关性(P> 0.05),见表 1。
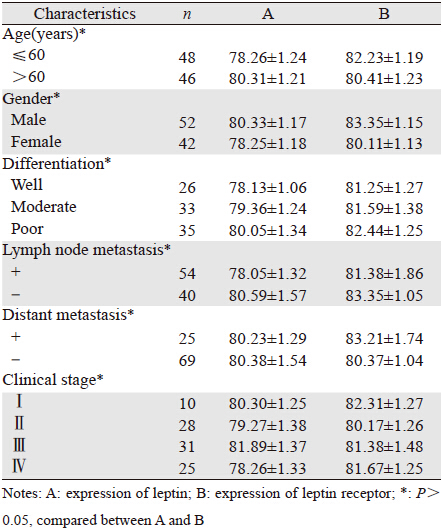 |
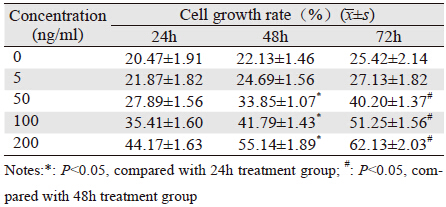
浓度为50、100和200 ng/ml的外源性瘦素作用 TH-29细胞后均明显促进其增殖,随着作用时间的 增加,其促进增殖作用越明显,差异有统计学意 义(P<0.05);浓度为200 ng/ml的外源性瘦素作用 72 h其促进细胞增殖效应最明显,见图 1、表 2。
|
| 图 1 外源性瘦素对TH-29细胞增殖的影响 Figure 1 Effect of exogenous leptin on proliferation of TH-29 cells |
 |
不同浓度外源性瘦素作用TH-29细胞72 h后, 具有明显促进其增殖的作用(P<0.05),但对 TH-29细胞凋亡无明显影响(P>0.05);G0/G1 期细胞比例减少,S 期、G2/M期细胞比例增加 (P<0.05),见图 2、表 3。

|
| A: leptin 0ng/ml; B: leptin 5ng/ml; C: leptin 50ng/ml; D: leptin 100ng/ml; E: leptin 200ng/ml 图 2 不同浓度瘦素对TH-29细胞周期及凋亡的影响 Figure 2 Effect of different concentration of leptin on cell cycle and apoptosis of TH-29 cells |
 |
瘦素与其瘦素受体在多种肿瘤细胞中均有 表达,其可以调控JAK/STAT(signal transducer and activator of transcription)、MAPK (mitogenactivated protein kinase)、 PI3K/AKT等多种信号 通路,对肿瘤细胞的增殖和生长具有促进作用, 且可调节肿瘤血管生成、转移、化疗耐药等[8, 9]。 本实验发现瘦素和瘦素受体在结肠癌组织中的表 达明显高于正常肠黏膜组织,提示瘦素及瘦素受 体可能参与了结肠癌的发生。Chen等[10]实验发现 血清中瘦素水平与结肠癌之间并没有相关性,提 示肠道局部分泌的瘦素参与调控了结肠癌的发生 过程。本实验还发现瘦素和瘦素受体在结肠癌组 织中的表达与结肠癌患者的性别、年龄、分化程 度、淋巴结或远处转移及临床分期无明显相关性 (P<0.05),提示瘦素和瘦素受体参与调控结肠 癌的发生是早期过程,其在结肠癌发生的早期发 挥着重要作用。Dubois等[11]发现外源性瘦素可以促 进乳腺癌细胞的增殖,却不影响正常乳腺细胞的 增殖,说明瘦素不是肿瘤发生的启动因素,而是促进因素。Yoon等[12]发现结肠癌细胞系中瘦素的 表达与结肠癌的进展相关,外源性瘦素可通过JAK 和ERK信号通路增强结肠癌细胞黏附和侵袭,这 说明瘦素可促进结肠癌的侵袭与转移,瘦素的表 达可能与结肠癌的淋巴结或远处转移相关。Wang 等[13]发现瘦素在结肠癌组织中的表达与结肠癌肿 瘤分化、淋巴结或远处转移及临床分期相关,与 我们的实践结果不一致,说明瘦素在结肠癌发生 发展中作用尚需进一步研究。
肿瘤的发生过程中细胞增殖和凋亡的失衡是 重要机制。本实验通过MTT法发现浓度为50、100 和200 ng/ml的外源性瘦素作用TH-29细胞后均明显 促进其增殖,随着作用时间的增加,其促进增殖 作用越明显,浓度为200 ng/ml的外源性瘦素作用 72 h其促进细胞增殖效应最明显。细胞的增殖改 变与细胞周期的改变密切相关,S期最能反应细胞 的增殖活性,本实验通过流式细胞分析仪发现, 不同浓度的外源性瘦素作用TH-29细胞72 h后,明 显具有促进其增殖的作用,但对TH-29细胞的凋亡 无明显影响;G0/G1期间细胞比例减少,S期间、 G2/M期细胞比例增加。本实验提示瘦素可以明显 促进结肠癌细胞的增殖,细胞增殖的增加,而细 胞凋亡无明显改变。目前关于瘦素与细胞凋亡的 关系存在不一致的实验数据。Mokrowiecka等[14]发 现外源性瘦素可促进食管腺癌细胞株的增殖,但 对其细胞凋亡无明显影响,与我们在结肠癌的数 据一致。而Beales等[15]却发现外源性瘦素不仅可 以促进食管癌细胞的增殖,还可以明显抑制其凋 亡。同样,Ptak等[16]发现外源性瘦素同样通过增加 细胞增殖、抑制凋亡的方式促进卵巢癌的发生、 发展。但这些研究都说明外源性瘦素导致了细胞 增殖与凋亡的失衡,这种增殖与凋亡的失衡或许 是瘦素促进结肠癌发生的可能机制。
综上所述,瘦素和瘦素受体可能通过促进细胞 增殖的方式在结肠癌发生过程中发挥重要作用。
| [1] | Peng JJ.Application of the individual coucept on standradized comprehensine threatment for colorectal cancer[J].Zhongguo Lin Chuang Zhong Liu Xue Jin Zhan, 2013, 292-6. [彭俊杰. 大肠癌规范化综合治疗下个体化理念的应用[J]. 中国临床肿瘤学进展, 2013, 292-6.] |
| [2] | Vona-Davis L, Rose DP. Angiogenesis, adipokines and breast cancer [J]. Cytokine Growth Factor Rev, 2009,20(3):193-201. |
| [3] | Ren H, Zhao T, Wang X, et al. Leptin upregulates telomerase activity and transcription of human telomerase reverse transcriptase in MCF-7 breast cancer cells [J]. Biochem Biophys Res Commun, 2010, 394(1): 59-63. |
| [4] | Al Khaldi RM, Al Mulla F, Al Awadhi S, et al. Associations of single nucleotide polymorphisms in the adiponectin gene with adiponectin levels and cardio-metabolic risk factors in patients with cancer[J].Dis Markers, 2011, 30(4): 197-212. |
| [5] | Healy LA, Howard JM, Ryan AM, et al. Metabolic syndrome and leptin are associated with adverse pathological features in male colorectal cancer patients[J].Colorectal Dis, 2012, 14(2): 157-65. |
| [6] | Park J, Scherer PE. Leptin and cancer: from cancer stem cells to metastasis[J]. Endocr Relat Cancer, 2011, 18(4): C25-29. |
| [7] | López Fontana CM, Maselli ME, Pérez Elizalde RF, et al. Leptin increases prostate cancer aggressiveness[J]. J Physiol Biochem, 2011, 67(4): 531-8. |
| [8] | Uddin S, Hussain AR, Khan OS, et al. Role of dysregulated expression of leptin and leptin receptors in colorectal carcinogenesis[J]. Tumour Biol, 2014, 35(2): 871-9. |
| [9] | Bain GH, Collie-Duguid E, Murray GI, et al. Tumour expression of leptin is associated with chemotherapy resistance and therapyindependent prognosis in gastro-oesophageal adenocarcinomas[J]. Br J Cancer, 2014, 110(6): 1525-34. |
| [10] | Chen J, Iverson D. Estrogen in obesity-associated colon cancer: friend or foe? Protecting postmenopausal women but promoting late-stage colon cancer[J].Cancer Causes Control, 2012, 23(11): 1767-73. |
| [11] | Dubois V, Jardé T, Delort L, et al. Leptin induces a proliferative response in breast cancer cells but not in normal breast cells[J]. Nutr Cancer, 2014, 66(4): 645-55. |
| [12] | Yoon KW, Park SY, Kim JY, et al. Leptin-induced adhesion and invasion in colorectal cancer cell lines[J]. Oncol Rep, 2014, 31(6): 2493-8. |
| [13] | Wang D, Chen J, Chen H, et al. Leptin regulates proliferation and apoptosis of colorectal carcinoma through PI3K/Akt/mTOR signalling pathway[J]. J Biosci, 2012, 37(1): 91-101. |
| [14] | Mokrowiecka A, Daniel P, Jasinska A, et al. Serum adiponectin, resistin, leptin concentration and central adiposity parameters in Barrett’s esophagus patients with and without intestinal metaplasia in comparison to healthy controls and patients with GERD[J]. Hepatogastroenterology, 2012, 59(120): 2395-9. |
| [15] | Beales IL, Garcia-Morales C, Oqunwobi OO, et al. Adiponectin inhibits leptin-induced oncogenic signalling in oesophageal cancer cells by activation of PTP1B[J]. Mol Cell Endocrinol, 2014, 382(1): 150-8. |
| [16] | Ptak A, Kolaczkowska E, Gregoraszczuk EL. Leptin stimulation of cell cycle and inhibition of apoptosis gene and protein expression in OVCAR-3 ovariancancer cells[J]. Endocrine, 2013, 43(2): 394-403. |
 2015, Vol. 42
2015, Vol. 42