文章信息
- 周晓水,张陶然,刘毅,杨宗元,王常玉. 2015.
- ZHOU Xiaoshui, ZHANG Taoran, LIU Yi, YANG Zongyuan, WANG Changyu. 2015.
- 内质网功能状态对卵巢癌细胞顺铂敏感度的影响
- Effect of Endoplasmic Reticulum Status on Sensitivity of Ovarian Cancer Cells to Cisplatin
- 肿瘤防治研究, 2015, 42(01): 41-44
- Cancer Research on Prevention and Treatment, 2015, 42(01): 41-44
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.01.010
-
文章历史
- 收稿日期:2014-01-07
- 修回日期:2014-07-30
卵巢癌(ovarian cancer)是常见的女性生殖 系统恶性肿瘤之一,虽然其发病率低于宫颈癌和 子宫内膜癌,但是由于其发病隐匿,缺乏早期症 状和有效的筛查手段,导致大多数发现时已经处于疾病中晚期,再加上原发或继发的多药耐药存 在,使其死亡率居妇科恶性肿瘤首位[1] 。
在内质网中,分泌性蛋白、跨膜蛋白和内质 网驻留蛋白折叠成天然构象,经过修饰后,形成 有活性的功能性蛋白质。如果蛋白质在内质网内 的折叠受到抑制,造成未折叠蛋白聚集,将引起 内质网应激(endoplasmic reticulum stress,ERS), 激活未折叠蛋白反应(unfolded protein response, UPR),使蛋白质的生物合成减少,内质网的降解 功能增强,从而降低内质网负担,维持细胞内的 稳态。如果内质网应激持续存在,则可诱发细胞 凋亡[2]。本实验通过改变卵巢癌耐药细胞株SKOV3 的ERS功能状态进行比较其对顺铂敏感度的差异。 1 资料与方法 1.1 资料
于2012年10月—2013年10月收集武汉华中 科技大学同济医学院附属同济医院卵巢癌患 者腹水5 例,卵巢癌患者在术后病检均得到证 实。卵巢癌细胞系SKOV3 购自美国标准生物 品收藏中心(ATCC)。McCoy′s 5A培养液及 胎牛血清购自美国Gibco公司。顺铂、毒胡萝 卜素(thapsigargin,TG)和牛磺熊去氧胆酸钠 (tauroursodeoxycholate,TUDCA)购于美国Sigma 公司。内质网示踪染料(ER-tracker)购于中国 Beyotime公司。CHOP抗体、GRP78抗体、Cleaveparp 抗体、Cleave-caspase3抗体均购于美国Santa Cruz公司。CHOP、GRP78、GRP94、EIF-2a、 PERK及ATF6引物合成均购于上海生工生物技术有 限公司,增强化学发光(ECL)底物为美国Pierce 公司产品。EPCAM-FITC购于德国Miltenyi公司, 流式凋亡试剂盒购于北京四正柏生物科技有限公 司,羊抗兔、羊抗鼠酶标二抗购于武汉三鹰公司。 1.2 细胞培养
SKOV3细胞用含10%胎牛血清McCoy’s 5A培养液 (含青霉素100 u/ml及链霉素100 μg/ml),在37℃、5% CO2条件下传代培养。采用0.4%胰酶消化传代培养。 1.3 流式细胞技术凋亡检测
胰酶轻消化收集不同处理因素处理过后的细 胞,离心沉淀细胞弃上清液,用预冷PBS洗2遍 后,每个样品用100 μl 1 × Binding Buffer/PBS重 悬细胞,加入5 μl Annexin V-FITC和5 μl PI试剂, 轻轻混匀,4℃避光放置30 min。用流式细胞仪检 测,并采用分析软件进行分析。 1.4 qRT-PCR检测内质网应激相关基因表达
胰酶消化收集不同处理因素处理过后的细胞, 离心沉淀细胞弃上清液,细胞提取2 μg RNA,反 转录合成cDNA第一链,以PCR引物和第一链为模 板,反应条件:95℃ 3 min变性,95℃ 10 s,60℃ 30 s,40次循环,以β-actin为内参照,进行实时定 量PCR反应并进行数据分析。 1.5 Western blot检测内质网应激相关蛋白表达
胰酶消化收集不同处理因素处理过后的细胞, PBS洗涤。RiPA蛋白裂解液提取收集细胞蛋白,每孔 50 μg上样量进行SDS-PAGE电泳,低温湿转至PVDF 膜上,5%BSA封闭1 h,一抗4℃孵育过夜(CHOP 1∶ 200,GRP78 1∶1 000,GRP94 1∶1 000,P-EIF-2a 1∶1 000,PERK 1∶1 000,GAPDH 1∶2 000)。TBST洗 膜后,加入HRP标记二抗(1∶3 000),室温孵育1 h, TBST充分洗掉背景后用增强ECL底物曝光。 1.6 细胞内质网荧光标记
去除细胞培养液,用适量的含有Ca2+和Mg2+ 的HBSS溶液洗涤细胞,去除洗涤液,加入37℃ 预温育的ER-Tracker Red染色工作液(取少量ERTracker Red按照1∶1 000加入到ER-Tracker稀释 液中),与细胞37℃共孵育15~30 min。去除ERTracker Red染色工作液,用细胞培养液洗涤细胞 1~2次,随后用激光共聚焦显微镜观察并拍照。 1.7 腹水中卵巢癌细胞分离及鉴定
收集卵巢癌患者腹水,50 ml离心管分装并离 心,1 200 r/min,5 min,离心后弃上清液,红细胞裂 解液重悬细胞作用8 min,PBS终止裂解红细胞,1 200 r/min,5 min,离心后弃上清液,PBS重悬细胞, 1 200 r/min ,5 min,弃上清液,含10%胎牛血清的 McCoy′s 5A培养液重悬细胞种于培养瓶中,在37℃、 5%CO2条件下培养,24 h后换液,以后每三天换液一 次,直至细胞密度达到95%以上后传代。并采用梯度 消化方法提高卵巢癌细胞纯度,并用流式细胞学技 术单标EPCAM-FITC抗体对其纯度进行鉴定。 1.8 统计学方法
每次试验至少重复三次,应用SPSS 13.0软件 进行统计分析,计量资料以(x±s)表示,两组间比 较采用t检验,P<0.05为差异有统计学意义。 2 结果 2.1 DDP在卵巢癌耐药细胞株SKOV3中引起ERS
DDP 40 μmol/L处理SKOV3细胞(DDP处理组) 24 h后,进行qRT-PCR检测结果为:DDP处理组ERS 相关基因表达量较未做任何处理者(对照组)明显增 高,差异有统计学意义(P<0.05),见图 1A;内质网示踪染料(ER-tracker)检测细胞内质网形态,DDP处 理组较对照组明显颗粒化,见图 1B。

|
| ERS: endoplasmic reticulum status;DDP: cisplatin; ERS related proteins: GRP78,GRP94,CHOP,PERK,EIF-2-a and ATF6; *: P<0.05; A: the alteration of ERS-related genes expression examined by qRTPCR; B: the morphological change observed by ER-tracker 图 1 DDP在卵巢癌细胞中引起内质网应激 Figure 1 ERS elicited by DDP in ovarian cancer cells SKOV3 |
TG预处理SKOV3细胞12 h联合DDP作用于 SKOV3细胞24 h(TG联合DDP组),进行后续试 验,流式细胞技术检测其凋亡率,结果显示:TG 联合DDP处理后,其凋亡率明显高于DDP处理组 和对照组,差异有统计学意义(P=0.002),见图 2A;Western blot结果为:ERS相关蛋白GRP78和 CHOP表达量在TG联合DDP处理组明显高于DDP 处理组和对照组,DDP处理组高于对照组,差异 有统计学意义(P<0.05),见图 2B。

|
| TG: ERS sensitizer; GAPDH: internal reference; *: P<0.05 A: the change of apoptosis rate; B: the alteration of ERS related genes 图 2 ERS诱导剂TG对SKOV3细胞DDP敏感度的影响 Figure 2 Effect of TG on the sensitivity of SKOV3 cells to DDP |
TUDCA 250 nM作用于SKOV3 12 h后给予DDP 40 μmol/L处理细胞(TUDCA联合DDP组)24 h, 进行后续试验,流式细胞技术检测其凋亡率,结 果显示:TUDCA联合DDP处理后其凋亡率明显低 于DDP处理组,差异有统计学意义(P=0.001), 见图 3A;Western blot结果为:ERS相关蛋白表达 量在TUDCA联合DDP组明显低于DDP处理组, DDP处理组高于对照组,差异有统计学意义(P <0.05),见图 3B。
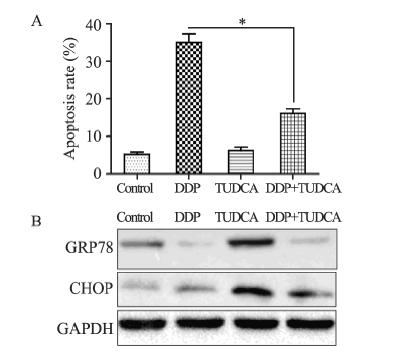
|
| TUDCA: ERS stabilizer; *: P<0.05; A: the change of apoptosis rate; B: the alteration of ERS related genes 图 3 ERS稳定剂TUDCA对SKOV3细胞DDP敏感度的影响 Figure 3 Effect of TUDCA on the sensitivity of SKOV3 cells to DDP |
腹水中原代卵巢癌细胞贴壁1周后形态图,见 图 4A;流式细胞术鉴定EPCAM-FITC阳性比例为98.1%,见图 4B;流式细胞术比较TUDCA及TG预 处理对原代卵巢癌细胞DDP敏感度影响结果为: TG可上调DDP引发的凋亡率,TUDCA可降低其凋 亡率,见图 4C;Western blot结果显示TG联合DDP 作用于原代卵巢癌细胞后上调凋亡相关蛋白的表 达,TUDCA反之,见图 4D。
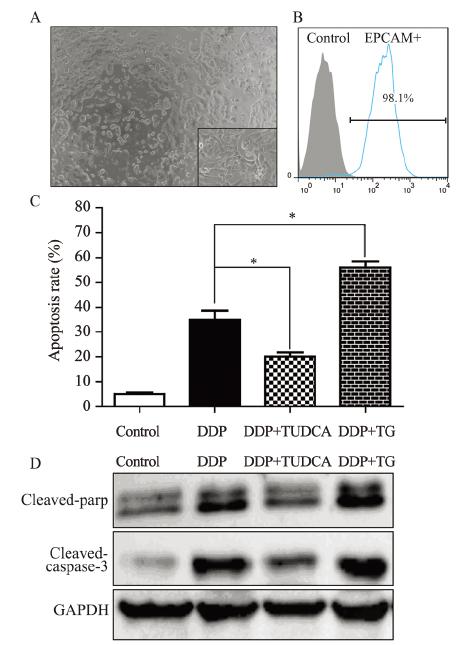
|
| Apoptosis-related protein: Cleaved-parp and Cleaved-caspase-3; *: P<0.05,compared with DDP group; A: morphological figure of the primary ovarian cancer cells in ascites; B: the positive rate of EPCAMFITC checked by flow cytometry; C: effect of TG and TUDCA on the relative apoptosis rate of primary ovarian cancer cells; D: the apoptosis protein detected by Western blot after TG and TUDCA treatment 图 4 改变原代卵巢癌细胞中ERS效应后凋亡相关蛋白的变化 Figure 4 The change of apoptosis-related protein induced by altering ERS in primary ovarian cancer cells |
铂类在过去的几十年已经广泛应用于头颈部 肿瘤、睾丸癌、生殖细胞肿瘤和复发淋巴瘤等多 种肿瘤[3]。目前顺铂耐药的机制还不是很清楚,但 是已明确涉及到多方面因素:(1)增强解毒性; (2)调节转运蛋白的表达;(3)细胞通过阻碍 顺铂与DNA结合;(4)提高DNA的修复;(5) 激活促细胞存活的基因,如Bcl-2等[4, 5]。
研究表明,许多病理和生理情况,如缺氧、氧化损伤、内质网Ca2+耗竭、病毒感染、低血糖、高 脂饮食等均可能导致内质网蛋白折叠负荷能力的失 衡,导致未折叠蛋白在内质网内的堆积,即发生内 质网应激[6]。在肿瘤发生发展过程中,由于肿瘤细 胞的快速增长、代谢旺盛对能量需求增加以及血液 供应相对不足,肿瘤细胞处于氧和葡萄糖相对缺乏 的状态,而严重依赖葡萄糖酵解为其提供生长所需 的能量的肿瘤细胞因氧和葡萄糖的相对缺乏以及葡 萄糖酵解增加所致的pH降低,引起为折叠蛋白在 内质网中聚集增多,导致肿瘤细胞的内质网应激反 应[7]。当细胞处于内质网应激状态时,可以激活细 胞内的信号转导系统和相关的降解途径,清除细胞 内积累的错误折叠的蛋白,减弱细胞应激水平,但 是当内质网损伤的程度持续加重不能被恢复时,内 质网应激可以导致细胞死亡[8]。在神经外胚层肿瘤 细胞中,通过eIF2a-ATF4信号通路调控内质网应激 诱导的细胞凋亡[9]。ERS通过PERK信号通路介导丝 裂霉素C引起的成纤维细胞凋亡[10]。
本研究结果发现,通过改变卵巢癌耐药株 SKOV3的ERS功能状态可以影响其对顺铂敏感度。 顺铂可以诱导卵巢癌耐药株SKOV3细胞发生ERS, 联合ERS诱导剂TG与顺铂处理SKOV3细胞,其ERS 相关蛋白表达和凋亡率相对单用DDP组增加。同 时,联合ERS抑制剂TUDCA与顺铂作用于SKOV3 细胞,其ERS相关蛋白表达相对单用DDP组减少, 且其凋亡率也相应降低。在卵巢癌原代细胞中进 行验证,结果与在SKOV3中一致,其相关凋亡蛋白 Cleaved-parp和Cleaved-caspase-3在TG联合DDP组表 达最高,而TUDCA可以减少DDP引起的凋亡蛋白的 表达。另外,本研究结果显示,顺铂可以引起CHOP 蛋白的表达,而且联用TG、TUDCA其表达量会随之 增加或减少,而ERS引起细胞凋亡中,有许多相关通 路参与其中,第一条为CHOP通路,第二条为IRE1- TRAF2-ASK1-caspase12通路,第三条为Ca2+通路[2]。 本研究中CHOP表达增加,我们猜测,在卵巢癌中顺 铂诱导的ERS可能通过该通路引起细胞凋亡,具体 机制还需后续实验进行进一步的验证。
综上所述,ERS在卵巢癌化疗耐药机制方面可 能起到重要作用,为临床肿瘤辅助治疗提供新的 思路与策略。
| [1] | Parin DM, Bray F, Ferlay J, et al. Global cancer statistics, 2002[J].CA Cancer J Clin, 2005, 55(2): 74-108. |
| [2] | Li M, Ding J, Mou ZH, et al. The signal transduction of unfoldedprotein response[J]. Sheng Ming Ke Xue, 2008, 20(2): 246-52. [李明,丁健, 缪泽鸿,等.未折叠蛋白反应的信号转导[J].生命科学,2008, 20(2): 246-52.] |
| [3] | Lipp HP, Hartmann JT. Platinum compounds: metabolism, toxicityand supportive strategies[J]. Praxis (Bern 1994), 2005, 94(6): 187-98. |
| [4] | Zhou T, Yu HM, Su J, et al. The difference of ER stress inducedby cisplatinin human ovarian cancer cells SKOV3 and SKOV3/DDP[J]. Zhongguo Shi Yan Zhen Duan Xue, 2011, 15(5): 809-11.[周彤, 于慧美, 苏静, 等. 顺铂诱导人卵巢癌SKOV3和SKOV3/DDP细胞内质网应激差异的研究[J]. 中国实验诊断学, 2011,15(5): 809-11.] |
| [5] | Beale PJ, Rogers P, Boxall F, et al. BCL-2 family protein expressionand platinum drug resistance in ovarian carcinoma[J]. Br JCancer, 2000, 82(2): 436-40. |
| [6] | Verfaillie T, Salazar M, Velasco G, et al. Linking ER stress toautophagy: potential implications for cancer therapy[J]. Int J CellBiol, 2010, 2010: 930509. |
| [7] | Fan W, Pan CP, Zhang YM, et al. Endoplasmic reticulum stressinducedoverexpression of CCL5 in human breast cancer cellMCF-7[J]. Zhong Liu Fang Zhi Yan Jiu, 2012, 39(4): 385-8. [范威,潘翠萍, 张懿敏, 等.内质网应激对乳腺癌MCF-7细胞CCL5表达的影响[J]. 肿瘤防治研究, 2012, 39(4): 385-8.] |
| [8] | Szegezdi E, Logue SE, Gorman AM, et al. Mediators of endoplasmicreticulum stress-induced apoptosis[J]. EMBO Rep, 2006, 7(9): 880-5. |
| [9] | Armstrong JL, Flockhart R, Veal GJ, et al. Regulation of endoplasmicreticulum stress-induced cell death by ATF4 in neuroectodermaltumor cells[J]. J Biol Chem, 2010,285(9): 6091-100. |
| [10] | Shi K, Wang D, Cao X, et al. Endoplasmic reticulum stress signalingis involved in mitomycin C(MMC)-induced apoptosis in humanfibroblasts via PERK pathway[J]. PLoS One, 2013, 8(3): e59330. |
 2015, Vol. 42
2015, Vol. 42


