文章信息
- 孙菊杰,魏玲,张德贤,王兴武,吕丽燕,王恒孝. 2015.
- SUN Jujie, WEI Ling, ZHANG Dexian, WANG Xingwu, LV Liyan, WANG Hengxiao. 2015.
- 非小细胞肺癌中Snail、HIF-1α和E-cadherin表达的临床意义及相关性
- Clinical Significance of Snail, Hypoxia-induced Factor-1α and E-cadherin Expression in Non-small Cell Lung Cancer and Their Correlations
- 肿瘤防治研究, 2015, 42(01): 37-40
- Cancer Research on Prevention and Treatment, 2015, 42(01): 37-40
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.01.009
-
文章历史
- 收稿日期:2014-07-08
- 修回日期:2014-07-30
2. 250117济南,山东省肿瘤医院山东省放射肿瘤学重点实验室;
3. 250062济南,山东省医学科学院基础医学研究所
2. Shandong Provincial Key Laboratory of Radiation Oncology, Shandong Cancer Hospital, Ji'nan 250117, China;
3. Institute of Basic Medicine, Shandong Academy of Medical Sciences, Ji'nan 250062, China
侵袭转移是恶性肿瘤的生物学特征之一,也 是患者临床致死的主要原因。乏氧与肿瘤转移 显著正相关,但乏氧引起转移增加的具体机制 尚不清楚。同时,乏氧也是引起上皮-间质转化 (epithelial mesenchymal transition,EMT) 的一个重要途径。EMT在肿瘤转移中扮演重要角色,它 是具有极性的上皮细胞转换为活动能力强的间质 细胞并获得侵袭和迁移能力的过程。EMT表型改 变包括上皮标志物如E-钙黏素(E-cadherin)等表 达下调、间质标志物如波形蛋白(vimentin)等表 达增加[1, 2]。锌指转录因子Snail为EMT调控子,通 过与近E-cadherin基因启动子区域的E-boxes结合抑 制E-cadherin表达,诱发EMT[3]。
非小细胞肺癌(NSCLC)占肺癌的80%,是 世界范围内的主要死因之一。引起肺癌转移的一 个重要原因也不排除其他恶性实体瘤,即乏氧的 存在。目前有关肺癌EMT的研究较少。Snail与乏 氧应答中处于核心地位的乏氧诱导因子-1α(HIF- 1α)关系如何,两者在肺癌EMT中扮演何种角色 尚未见文献报道。本研究采用免疫组织化学技术 检测Snail、HIF-1α和E-cadherin在NSCLC组织中的 表达,探讨其在NSCLC中表达的临床意义及相互关 系,为防治肺癌转移提供依据。 1 资料与方法 1.1 临床资料
收集山东省肿瘤医院2010年2月1日至2011年11 月31日行根治性或姑息性切除术且临床病理资料 完整的原发肺腺癌和肺鳞癌患者切除标本62例, 患者术前均未接受放疗及化疗。研究用组织选取 需避开坏死和出血。取患者距癌组织边缘5 cm的 癌旁组织(均经病理证实无癌细胞浸润) 20例作 为对照。62例患者中,男性44例、 女性18例;患 者年龄38~75岁,平均年龄61岁,中位年龄62岁; 病理类型包括腺癌29例、鳞癌33例。无淋巴结转 移的22例、有淋巴结转移的40例。所有病例均经 病理学检查证实,并按2009年UICC分期标准进行 TNM分期。 1.2 试剂及其来源
兔抗人Snail(ab63371)多克隆抗体和鼠抗人 HIF-1α单抗(ab8366)均购自Abcam公司,兔抗人 E-cadherin多克隆抗体(sc-7870)为Santa Cruz产 品。PV-9000二步法免疫组织化学检测试剂和浓缩 型DAB试剂盒购自北京中杉金桥生物技术有限公 司。 1.3 免疫组织化学染色
4 μm厚石蜡切片脱蜡水化后进行热介导的抗 原修复。Snail和E-cadherin检测采用EDTA(pH 9.0)抗原修复,HIF-1α检测采用柠檬酸盐缓冲液 (0.01mol /L,pH6.0)抗原修复。3%H2O2室温孵 育10 min阻断内源性过氧化物酶活性。用于免疫组 织化学染色的Snail、HIF-1α和E-cadherin抗体稀释 度分别为1:500、1:50和1:100,切片与相应一抗4℃ 孵育过夜,以PBS代替一抗作为阴性对照。染色程 序按试剂盒说明书进行,DAB显色。苏木精对比 染色后将组织切片进行脱水、透明和封固处理。 1.4 结果判定
两位病理医生采用双盲法评价免疫组织化学 染色切片。结果判定依据免疫染色阳性率和强度 进行。Snail和HIF-1α以胞核出现棕黄色染色为阳 性细胞,E-cadherin以胞膜出现棕黄色染色为阳性 细胞。按染色强度的深浅评分:0分无染色;1分 淡黄色;2分棕黄色;3分棕褐色。按阳性细胞百 分比评分:1分:1%~10%;2分:>10%~50%;3 分:>50%~80%;4分:>80%。然后按照阳性细 胞与染色强弱的乘积计积分,≥4分为阳性[4]。 1.5 统计学方法
采用配对样本的Wilcoxon非参数检验比较癌组 织及癌旁正常组织表达差异,Pearson χ2 检验分析 蛋白表达与NSCLC患者临床病理因素的关系,相 关性用Spearman等级相关分析。统计软件为SPSS 13.0,统计检测均为双侧,P<0.05认为差异有统计 学意义。 2 结果 2.1 肺癌组织Snail、HIF-1α和E-cadherin蛋白表达
Snail和HIF-1α阳性表达主要位于细胞核,见 图 1~2;E-cadherin蛋白阳性表达位于细胞膜,见 图 3。62例肺癌组织Snail和HIF-1α蛋白阳性率分别 为64.5%(40/62)和59.7% (37/62),均高于癌旁 组织阳性率15.0%(3/20)和10.0%(2/20),两者 比较差异有统计学意义(均P<0.05)。E-cadherin 蛋白癌组织阳性率为54.8%(34/62),癌旁组织 为100% (20/20),两者比较差异有统计学意义 (P<0.05)。
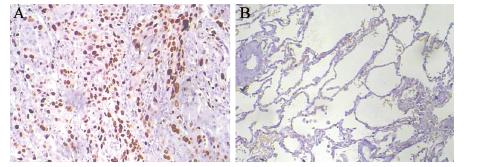
|
| A: lung cancer tissues; B: paracancerous tissues 图 1 肺癌组织和癌旁组织Snail染色结果(PV两步法×100) Figure 1 Snail staining in lung cancer tissues and paracancerous tissues(PV two-step assay ×100) |
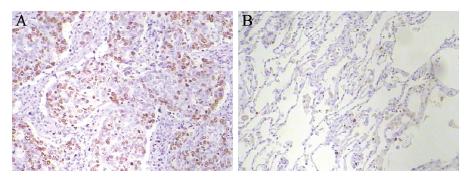
|
| A: lung cancer tissues; B: paracancerous tissuess; HIF-1α: hypoxiainduced factor-1α 图 2 肺癌组织和癌旁组织HIF-1α染色结果(PV两步法 ×100) Figure 2 HIF-1α staining in lung cancer tissues and paracancerous tissues(PV two-step assay ×100) |
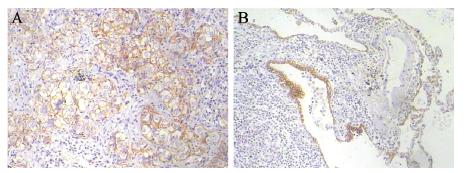
|
| A: lung cancer tissues; B: paracancerous tissue 图 3 肺癌组织和癌旁组织E-cadherin染色结果(PV两步法 ×100) Figure 3 E-cadherin staining in lung cancer tissues and paracancerous tissues(PV two-step assay ×100) |
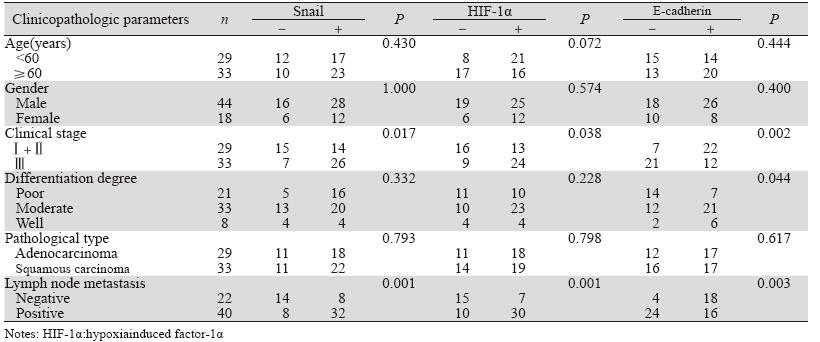
62例肺癌患者的临床病理特征,包括年龄、 性别、病理类型、组织学分级、淋巴结转移、临 床分期见表 1。分析显示,Snail和HIF-1α表达升高 及E-cadherin降低与肺癌临床分期和淋巴结转移有 关(P<0.05),E-cadherin表达降低与肺癌分化程 度有关(P=0.044)。三者与其他临床病理参数如 年龄、性别和病理类型均无关(P>0.05)。
 |
用Spearman等级相关分析,Snail和HIF-1α表 达均与E-cadherin表达呈负相关关系(r=-0.267, P=0.036;r=-0.283,P=0.026),Snail与HIF-1α表 达未见显著相关性(r=0.146,P=0.257)。 3 讨论
乏氧是引起恶性肿瘤转移增加和产生放化疗 抗拒等的重要因素。HIF-1由HIF-1α和HIF-1β亚基 构成的异二聚体,是细胞乏氧情况下调控基因表 达的主要转录因子之一。常、乏氧状态下HIF-1作 用差异主要由HIF-1α亚基的表达和活性决定[5]。 HIF-1α在多种恶性肿瘤组织高表达,它可通过上 调血管内皮生长因子(VEGF)、葡萄糖转换因子 (Glut-1)及糖酵解过程中多种关键酶基因,促进 肿瘤组织血管生成和能量代谢,在促肿瘤侵袭转 移方面起重要作用[6]。本研究结果显示,肺癌患 者癌组织HIF-1α蛋白的表达显著高于癌旁组织, 提示其与NSCLC发生有关。同时本研究还发现, NSCLC癌组织HIF-1α蛋白表达与临床分期和淋巴 结转移有关(P<0.05) ,说明HIF-1α参与NSCLC 进展和转移,HIF-1α过表达患者可能预后不良。
EMT,以上皮细胞丧失极性和获得间质特性 为主要特征,是包括NSCLC在内的多种肿瘤细胞 获得侵袭转移能力的重要机制[7, 8, 9]。E-cadherin表 达下调或丢失是EMT过程中最重要的分子事件。 E-cadherin是一类依赖Ca2+的细胞间粘连跨膜糖 蛋白分子,在维持细胞间黏附稳定性和细胞极性 方面发挥重要作用。与相应正常组织相比,多种 人类肿瘤常见E-cadherin表达完全丧失或下调,E-cadherin表达与转移潜能负相关,被视为肿瘤 抑制基因。锌指转录因子Snail为EMT强诱导子。 Cheng和Blanco等先后发现肿瘤细胞Snail表达和上 皮细胞E-cadherin表达抑制有关,进一步研究发现 Snail通过直接结合E-cadherin转录启动子E-Box区域 发挥抑制E-cadherin表达的作用,这一作用在多种 上皮源性肿瘤细胞株包括乳腺癌、胃癌、肝癌等得 到证实[10, 11]。Castro等对胃癌的研究发现,肿瘤细胞 Snail蛋白表达与胃癌EMT有关,通过抑制E-cadherin 表达,Snail蛋白可促进胃癌间质浸润和远处转移[3]。 相比于正常组织,本研究发现NSCLC癌组织Snail表 达增高,E-cadherin表达降低,提示E-cadherin低表 达和Snail高表达对肺癌发生可能起重要作用[12, 13, 14, 15]。 有报道显示Snail高表达和(或)E-cadherin低表达与 肺癌患者总生存率降低有关[13]。本研究发现,两种 蛋白表达均与患者年龄、性别、病理类型无关, 但与淋巴结转移和临床分期有关,与文献报道基 本一致[13, 14],提示Snail和E-cadherin在肺癌进展和 转移过程中可能发挥重要作用,可作为NSCLC进展 和转移的指标。
同时检测Snail、HIF-1α和E-cadherin在NSCLC 中的表达意义并评价其相关性尚未见报道。本研 究对三种蛋白进行相关分析,发现Snail和HIF- 1α表达均与E-cadherin呈负相关性(P<0.05)。 Ima i 等在卵巢癌组织也发现H I F - 1 α 核染色与 E-cadherin缺失高度相关[16]。尽管Snail和HIF-1α均 与E-cadherin表达有负相关性,但Snail与HIF-1α表 达未见相关性(P>0.05)。Hung等对87例NSCLC 患者HIF-1α、Snail和Twist表达进行检测,亦未发 现HIF-1α与Snail表达有相关性[13]。HIF-1α与Snail 的确切关系有待扩大样本例数进一步确定。
总之,本资料显示Snail和HIF-1α高表达、 E-cadherin低表达与NSCLC发生发展和转移有关, 为肺癌临床诊断和预后评估及开发新的肿瘤治疗 靶点提供了依据。
| [1] | Thompson EW, Newgreen DF, Tarin D. Carcinoma invasion andmetastasis: a role for epithelial-mesenchymal transition?[J].Cancer Res, 2005, 65(14):5991-5. |
| [2] | Thiery JP, Sleeman JP. Complex networks orchestrate epithelialmesenchymaltransitions[J]. Nat Rev Mol Cell Biol, 2006, 7(2): 131-42. |
| [3] | Castro Alves C, Rosivatz E, Schott C, et al. Slug is overexpressedin gastric carcinomas and may act synergistically with SIP1 andSnail in the down-regulation of E-cadherin[J]. J Pathol, 2007,211(5): 507-15. |
| [4] | Shi Y, Wu H, Zhang M, et al. Expression of the epithelialmesenchymaltransition-related proteins and their clinicalsignificance in lung adenocarcinoma[J]. Diagn Pathol, 2013, 8:89. |
| [5] | Semenza GL. Hypoxia-inducible factor-1: control of oxygenhomeostasis in health and disease[J]. Pediatr Res, 2001, 49(5):614-7. |
| [6] | Kaur B, Khwaja FW, Severson EA, et al. Hypoxia and thehypoxia-inducible-factor pathway in glioma growth andangiogenesis[J]. Neuro Oncol, 2005, 7(2): 134-53. |
| [7] | Christiansen JJ, Rajasekaran AK. Reassessing epithelial tomesenchymal transition as a prerequisite for carcinoma invasionand metastasis[J]. Cancer Res, 2006, 66(17): 8319-26. |
| [8] | Thiery JP. Epithelial-mesenchymal transitions in tumourprogression[J]. Nat Rev Cancer, 2002, 2(6): 442-54. |
| [9] | Berx G, Raspé E, Christofori G, et al. Pre-EMTing metastasis?Recapitulation of morphogenetic processes in cancer[J]. Clin ExpMetastasis, 2007, 24(8): 587-97. |
| [10] | Cheng CW, Wu PE, Yu JC, et al. Mechanisms of inactivationof E-cadherin in breast carcinoma: modification of the two-hithypothesis of tumor suppressor gene[J]. Oncogene, 2001, 20(29):3814-23. |
| [11] | Blanco MJ, Moreno-Bueno G, Sarrio D, et al. Correlation of Snailexpression with histological grade and lymph node status in breastcarcinomas[J]. Oncogene, 2002, 21(20): 3241-6. |
| [12] | Yanagawa J, Walser TC, Zhu LX, et al. Snail promotes CXCR2ligand-dependent tumor progression in non-small cell lungcarcinoma[J]. Clin Cancer Res, 2009, 15(22): 6820-9. |
| [13] | Hung JJ, Yang MH, Hsu HS, et al. Prognostic significance ofhypoxia-inducible factor-1alpha, TWIST1 and Snail expressionin resectable non-small cell lung cancer[J]. Thorax, 2009, 64(12):1082-9. |
| [14] | Shiwu WU, Lan Y, Wenqing S, et al. Expression and clinicalsignificance of CD82/KAI1 and E-cadherin in non-small cell lungcancer[J]. Arch Iran Med, 2012, 15(11): 707-12. |
| [15] | Zhao JQ, Sun FJ, Liu SS, et al. Expression of connexin 43 andE-cadherin protein and mRNA in non-small cell lung cancers inChinese patients[J]. Asian Pac J Cancer Prev, 2013, 14(2): 639-43. |
| [16] | Imai T, Horiuchi A, Wang C, et al. Hypoxia attenuates theexpression of E-cadherin via up-regulation of SNAIL in ovariancarcinoma cells[J]. Am J Pathol, 2003, 163(4): 1437-47. |
 2015, Vol. 42
2015, Vol. 42
