文章信息
- 曹彦坤,沈文斌,祝淑钗. 2015.
- CAO Yankun, SHEN Wenbin, ZHU Shuchai. 2015.
- 肺低剂量区体积预测胸中下段食管癌放射性肺炎的价值
- Low Dose Volume of Lung in Predicting Acute Radiation Pneumonitis in Patients with Middle and Lower Thoracic Esophageal Cancer
- 肿瘤防治研究, 2015, 42(01): 32-36
- Cancer Research on Prevention and Treatment, 2015, 42(01): 32-36
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.01.008
-
文章历史
- 收稿日期:2013-10-24
- 修回日期:2013-11-13
在临床上尽管对接受三维适形放疗食管癌患 的肺V20、V25、V30及双肺平均剂量(mean lung dose,MLD)等常规指标进行了有效地剂量 控制,但仍有部分患者发生放射性肺炎(radiation pneumonitis,RP)。研究表明,以往被多数临床医 师忽略的肺低剂量区体积指标如V5、V10及V15等 同样对RP的发生有显著影响。为此,我们对在河 北医科大学第四医院接受放射治疗的205例胸中下 段食管癌患者进行分析,主要分析肺低剂量区体积 指标在预测胸中下段食管癌中发生RP的价值。 1 资料与方法 1.1 临床资料
2003年1月—2007年6月,205例未经治疗的胸 中下段食管癌患者于河北医科大学第四医院放疗科 接受放疗。其中男137例,女68例,年龄37~80岁, 中位年龄68岁;胸中段159例、胸下段46例;KPS 评分均≥70分;全组患者均为食管鳞状细胞癌;所 有病例均为初治患者,均有完整的住院病历资料。 据1997年国际抗癌联盟组织(union for international cancer control,UICC)提出的分期标准为:Ⅰ期43 例、Ⅱ期56例、Ⅲ期95例、Ⅳ期11例。 1.2 放射治疗计划
CT模拟机下扫描定位,所得图像进入三维适 形治疗计划系统(美国CMS公司Focus3.0)。勾 画食管病变同时包括纵隔内肿大淋巴结定义为肿 瘤靶区(gross tumor volume,GTV);GTV前后左 右方向各外放0.5~0.8 cm,上下方向各外放2.0~3.0 cm为临床靶区(clinical target volume,CTV); CTV再均匀外放0.5~1.0 cm为计划靶区(planning target volume,PTV)。同时勾画邻近组织和器官如 脊髓、气管、心脏及双侧肺。采用6MVX线西门子 直线加速器实施治疗。全组患者处方剂量(50~70) Gy/(25~35)次,5~7周,中位剂量64 Gy。 1.3 化疗
全组205例患者中接受化疗30例,化疗疗程 为1~6周期,中位4周期,化疗方案以“顺铂”为基 础,主要有LFP(亚叶酸钙200 mg/次,d1~5,替 加氟1 g/次,d1~5,顺铂20 mg/次,d1~5)和TP (紫杉醇240 mg次,d1,顺铂20 mg/次,d1~5)方 案。30例患者中接受同步放化疗患者11例,序贯 放化疗者19例。 1.4 物理指标
由横切面等剂量分布图、剂量体积直方图 (dose volume histogram,DVH)评价治疗计划。 观察并记录两侧肺接受5、10、15Gy照射时的肺体 积占全肺总体积的百分比(V5、V10、V15)及双 肺受照平均剂量(MLD);GTV长度、最大横径 及体积,PTV的长度及体积,适形计划射野数。 1.5 放射性肺损伤评价标准
依据美国肿瘤放射治疗协作组织(radiaion therapy oncology group,RTOG)放射性损伤评价标 准,将发生在放疗开始后90天内的放射性肺损伤 称为急性放射性肺炎,发生在90天以后者称为后 期放射性损伤即放射性纤维化[1]。急性放射性肺炎 影像学诊断依据参考文献[2]。根据临床症状严重程 度按RTOG标准分为0~4级,笔者仅分析≥2级需积 极治疗的急性放射性肺炎。 1.6 随访情况
随访截至2012年12月31日,最长随访期86 月,中位随访期25月,随访率为100%。所有入 组患者在治疗后至随访结束期间均行2~7次胸部X 线、CT或薄层CT检查。 1.7 统计学方法
采用SPSS 11.5统计软件进行分析,计数资料 组间比较采用χ2检验,临床和物理参数剂量资料比 较采用Mann-Whithey检验,与放射性肺损伤相关 影响因素的分析采用Logistic多因素回归分析。检 验水准α=0.05。以不同的检测值为临界点,以每 个临界点对应的敏感度为纵坐标,1−特异度为横 坐标作图得到ROC曲线,算出不同临界点时ROC 曲线下的面积(area under the curve,AUC)、敏感 度、特异性,取AUC值最大时曲线图中最左上方 的点对应的值为诊断最佳临界值。 2 结果 2.1 全组患者出现RP的结果
全组患者出现≥2级RP的患者为60例,占 29.27%(60/205),其中2级48例(23.41%),3 级10例(4.88%),4级2例(0.98%)。 2.2 影响患者≥2级RP的单因素分析结果
单因素分析结果显示食管癌病变X线长度、 GTV最大横径、GTV长度、射野数、双肺MLD、 GTV体积、PTV体积、肺V5、肺V10和肺V15均影 响患者≥2级RP的发生,见表 1。
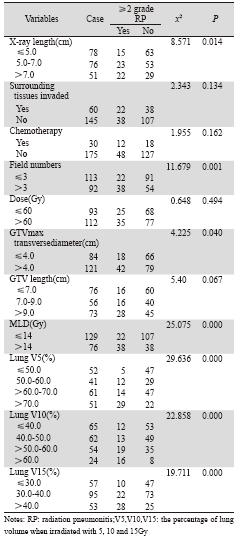 |
将可能影响患者发生RP的相关物理及临床指 标进行分析,结果显示不同范围值内的食管病变X 线长度、射野数、GTV最大横径、双肺MLD、肺 V5、肺V10和肺V15患者≥2级RP的发生率有显著 性差异,见表 2。
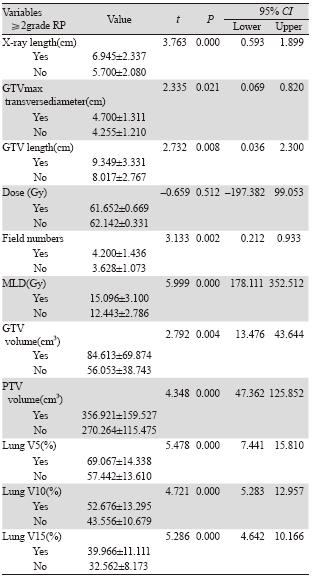 |
多因素分析结果显示射野数、双侧肺脏MLD 及肺V5为患者≥2级RP发生的独立影响因素(P均 <0.05),见表 3。
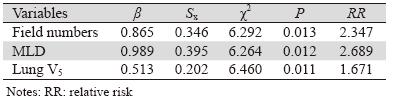 |
以V5为检测变量,以分组为状态变量,定状 态变量值为l,建立ROC曲线。结果显示V5预测放 射性肺炎的ROC曲线下的面积为0.712,曲线下面 积的95%可信区间为0.633~0.791,差异具有统计学 意义(P<0.05)。取曲线最左上方的点,即:敏感度与特异性之和最大为最佳临界点,结果提示V5 的临界值为51.17%,以V5≤51.17%预测放射性肺 炎,敏感度为91.7%,特异性为66.2%,见图 1。
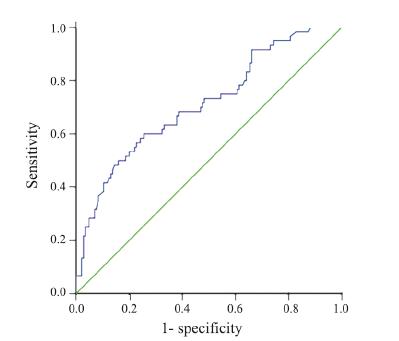
|
| 图 1 胸中下段食管癌患者肺V5预测RP的ROC曲线(误判率=1-特异度) Figure 1 ROC curves of RP predicted by lung V5 middle and lower thoracic esophageal cancer(error rate =1−specificity) |
RP是胸部肿瘤放射治疗重要剂量限制性因素 之一,影响RP发生的临床、物理学因素多种多 样,其中肿瘤的解剖位置也为其影响因素之一。 对于食管癌,从解剖位置看,不同部位食管癌放 射性肺损伤的发生率应有所不同,由于肺呈上尖 下圆的形状,肺受照剂量的容积在中胸段食管癌 放疗时较上胸段时的高,因此中胸段食管癌放疗 其RP发生率较上胸段高。目前,对于RP的诊断标准也不尽相同,多数文献应用的诊断标准主要有: 根据1995年RTOG制定的RP分级标准[3],改良NCICTC( national institutes of health common toxicity criteria for adverse events)2.0~4.0评分标准[4],WHO 毒性评价标准[5]和影像学评价标准等[2, 6]。本研究全 组患者放疗后出现≥2级RP的比率为29.27%,其中 2级RP为23.41%,3级为4.88%,4级为0.98%。这 与Asakura等[7]对37例接受放化疗的食管癌患者发 生RP的研究结果相似,其结果表明2级RP发生率 为27%,3级RP为5%,无4级RP发生,而有3%的 患者出现5级RP。
本研究结果显示,患者多个临床、物理学 指标如食管病变X线长度、GTV横径、GTV长 度、GTV/PTV体积、射野数、双肺MLD及双肺 V5~V15等均与RP的发生相关,这与我们以前的研 究结果相似[8, 9, 10],也与王澜等[11]对胸部肿瘤放疗发 生RP的研究结果相似。适形放疗计划的剂量—体 积直方图(dose-volume histogram,DVH)为评 估RP发生的重要工具之一,既往研究结果显示与 剂量-体积相关的肺V20、V25、V30及MLD的大 小均与RP肺炎发生有显著相关性[6, 7, 8, 9, 10, 11, 12, 13]。然而,在临 床上即使放疗医师在制定治疗计划时将肺V20、 V25、V30及MLD等重要影响患者RP指标数值, 同样也有部分患者会出现RP。近年来,研究结果 显示肺低剂量区体积如肺V5~V15尤其是V5同样对 胸部肿瘤RP的发生有着重要的作用。Wang等[13]研 究223例同期放化疗的非小细胞肺癌患者发生RP的 情况,结果表明RP与肺V5~V65高度相关,其多 因素分析结果显示肺V5为≥3级RP的独立影响因 素。Tanabe等[14]对86例局部晚期食管癌患者的RP发 生情况进行分析,结果显示肺V5和V10为患者RP 发生的主要影响因素。Yamashita等[15]研究结果显 示MLD、V5~V20与放射性肺损伤相关,且与V5 相关性最大。本文作者在以往文献中[8]分析对接受 放射治疗的食管癌患者的肺低剂量区体积对RP影 响一文中同样得出肺V5为≥2级RP的独立影响因 素。为进一步明确肺低剂量体积在食管癌放疗所 致RP的预测作用,本次对205例接受放疗的胸中下 段食管癌患者发生RP的情况进行了分析,结果同 样表明肺V5为患者发生RP的独立预后影响因素。 为了进一步明确V5预测RP的效能,我们进行了V5 的ROC曲线分析,结果提示V5的临界值为51.17% 时患者发生RP的差异有显著性,此时ROC曲线 下的面积为0.712,95%可信区间为0.633~0.791。 进一步分析结果显示,在V5≤51.17%组有5例 患者出现RP,发生率为9.3%(5/54),而V5> 51.17%组有55例患者出现RP,发生率为36.4% (55/151),两组患者RP发生率差异具有统计学 意义(χ2=14.178,P=0.000)。这与Tanabe等[14]认 为肺V5应该≤55%和Asakura等[7]认为V5的临界值 为54%的结果相似。
总之,RP为胸部食管癌主要剂量限制性因素 之一,影响其发生、发展的因素也多种多样,通 过本研究,我们认为肺低剂量区体积V5为接受放 疗的胸中下段食管癌患者发生RP的重要预测因素 之一,建议在以后制定胸中下段食管癌的放射治 疗计划时应该予以重视,同时建议将V5联合其他 剂量-体积指标来降低或消除RP的发生率。
| [1] | Xu G, Li XM. The advances in the study of radiationpneumonitis[J]. Zhong Liu Fang Zhi Yan Jiu, 2005, 32(4):251-3.[徐钢, 李先明. 放射性肺炎的研究进展[J]. 肿瘤防治研究, 2005, 32(4): 251-3.] |
| [2] | Ding W, Guo Y. Radiation induced lung injury[J]. Yi Xue YingXiang Xue Za Zhi, 2005, 15(9): 813-6.[丁文, 郭岩. 放射性肺损伤[J]. 医学影像学杂志, 2005, 15(9): 813-6.] |
| [3] | Yin WB, Gu XZ. Radiation oncology (third edition) [M]. Beijing:Peking Union Medical College Press, 2002:1108-10.[殷蔚伯, 谷铣之. 肿瘤放射治疗学(第3版)[M]. 北京: 中国协和医科大学出版社, 2002: 1108-10.] |
| [4] | Hirota S, Tsujino K, Endo M, et al. Dosimetric predictors ofradiation esophagits in patients treated for non-small-cell lungcancer with carboplatin/paclitaxel/radiotherapy[J]. Int J RadiatOncol Biol Phys, 2001, 51(2): 291-5. |
| [5] | Miller AB, Hoogstraten B, Staquet M, et al. Reporting results ofcancer treatment[J]. Cancer, 1981, 47(1): 207-14. |
| [6] | Hart JP, McCurdy MR, Ezhil M, et al. Radiation pneumonitis:correlation of toxicity with pulmonary metabolic radiationresponse[J]. Int J Radiat Oncol Biol Phys, 2008, 71(4): 967-71. |
| [7] | Asakura H, Hashimoto T, Zenda S, et al. Analysis of dose-volumehistogram parameters for radiation pneumonitis after definitiveconcurrent chemoradiotherapy for esophageal cancer[J]. RadioOncol, 2010, 95(2): 240-4. |
| [8] | Shen WB, Zhu SC, Gao HM, et al. Low dose volume histogramanalysis of the lungs in prediction of acute radiation pneumonitisin patients with esophageal cancer treated with three-dimensionalconformal radiotherapy[J]. Zhonghua Zhong Liu Za Zhi, 2013,35(1): 45-9.[沈文斌, 祝淑钗, 高红梅, 等. 肺脏低剂量区体积预测食管癌三维适形放疗所致急性放射性肺炎的价值[J]. 中华肿瘤杂志, 2013, 35(1): 45-9.] |
| [9] | Shen WB, Zhu SC, Li R, et al. Predictors of radiation-induced lungtoxicties in patients with thoracic middle and lower esophagealcancer treated with three-dimensional conformal radiotherapy[J].Zhonghua Fang She Zhong Liu Xue Za Zhi, 2007, 16(5):335-40.[沈文斌, 祝淑钗, 李任, 等. 胸中下段食管癌三维适形放疗所致放射性肺损伤相关因素分析[J]. 中华放射肿瘤学杂志,2007, 16(5): 335-40.] |
| [10] | Zhu SC, Shen WB, Liu ZK, et al. Dosimetric and clinicalpredictors of radiation-induced lung toxicity in esophagealcarcinoma[J]. Tumori, 2011, 97(5): 596-602. |
| [11] | Wan L, Li XN, Lv DJ, et al. Low dose volume of the lung inprediction of acute radiation pneumonitis[J]. Zhonghua Fang SheZhong Liu Xue Za Zhi, 2010, 19(4): 296-300.[王澜, 李晓宁, 吕冬捷, 等. 肺低剂量区体积预测急性放射性肺炎价值探讨[J]. 中华放射肿瘤学杂志, 2010, 19(4): 296-300.] |
| [12] | Kumar G, Rawat S, Puri A, et al. Analysis of dose-volumeparameters predicting radiation pneumonitis in patients withesophageal cancer treated with 3D-conformal radiation therapy orIMRT[J]. Jpn J Radiol, 2012, 30(1): 18-24. |
| [13] | Wang SL, Liao Z, Vaporciyan AA, et al. Investigation of clinicaland dosimetric factors associated with postoperative pulmonarycomplications in esophageal cancer patients treated withconcurrent chemoradiotherapy followed by surgery[J]. Int J RadiatOncol Biol Phys, 2006, 64(3): 692-9. |
| [14] | Tanabe S, Myojin M, Shimizu S,et al. Dose-volume analysis forrespiratory toxicity in intrathoracic esophageal cancer patientstreated with definitive chemoradiotherapy using extended fields[J].J Radiat Res, 2013, 54(6): 1085-94. |
| [15] | Yamashita H, Nakagawa K, Nakamura N, et al. Exceptionally highincidence of symptomatic grade 2-5 radiation pneumonitis afterstereotactic radiation therapy for lung tumors[J]. Radiat Oncol,2007, 2: 21. |
 2015, Vol. 42
2015, Vol. 42


