文章信息
- 郭智珍,宫剑,王建功,刘卫东,胡万宁,邢树山. 2015.
- GUO Zhizhen, GONG Jian, WANG Jiangong, LIU Weidong, HU Wanning, XING Shushan. 2015.
- 胶质瘤细胞中IL-1RAP的作用及其与STAT3的关系
- Role of IL-1RAP in Gliomas Cells and Its Relationship with STAT3
- 肿瘤防治研究, 2015, 42(01): 23-27
- Cancer Research on Prevention and Treatment, 2015, 42(01): 23-27
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.01.006
-
文章历史
- 收稿日期:2013-11-26
- 修回日期:2014-03-03
2.100050 北京,首都医科大学附属北京天坛医院神经外科;
3.063000 唐山,河北联合大学附属唐山市人民医院生物治疗科;
4.063000 唐山,河北联合大学附属唐山市人民医院放化科
2. Department of Pediatric Neurosurgery, Beijing Tiantan Hospital, Capital Medical University, Beijing 100050, China;
3. Department of Biotherapy, Tangshan People's Hospital, Hebei United University, Tangshan 063000, China;
4. Department of Radiochemotherapy, Tangshan People's Hospital, Hebei United University, Tangshan 063000, China
胶质瘤亦称神经胶质细胞瘤,是最常见的颅 内恶性肿瘤(约占60%),具有发病率、复发率、 死亡率高和治愈率低等特点,即使手术切除结合 综合治疗,平均带瘤生存时间超过5年的却不到 50%[1],是威胁人类生存的神经系统主要疾病之 一。目前对于影响胶质瘤预后的具体分子生物学 机制尚不清楚。
近年来,感染性炎症因子、细胞因子以及细胞 因子间的网络调控在肿瘤的发生发展中越来越受到 重视。白介素1受体辅助蛋白(interleukin 1 receptor accessory protein,IL-1RAP)是IL-1信号通路的一种辅助蛋白[2],本课题组既往研究发现IL-1RAP在胶 质瘤中有明显抑癌作用[3]。信号转导和转录活化因 子3( signal transducers and activators of transcription 3,STAT3)是一种转录因子,在调节细胞多种 生物学功能方面起重要作用。本研究将在既往研 究的基础上进一步在胶质瘤细胞系U251中验证IL- 1RAP的抑癌作用及其与STAT3的相关机制。 1 材料和方法 1.1 材料
人神经胶质细胞瘤U251细胞购自中国医学科 学院基础医学研究所细胞中心,IL-1RAP抗体、二 抗购自英国Abcam公司,STAT3抗体购自美国CST 公司。Protein A/G agarose、凋亡和周期试剂盒购 自美国Invitrogen公司。RIPA试剂购自中国碧云天 公司。DH5α感受态细胞、LB培养液、kana+抗生 素、BHI琼脂平板培养液、BCA蛋白定量试剂盒 均购自中国普利来公司。FITC和TRITC标记的二 抗购自中国中杉金桥公司。TurboFect Transfection Reagent转染试剂购自加拿大Fermantas公司。细胞 用血清和培养液购自美国Gibco公司。质粒提取并 去除内毒素试剂盒(EndoFee Plasmid Mini Kit)购 自美国Omega公司。 1.2 IL-1RAP质粒制备和转染
IL-1RAP质粒的构建与质检均由Origin公司完 成,并出具质检报告。质检方法为利用构建的质 粒与空质粒分别转染HEK239细胞,再利用PCR和 Western blot检测IL-1RAP的RNA和蛋白表达情况。 经检测转染构建质粒组IL-1RAP的RNA和蛋白均表 达,表明质粒制备及转染成功。
利用IL-1RAP质粒转化DH5α感受态细胞, 将转化的菌液按照1:100体积接种于kana+抗性LB 培养液中,37℃摇床培养10 h。取10 ml菌液, 按照质粒提取并去除内毒素试剂盒(EndoFee Plasmid Mini Kit)说明书操作。将洗脱下的 DNA定量-20℃分装保存用于转染。并利用PCR 对质粒进行鉴定,IL-1RAP引物序列:上游: 5’-TATGCCTGCCTTTGGTAC-3’;下游:5’-CATT TCCCTTGAATGTTCT-3’。
根据TurboFect Transfection Reagent试剂说明 书,将U251细胞以每孔2×105个细胞的密度均匀种 植于6孔板中,37℃培养12 h。按照每孔50 μl无血 清MEM培养液与5 μl转染试剂和3 μl质粒的混合物 进行转染,以空载体作为阴性对照,以荧光显微 镜观察GFP标签表达情况计算转染效率。转染质粒 37℃培养12 h进行下一步实验。将6孔板中转染IL- 1RAP质粒的U251细胞在荧光显微镜高倍视野下 (×400)观察,于可见光下固定一个视野,计数 细胞总数,转换荧光光源计数携带GFP绿色荧光的 细胞数,转染效率=有荧光表达的细胞数/细胞总 数×100%,每孔细胞随机选择5个观察视野,重复 3次[4]。 1.3 流式细胞分析IL-1RAP对U251细胞周期的影响
将转染IL-1RAP质粒和空载体的U251,用胰 酶消化细胞,清洗,重悬细胞,加入1 ml 70%乙醇 中-20℃固定过夜。收集细胞并重悬。每管细胞样 品中加入0.5 μl碘化丙啶(PI)染色液,37℃避光 温浴30 min。冰浴避光存放。流式细胞仪分析时以 未作处理的U251细胞圈门,通过流式细胞仪分析 对比转染IL-1RAP组和转染空质粒的对照组各设3 个平行对照。 1.4 流式细胞分析IL-1RAP对U251细胞凋亡的影响
将转染IL-1RAP质粒和空载体的U251,用 胰酶消化细胞,清洗,重悬细胞,取1×105的细 胞,加入195 μl Annexin V-FITC结合液重悬。并 加入5 μl Annexin V-FITC,加入10 μl PI染色液, 轻轻混匀,避光放置室温孵育30 min。流式细胞 仪分析时以未作处理的U251细胞圈门,通过流式 细胞仪分析对比转染IL-1RAP组和转染空质粒的 对照组各设3个平行对照。 1.5 免疫共沉淀分析IL-1RAP与STAT3的关系
RIPA裂解液在使用前数分钟内加入PMSF, 使PMSF的最终浓度为1 mM。去除转染过后U251 细胞培养液,用PBS液洗一遍,按照6孔板每孔 加入200 μl裂解液的比例加入裂解液。蛋白样品 应用BCA法进行定量。每1 ml总蛋白中加入100 μl Protein A/G agarose,4℃摇晃1 h,以去除非 特异性杂蛋白,去除Protein A/G珠子。上清液加 入IL-1RAP抗体和STAT3抗体各5 μl并加入100 μl Protein A/G agarose,4℃缓慢摇动抗原抗体混合 物过夜。收集琼脂糖珠-抗原抗体复合物,去上清 液。用60 μl 2×上样缓冲液将琼脂糖珠-抗原抗体 复合物悬起,轻轻混匀,将样品煮10 min。收集 上清液,将上清液电泳。 1.6 免疫荧光检测IL-1RAP与STAT3的共定位
将转染后的U251细胞用PBS洗3次。加入4%多 聚甲醛200 μl于4℃固定20 min。在固定好的细胞中 加入200 μl的0.5% Triton X-100于4℃通透15 min。 用3% BSA于37℃封闭1h,洗净封闭液。加入IL- 1RAP抗体和STAT3一抗于4℃孵育过夜。加入FITC和TRITC标记的二抗37℃避光孵育30 min,此步骤 之后尽量避光操作。用甲醇稀释的DAPI洗一次, 加入新的甲醇稀释的DAPI于37℃避光孵育10 min甲 醇,用甲醇洗一次。稍晾干后用 50%甘油封片。激 光共聚焦显微镜镜检。 1.7 统计学方法
用SPSS19.0 软件进行t检验,比较细胞周期和 细胞凋亡数据,P<0.05为差异有统计学意义。 2 结果 2.1 IL-1RAP转染效率计算结果
根据流式细胞仪检测结果计算IL-1RAP质粒在 U251细胞中的转染效率为(56.9±5.1)%。 2.2 流式细胞仪分析IL-1RAP对U251细胞形态学的影响情况
流式细胞仪分析发现转染IL-1RAP组细胞凋亡 百分比为(52.10±5.51)%,而转染空质粒的对照组细 胞凋亡百分比为(7.57±0.54)%。转染IL-1RAP组细 胞凋亡百分比明显增加(P<0.05),见图 1。
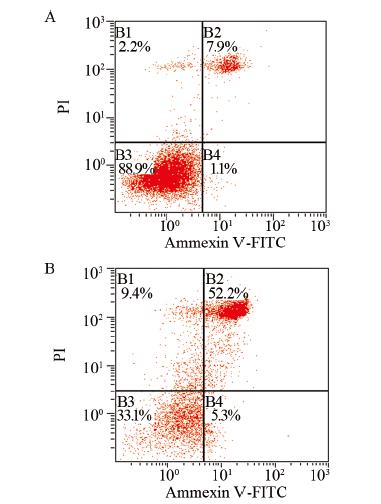
|
| A: transfected with blank plasmid; B: transfected with IL-1RAP 图 1 转染IL-1RAP对U251细胞凋亡的影响 Figure 1 The impact of IL-1RAP transfection on U251 cell apoptosis |
流式细胞仪分析发现,转染IL-1RAP组细胞S 期细胞百分比为(68.22±1.96)%而转染空质粒的 对照组细胞S期细胞百分比为(38.31±7.22)%。 转染IL-1RAP组细胞S期百分比明显增加,转染IL- 1RAP使细胞停留在S期抑制其进一步的细胞分裂 (P<0.05),见图 2。

|
| A:transfected with blank plasmid;B:transfected with IL-1RAP 图 2 转染IL-1RAP对U251细胞周期的影响 Figure 2 The impact of IL-1RAP transfection on U251 cells cycle |
IL-1RAP抗体和STAT3抗体分别钓取转染IL- 1RAP组和转染空白质粒组细胞总蛋白,IL-1RAP 抗体在转染组钓取到STAT3和IL-1RAP,说明存 在IL-1RAP的情况下STAT3可以和IL-1RAP结合。 STAT3抗体在转染组钓取到STAT3和IL-1RAP说明 存在STAT3的情况下IL-1RAP可以和STAT3结合, 并且转染IL-1RAP后STAT3表达量有所提高。通过 免疫共沉淀证实了IL-1RAP和STAT3之间在细胞内 可以相互结合。在转染空白质粒组利用STAT3抗体 钓取到STAT3蛋白说明STAT3在未转染IL-1RAP的 胶质瘤细胞系U251中也有表达,而IL-1RAP几乎 没有表达,见图 3。

|
| A: transfected with blank plasmid; B: transfected with IL-1RAP 图 3 IL-1RAP和STAT3免疫共沉淀结果 Figure 3 Co-immunoprecipitation of IL-1RAP and STAT3 |
在免疫荧光共定位实验中,利用激光共聚 焦显微镜观察,IL-1RAP与FITC标记的二抗相结 合,在波长495 nm的激光下观察产生绿色荧光; STAT3与TRITC标记的二抗相结合,在波长550 nm 的激光下观察产生橘红色荧光;细胞核与DAPI相结合,在波长340 nm的激光下观察产生蓝色荧 光。通过激光共聚焦显微镜观察,在转染IL-1RAP 组,代表STAT3表达水平的橘红色荧光与明场视 野基本一致,说明STAT3为全细胞表达,代表IL- 1RAP表达水平的绿色荧光与代表细胞核的蓝色荧 光视野一致说明IL-1RAP为细胞核表达,绿色荧光 与橘红色荧光较强的部位视野一致说明二者有共 定位信号,见图 4-1。在转染空白质粒的对照组可 见橘红色荧光说明有STAT3表达;但是未见绿色 荧光说明未见IL-1RAP表达,见图 4-2。
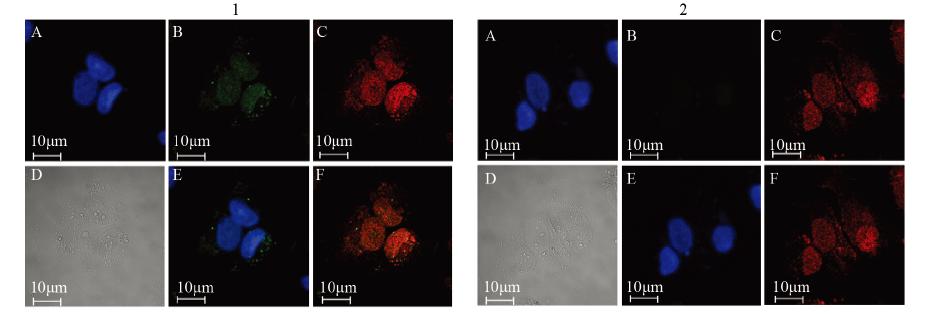
|
| A: DAPI; B:IL-1RAP; C: STAT3; D: Bright field; E: DAPI+IL-1RAP; F: IL-1RAP+STAT3; 1: transfected with IL-1RAP; 2: transfected with blank plasmid 图 4 免疫荧光检测STAT3与IL-1RAP共定位 Figure 4 Colocalization of STAT3 and IL-1RAP detected by immunofluorescence |
IL-1RAP是IL-1信号通路的一种辅助蛋白。近 年来,对IL-1RAP的研究主要集中于其在IL-1信号 转导通路中的作用[2],其抗肿瘤作用却报道不多。 Kim等[5]曾报道在肾癌IL-1RAP的表达水平镜像反 映了Wilms’肿瘤抑制基因(WT1)的表达水平。 Järås等[6]研究发现利用单克隆抗体靶向IL-1RAP能 够对慢性粒细胞白血病干细胞产生杀伤作用。有 报道称IL-1RAP可以使免疫器官更加敏感从而提 高免疫反应和免疫应答[7]。本课题组既往研究证实 IL-1RAP在儿童低级别胶质瘤中表达水平明显高于 成人低级别胶质瘤,并发现IL-1RAP在胶质瘤中 具有抑癌作用[3]。本研究利用IL-1RAP转染U251细 胞发现转染IL-1RAP组细胞凋亡百分比为(52.10 ±5.51)%,而转染空质粒的对照组细胞凋亡百分 比为(7.57±0.54)%。说明转染IL-1RAP可以明显 促进细胞凋亡(P<0.05)。转染IL-1RAP组细胞S 期百分比为(68.22±1.96)%,而转染空质粒的对 照组细胞S期百分比为(38.31 ±7.22)%。转染IL- 1RAP组细胞S期百分比明显增加,转染IL-1RAP可 以使细胞停留在S期抑制其进一步的细胞分裂。转 染IL-1RAP主要造成细胞的S期阻滞(P<0.05)。 结合以上结果表明IL-1RAP的核定位后抑制了细胞 的分裂,从而导致了U251细胞的凋亡。在进一步 的研究中我们发现转染后IL-1RAP主要表达于U251 细胞的细胞核,这与本课题组既往报道的IL-1RAP 在胶质瘤组织中的表达定位一致[3]。通常情况下 IL-1RAP通过分泌到细胞外发挥其生物学功能[8], 然而无论是在胶质瘤组织中还是在胶质瘤细胞系 U251细胞中IL-1RAP均为胞核表达。一般认为核 定位信号(NLS)是核内功能蛋白进入细胞核的 结构基础[9]。由于常规核定位信号序列在构成特点 上具有明显的规律性,因而通过生物信息学的手 段容易预测[10],而通过生物信息学的手段预测IL- 1RAP蛋白没有细胞核定位信号。
STAT3是一种在调节发育、分化、增殖和 细胞凋亡等生物学功能方面起重要作用的转录 因子[11]。Dasgupta等[12]的研究发现在异常活化的 STAT3不仅导致肿瘤发生,而且还通过抑制细胞 免疫使肿瘤细胞免疫逃逸。另一方面STAT3作为 细胞自我改造的一种代偿性、适应性的反应抑制 细胞生长的功能,减缓肿瘤形成过程。STAT3在 某些情况下还有促进细胞死亡的作用,从而揭 示了STAT3有潜在的肿瘤抑制功能。当乳腺上皮 细胞缺乏STAT3时细胞凋亡明显抑制[13]。本研究 中发现STAT3和IL-1RAP在U251细胞系中具有共 定位信号,并且能够相互结合。研究证实STAT3 能够促进神经干细胞分化为星形胶质细胞[14]。在 STAT3基因对胶质瘤影响的研究中发现,过量表 达STAT3可以促使胶质母细胞瘤沿着星形胶质细 胞方向分化。敲除STAT3的星形胶质细胞与STAT3过表达的星形胶质细胞相比,其增殖和侵袭的能 力都有明显的增强,表明STAT3有抑制星形胶质 细胞的增殖和侵袭的作用[14]。本研究中发现在未 转染IL-1RAP的胶质瘤细胞中也有STAT3表达, 但并未引起胶质瘤细胞的凋亡和细胞周期阻滞现 象,而转染IL-1RAP后STAT3的表达水平亦有提高 并且出现了胶质瘤细胞的凋亡和细胞S期阻滞。说 明在胶质瘤细胞中STAT3与IL-1RAP结合发挥作用 引起了胶质瘤细胞的凋亡和细胞周期阻滞,二者 之间可能存在反馈调节机制。目前认为二聚化的 STAT3可以进入细胞核,结合在基因启动子的特 定序列上,通过与其他转录调控元件的相互作用 来调控基因的表达[15]。在没有信号分子刺激的情 况下,STAT3分子主要分布在胞质中。受IL-6等细 胞因子的刺激后,数分钟内发生磷酸化而聚集在 细胞核内 [16],而IL-1RAP可以促进IL-6的产生[17]。 经典NLS包括一段单价的碱性氨基酸或双价的碱 性氨基酸[18]。STAT3的DNA结合域具有一段这样 的序列。但是STAT3与IL-1RAP在低级别胶质瘤中 的具体作用机制还有待我们进一步研究。
综上所述,本研究发现IL-1RAP有抑制胶质瘤 细胞增殖、促进细胞凋亡的作用。IL-1RAP可能通 过与STAT3相互作用进入细胞核进一步发挥其生物 学作用。由此推测 IL-1RAP 和STAT3在胶质瘤的 发生、发展过程中发挥了重要作用,可为胶质瘤 的治疗提供客观依据和可能的药物靶点。
| [1] | Zhang J. Deep and comprehensive treatment of glioma[J].Zhonghua Shen Jing Wai Ke Za Zhi, 2003, 19(1): 1-2. [张纪. 深入开展胶质瘤综合治疗及其基础研究[J]. 中华神经外科杂志,2003, 19(1): 1-2.] |
| [2] | Huang J, Gao X, Li S, et al. Recruitment of IRAK to theinterleukin 1 receptor complex requires interleukin 1 receptoraccessory protein[J]. Proc Natl Acad Sci U S A, 1997, 94(24):12829-32. |
| [3] | Xing SS, Hu WN, Zhao XQ, et al. Interleukin 1 receptor accessoryprotein contributes to children and adult low grade gliomas[J].Shou Du Yi Ke Da Xue Xue Bao, 2013, 34(2): 258-63. [邢树山,胡万宁, 赵喜庆, 等. 白介素1受体辅助蛋白在儿童和成人低级别胶质瘤中的作用[J]. 首都医科大学学报, 2013, 34(2): 258-63.] |
| [4] | Erfle H, Simpson JC, Bastiaens PI, et al. siRNA cell arrays forhigh-content screening microscopy[J]. Biotechniques, 2004,37(3): 454-8, 460, 462. |
| [5] | Kim HS, Kim MS, Hancock AL, et al. Identification of novelWilms’ tumor suppressor gene target genes implicated in kidneydevelopment[J]. J Biol Chem, 2007, 282(22):16278-87. |
| [6] | J?r?s M, Johnels P, Hansen N, et al. Isolation and killing ofcandidate chronic myeloid leukemia stem cells by antibodytargeting of IL-1 receptor accessory protein[J]. Proc Natl Acad SciU S A, 2010, 107(37): 16280-5. |
| [7] | Y?lmaz-Eli? AS, Aartsma-Rus A, 't Hoen PA, et al. Inhibitionof IL-1 signaling by antisense oligonucleotide-mediated exonskipping of IL-1 receptor accessory protein (IL-1RAcP)[J]. MolTher Nucleic Acids, 2013, 2: e66. |
| [8] | Jensen LE, Muzio M, Mantovani A, et al. IL-1 signaling cascadein liver cells and the involvement of a soluble form of the IL-1receptor accessory protein[J]. J Immunol, 2000, 164(10): 5277-86. |
| [9] | Lu Q, Lu Z, Liu Q, et al. Chromatin-bound NLS proteins recruitmembrane vesicles and nucleoporins for nuclear envelopeassembly via importin-α/β[J]. Cell Res, 2012, 22(11): 1562-75. |
| [10] | Zhou M, Li XL, Li GY. Molecular mechanism and progress ofprotein transport from cytoplasm to nucleus[J]. Zhongguo ShengWu Hua Xue Yu Fen Zi Sheng Wu Xue Bao, 2006, 22(10):780-6.[周鸣, 李小玲, 李贵源. 蛋白质入核转运的机制和研究进展[J].中国生物化学与分子生物学报, 2006, 22(10): 780-6. ] |
| [11] | Stine RR, Matunis EL. JAK-STAT signaling in stem cells[J]. AdvExp Med Biol, 2013, 786: 247-67. |
| [12] | Dasgupta A, Raychaudhuri B, Haqqi T, et al. Stat3 activation isrequired for the growth of U87 cell-derived tumours in mice[J].Eur J Cancer, 2009, 45(4): 677-84. |
| [13] | Casanova JL, Holland SM, Notarangelo LD. Inborn errors ofhuman JAKs and STATs[J]. Immunity, 2012, 36(4): 515-28. |
| [14] | de la Iglesia N, Konopka G, Puram SV, et al. Identification ofa PTEN-regulated STAT3 brain tumor suppressor pathway[J].Genes Dev, 2008, 22(4): 449-62. |
| [15] | Darnell JE Jr. STATs and gene regulation[J]. Science, 1997,277(5332): 1630-5. |
| [16] | Nigg EA.Nucleocytoplasmic transport: signals, mechanisms andregulation[J]. Nature, 1997, 386(6627): 779-87. |
| [17] | Sha Y, Markovic-Plese S. A role of IL-1R1 signaling in thedifferentiation of Th17 cells and the development of autoimmunediseases[J]. Self Nonself, 2011, 2(1): 35-42. |
| [18] | Fagerlund R, Mélen K, Kinnunen L, et al. Arginine/lysine-richnuclear localization signals mediate interactions between dimericSTATs and importin alpha 5[J]. J Biol Chem, 2002, 277(33):30072-8. |
 2015, Vol. 42
2015, Vol. 42


